线粒体DNA D-Loop区突变与弱精症的相关性
2023-12-21陈孟权单婷婷黄蕊孔万仲
陈孟权,单婷婷,黄蕊,孔万仲
1.温州市中医院 检验科,浙江 温州 325000;2.浙江中医药大学 医学技术与信息工程学院,浙江 杭州 310053
据世界卫生组织(World Health Organization,WHO)和中华医学会男性不育症诊疗指南规定,夫妇双方未采用任何避孕措施同居生活1年以上,其中男方因素导致女方不孕者,称为男性不育症。近年来由于环境污染严重、生活压力大、饮食习惯不良和生活习惯变化等多因素共同作用,因不孕不育就诊的患者逐年增加,据WHO统计,全球有10%~15%的育龄夫妇存在不孕不育问题,甚至一些发展中国家的某些地区可高达30%,其中男性因素导致不育的占50%[1-3]。男性不育症患者较为常见的临床表现主要是弱精症,即经精液常规检查主要表现为精子前向运动百分率<32%或精子总活力<40%[4]。
线粒体作为精子细胞中唯一的细胞器,在氧化磷酸化、细胞生长、信息传递和遗传等生理过程中均发挥重要的作用,其主要分布在精子尾部中段,为精子运动和功能提供能量保障。线粒体DNA(mtDNA) 作为线粒体的独立遗传物质,存在于线粒体内膜和基质内,是一条全长为16 569 bp的环状闭合双链DNA分子,负责编码37个基因,包括22个tRNA基因、2个rRNA基因(16S rRNA和12S rRNA)以及13个组成呼吸链复合体部分亚基的多肽基因[5-7]。mtDNA由于缺乏组蛋白保护及完整有效的DNA修复系统,容易受到活性氧(reactive oxygen species, ROS)及其他自由基的损伤,导致其突变率相比核基因组高出10~100倍[8-11]。
D-Loop区是mtDNA的非编码区域,包含了mtDNA轻重链转录启动子和重链复制起始点,在mtDNA复制和转录过程中发挥重要的调控作用[12]。D-Loop区中存在高突变区域(hypervariable region)[13],其高频率的突变可能引起mtDNA的复制和转录功能出现异常,造成mtDNA数量减少、呼吸链相关蛋白和ATP合成不足以及线粒体功能障碍等,使得精子获能不足、动力下降等,最终将导致弱精症[14]。本研究将通过对弱精症患者精子mtDNA的D-Loop区基因进行测序,分析其基因变异类型和变异频率的差异,探讨精子mtDNA D-Loop区基因突变和弱精症的相关性及其临床应用价值。
1 对象和方法
1.1 研究对象 选取2019年7月至2021年3月温州市中医院诊治的男性不育症患者134例,年龄23~42岁,平均年龄33岁,有1年以上不育史,精液常规分析提示精子前向运动率<32%,符合第五版《WHO人类精液检验与处理实验室手册》中弱精症的相关诊断标准,且其配偶的妇产科相关检查均正常。同时选取129例因女性不孕就诊的健康男性精液作为对照组,年龄22~40岁,平均年龄32岁,精液常规等检查结果均正常。
全部研究对象留取样本时均符合以下标准:①禁欲时间为2~7 d;②无泌尿系统感染史、附睾炎病史、睾丸损伤史、精索静脉曲张治疗史及相关性腺器官发育异常史;③常规精液检测相关参数均齐全;④符合本研究相关入组标准。本研究经温州市中医院伦理委员会批准(WTCM-KT-2021045),所有患者均知情同意。
1.2 方法
1.2.1 精液基因组DNA提取:精液样本经离心后收集精子细胞层,采用基因组DNA提取试剂盒[购于天根生化科技(北京)有限公司]提取精子总DNA,按照试剂盒说明书进行操作。
1.2.2 引物合成及PCR扩增:根据已报道的mtDNA D-Loop区引物序列[12],委托上海捷瑞生物工程有限公司合成,见表1。按要求配置20 μL的PCR反应体系,反应程序为:95 ℃预变性5 min;95 ℃变性 30 s,58 ℃退火30 s,72 ℃延伸1 min,共35个循环;72 ℃再延伸7 min;4 ℃保存,产物使用1.5%琼脂糖凝胶电泳和紫外凝胶成像系统(Tanon)确 认。

表1 mtDNA D-Loop区扩增引物设计
1.2.3 PCR产物测序及分析:将PCR产物送尚亚生物技术有限公司进行测序,所有样本采用双向重复测序,保证测序的准确性。以剑桥标准序列(rCRS)为参照,对测序结果进行分析,查找突变位点。
1.3 统计学处理方法 采用SPSS21.0软件对实验数据进行统计学分析。计数资料以例(%)表示,组间比较采用χ2检验或Fisher’s确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1 两组精子细胞mtDNA D-Loop区突变情况 通过对弱精症组(n=134)和对照组(n=129)的D-Loop区进行测序,共发现247种突变,其中弱精症组患者精子细胞中发现178种,对照组精子细胞中发现182 种,两组显示出相近的单核苷酸多态性(SNP) (2 232/134=16.66,2 259/129=17.51)。有62种突变的发生率>5%,其中大多在HV-1区(55.31%)和HV-2区(32.47%)。D-Loop区域的4个新突变均为核苷酸缺失突变,见图1、表2。
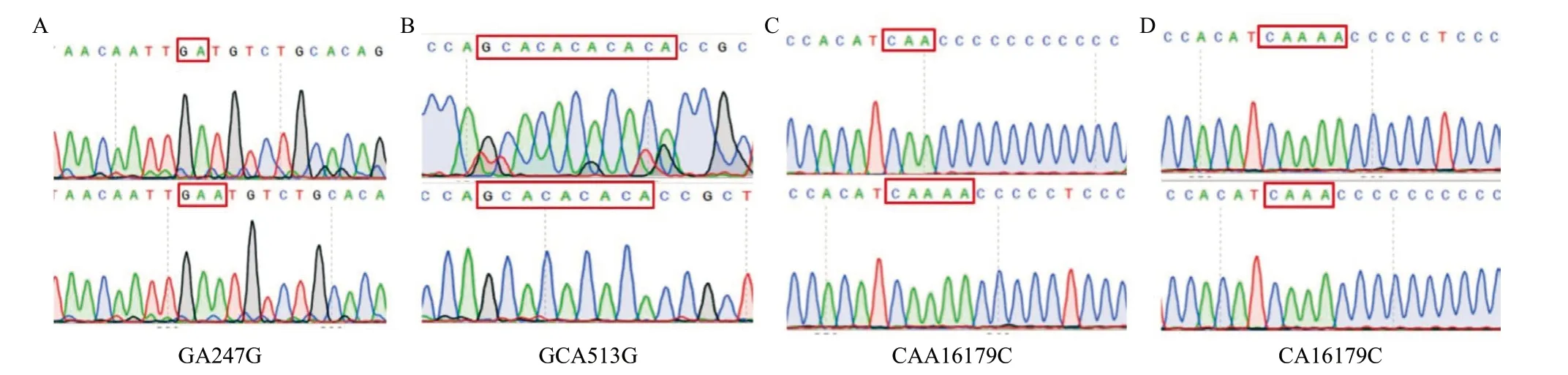
图1 4种新突变的测序结果比对图
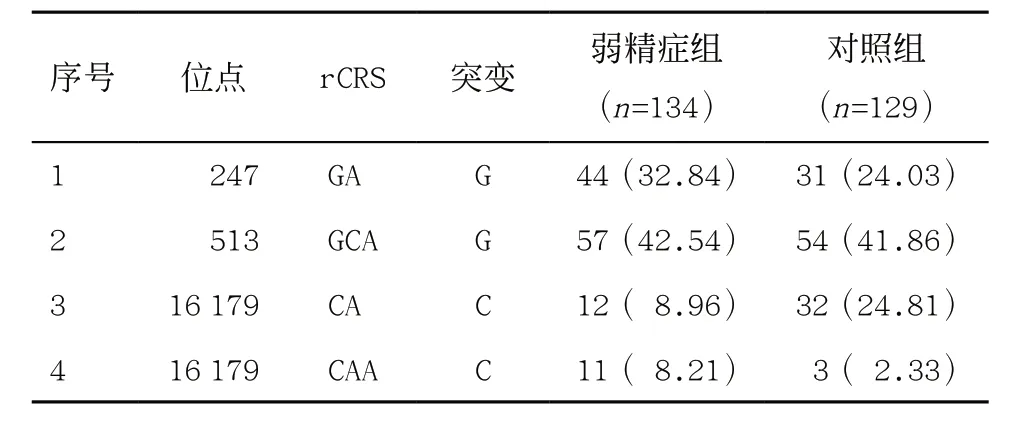
表2 4个D-Loop区域的新突变位点[例(%)]
2.2 两组精子细胞mtDNA D-Loop区突变的差异性分析 对发生率>5%的62种突变的分析显示,突变以替换突变为主(87.03%),其中替换突变54个,缺失突变5个,插入突变3个,且替换突变数量与其他两种突变的差异具有统计学意义(P<0.01);替换突变大多为T>C(42.2%)、A>G(23.03%)以及C>T(22.78%)等,且不同替换类型在两组间的分布差异无统计学意义(P=0.389),见图2。本研究发现有11种突变在两组间差异有统计学意义(P<0.05),见表3。
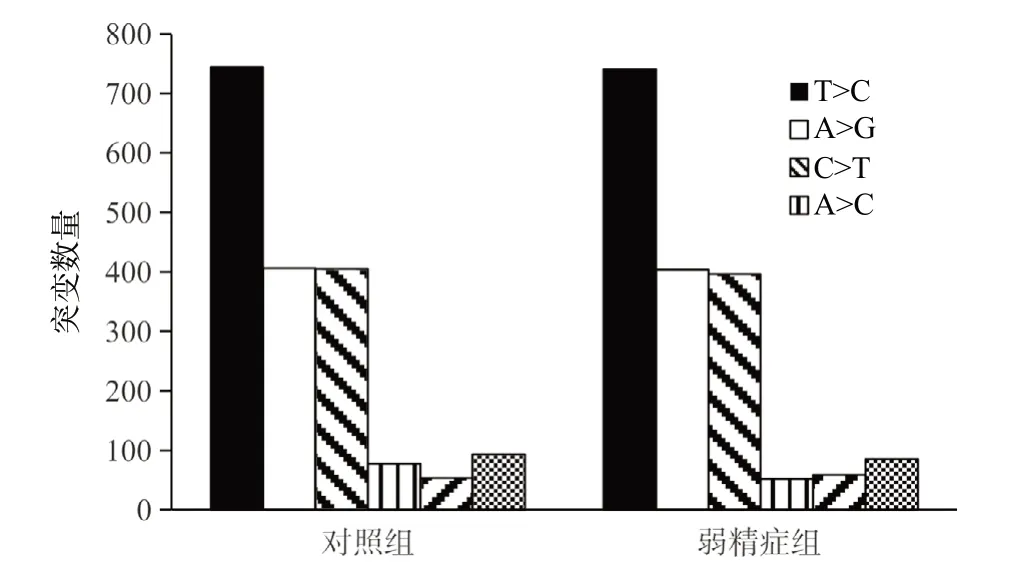
图2 两组间不同类型替换突变的差异

表3 两组精子细胞mtDNA D-Loop区突变分析[例(%)]
2.3 弱精症患者精子活动力水平与mtDNA D-Loop区突变的关系 根据精子细胞前向运动百分率将弱精症患者分为轻度68例(20%~32%)、中度48例(10%~20%)及重度18 例(<10%),其中mtDNA DLoop区基因突变发生率>5%的有92种,分析发现有4种突变在不同严重程度的弱精症患者间差异有统计学意义(P<0.05),见表4。
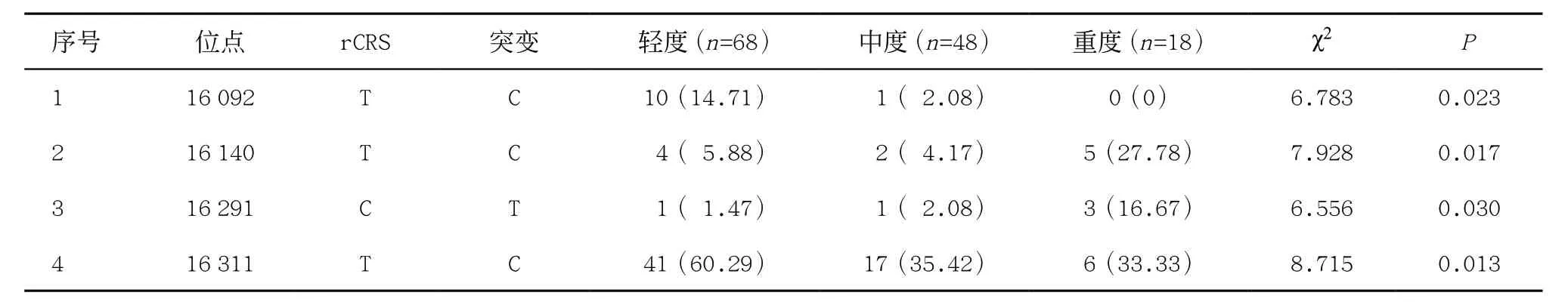
表4 不同严重程度弱精症患者精子细胞mtDNA D-Loop区突变分析[例(%)]
3 讨论
临床上男性不育大多表现为弱精症,即精子前向运动力减弱,从而引起不孕不育。作为细胞“动力工厂”的线粒体,是精子细胞的重要能量来源,若线粒体功能发生障碍,将影响精子细胞正常的生命活动和运动能力[15]。mtDNA由于其特殊的结构特点而具有较高的突变率[16],尤其作为mtDNA复制和转录调控区的D-Loop区,不仅包含了H链、L链转录启动子和H链复制起始点,还存在两个极具不稳定性的高突变区域(HV-1、HV-2),这些区域的高频突变可能导致复制和转录等功能紊乱[16-19]。
本研究结果显示所有研究对象在D-Loop区均有不同程度的突变,发生率>5%的突变有62 种,其中位于HV-1区(55.31%)的突变明显多于HV-2区(32.47%),替换突变数量(87.03%)明显高于其他突变类型,替换突变中以T>C占比最大(42.2%),其次为A>G(23.03%)和C>T(22.78%),同时我们还发现了4个未见报道过的新突变。
此前,已有多位学者发现mtDNA D-Loop区在各类肿瘤、慢性肝肾疾病、类风湿关节炎等疾病中表现出高突变率。SULTANA等[20]提出D-Loop区突变可能抑制电子传递链的进行,造成高水平ROS释放堆积,是肿瘤的诱发剂及启动剂。DRAGONI等[21]发现脑部病变时D-Loop区的甲基化水平明显增高。ALTAFI等[22]通过比较脑肿瘤组织及其相邻组织的mtDNA序列,发现两者D-Loop区突变存在明显差异。WANG等[23]研究发现mtDNA D-Loop区突变与胃肠道肿瘤进展存在相关性。位于D310区的微卫星序列,表现为多聚C单核苷酸重复序列,目前已被证实与乳腺癌有关[24-25]。研究[26-29]显示mtDNA D-Loop区突变与类风湿性关节炎发病年龄、慢性肾功能衰竭、溃疡性结肠炎以及喉癌之间均存在相关性。这些研究表明,D-Loop区突变的积累可能导致呼吸链环节发生异常,ROS大量堆积,进而造成细胞损伤和疾病发生[12]。
有不少研究报道弱精症患者存在mtDNA拷贝数异常[30-32]和大片段缺失现象[33-34],本课题组前期研究[35]提示弱精症组mtDNA拷贝数降低,但未发现大片段缺失,而D-Loop区与mtDNA复制转录过程息息相关,在弱精症相关研究中却较少被提及,在弱精症发生发展过程中的表现和作用亦不明确。本研究通过分析发现,有11种突变在弱精症患者和对照组之间存在显著性差异,其中T16172C、CAA16179C、C16257A、C16261T、T16304C可能会增加弱精症风险,而CA16179C、A16182C、A16183C、A16230G、T16249C、G16319A则相反。此前有报道T16172C和A16183C在子宫内膜异位症中亦呈现相同的表现[36], T16304C与卵巢癌发病年龄有关[37],C16179T与精子活力和浓度下降显著相关[38],本研究中CAA16179C、CA16179C、A16182C和A16183C在弱精症患者中均有显著差异,可能与紧邻16184-16193的微卫星结构(C5TC4)有关,这些突变可能造成该微卫星结构的多胞嘧啶单核苷酸重复模式改变,增加其不稳定性。C16257A和C16261T作为弱精症的风险因素,同时也被报道参与组成汉族人群II型糖尿病和中重症新冠肺炎的风险因素(G5417A/C16257A/C16261T),参与ROS堆积和线粒体破坏[39-40]。此外,本研究通过比较发现4种突变在不同程度弱精症之间存在显著性差异,其中T16140C、C16291T可能是弱精症患者精子活力进一步下降的风险因素,T16092C和T16311C则可能是弱精症患者病情进展的保护性因素,需要进一步研究明确其相关性。
综上所述,本研究结果表明,弱精症患者精子细胞mtDNA D-Loop区存在显著差异,可能在弱精症发生发展中发挥重要作用,对弱精症的临床诊疗具有一定提示意义,同时也为线粒体DNA点突变在弱精症机制研究方面提供新的思路和证据。
