心肺超声在鉴别ICU机械通气患者心源性撤机失败中的应用价值
2023-12-21刘奕赵浩天刘元琳王晓娜薛红元李丽龙玲
刘奕,赵浩天,刘元琳,王晓娜,薛红元,李丽,龙玲
机械通气是急危重症患者发生呼吸衰竭的重要救治工具。然而,长时间机械通气患者可发生呼吸机依赖,导致撤机困难。约40%的重症机械通气患者可发生撤机失败,增加撤机失败的发生率。撤机失败发生频繁,可导致再次气管插管、延长机械通气时间和住院时间、增加呼吸道感染风险等不良预后[1]。撤机过程可改变胸腔内压和降低对右心室后负荷的阻力,导致回心血量增加,当患者存在急性或慢性左心功能不全而无法耐受过多的静脉血液回流时,可造成心源性肺水肿,导致再次呼吸困难而撤机失败[2-3]。研究报道左心室收缩和舒张功能是撤机失败的重要影响因素[4]。既往关于心源性撤机失败的研究多集中于左心功能监测,属于肺水肿的间接评价指标。肺超声技术是近年来热门的血管外肺水无创监测技术,肺内增加仅3%~5%的肺水含量即可被肺超声敏锐发现[5]。本研究结合实践经验,将撤机后肺超声B线的变化、左心功能和下腔静脉(inferior vena cava,IVC)指标进行研究,并通过二元Logistic分析的β值权重积分计算撤机心肺超声评分,探究其在心源性撤机失败中的诊断价值,旨在针对撤机失败患者可迅速识别是否为心源性因素,并指导临床实施针对性治疗措施,报道如下。
1 资料与方法
1.1 临床资料 选取2019年7月—2021年5月于河北省人民医院重症医学科(ICU)接受机械通气治疗>48 h且至少发生一次撤机失败的患者48例,年龄31~91(65.69±15.08)岁。将撤机失败中高于N末端B型利钠肽前体(NT-proBNP)年龄分层阈值的患者纳入心源性因素撤机失败组(心源性组),低于上述阈值纳入非心源性因素撤机失败组(非心源性组)[6]。心源性组听诊湿啰音比例高于非心源性组(P<0.05)。2组患者性别、年龄、APACHE Ⅱ评分、呼吸频率、心率、血压、氧饱和度、二氧化碳分压、氧合指数、预后不良比例等指标比较,差异均无统计学意义(P>0.05),具有可比性,见表1。本研究已经获得医院伦理委员会批准(科研伦审2019第130号) ,患者或家属知情同意并签署知情同意书。

表1 心源性组与非心源性组撤机失败患者临床资料比较
1.2 病例选择标准 (1)纳入标准:①年龄>18岁;②接受机械通气>48 h且至少发生一次撤机失败;③撤机试验期间接受超声检查。(2)排除标准:①存在神经源性或神经传导性相关膈肌功能障碍疾病;②既往肺组织切除术、胸廓畸形、气胸、皮下气肿或大量胸腔积液等;③超声切面清晰度差,或测量资料不完整。
1.3 观测指标与方法 采用便携式超声仪(CX50 Phillips荷兰,vivid iq GE美国)进行检查。
1.3.1 心脏超声指标:于撤机试验开始时使用相控阵探头(1~5 MHz)于心尖四腔心切面测量左心室舒张末期内径(LVEDD)、右心室舒张末期内径(RVEDD)、左心室射血分数(LVEF)、二尖瓣舒张早期血流峰速度(E)、二尖瓣环/左心室侧壁舒张早期组织运动速度(e’),并计算E/e’[7]。
1.3.2 肺超声B线指标:使用凸阵探头(1~5 MHz)经胸壁扫查患者肺叶,分别于撤机0、15 min时对胸前区(胸骨旁线至腋前线)逐个肋间隙进行扫查,并对肺超声征象进行比较,观察肺超声B线数目的变化,见图1。

注:A~B:非心源性撤机失败患者,SBT 0 min与15 min时肺超声均为A线;C~D: 心源性撤机失败患者,SBT 0 min时为A线,SBT 15 min时出现2条新增B线
1.3.3 下腔静脉内径(IVCD)超声指标:使用相控阵探头经剑突下获取IVC长轴切面,于距右心房交汇1~2 cm位置作为IVCD测量位点,切换M模式并观察患者呼吸状态,以平静呼气末期IVCD测量值为准。
1.4 撤机失败及心力衰竭的诊断标准 机械通气患者撤机均由ICU医师根据患者生命体征(意识、呼吸、血压等)评估和执行,使用T型管接氧流量瓶进行60 min撤机试验,当发生下列情况之一定义为撤机失败[8]:(1)撤机后神志模糊、昏迷;(2)心率、血压变化较大,或需血管活性药物维持;(3)撤机48 h内再发呼吸困难,需再次气管插管、无创呼吸机支持或高流量吸氧维持自主呼吸;(4)撤机48 h内死亡。分组依据:结合既往心源性因素撤机失败文献标准[6],参照《中国心力衰竭诊断和治疗指南》[9]中NT-proBNP对心力衰竭的诊断标准:>450 ng/L(<50岁),>900 ng/L(50~75岁),>1800 ng/L(>75岁)。
心脏、下腔静脉和肺超声指标根据指南标准或既往研究结果转化为有序二分类变量[9-12],以心源性因素撤机失败为因变量(心源性=1,非心源性=0),以LVEF(<50%=1,≥50%=0)、E/e’(>14=1,≤14=0)、RVEDD/LVEDD(>0.6=1,≤0.6=0)、IVCD(≥20 mm=1,<20 mm=0)、肺超声B线数目变化(增加≥6条=1,增加<6条=0)作为自变量。
2 结 果
2.1 2组心肺超声指标比较 心源性组LVEF<50%、E/e’>14、IVCD≥20 mm、肺超声B线数目增加≥6条比例均高于非心源性组(P均<0.01),2组间RVEDD/LVEDD>0.6比例差异无统计学意义(P>0.05),见表2。

表2 非心源性组与心源性组撤机失败患者心脏、肺和下腔静脉超声指标比较 [例(%)]
2.2 心源性因素撤机失败的Logistic回归模型的建立与撤机心肺超声评分 以心源性因素撤机失败为因变量(赋值:是为“1”;否为“0”),以上述结果中P<0.05项目为自变量,进行多因素Logistic回归分析,结果显示, LVEF<50%、E/e’>14、肺超声B线数目增加≥6条是心源性因素撤机失败的独立影响因素,见表3。回归模型:logit(P)=-2.634+3.050×LVEF<50%+2.897×E/e’>14+1.964×肺超声B线数目增加≥6条。根据β权重评分法,肺超声B线数目增加≥6条=1.000分,LVEF<50%=1.553分,E/e’>14=1.475分,将该评分代入各组内,计算每位患者的撤机心肺超声评分。

表3 心源性撤机失败患者危险因素的Logistic回归模型分析
2.3 超声指标及撤机心肺超声评分诊断心源性撤机失败的效能比较 绘制超声指标及撤机心肺超声评分诊断心源性撤机失败的ROC曲线,并计算AUC,结果显示: LVEF、E/e’、IVCD、肺超声B线数目变化的AUC值分别为0.788、0.867、0.763、0.803,撤机心肺超声评分以1.238分为截断值,预测心源性因素撤机失败的 AUC为0.913,高于单独LVEF和IVCD预测(Z=2.015、2.352,P=0.044、0.019),与E/e和肺超声B线数目变化比较差异无统计学意义(Z=0.928、1.558,P=0.353、0.119),见表4、图2。
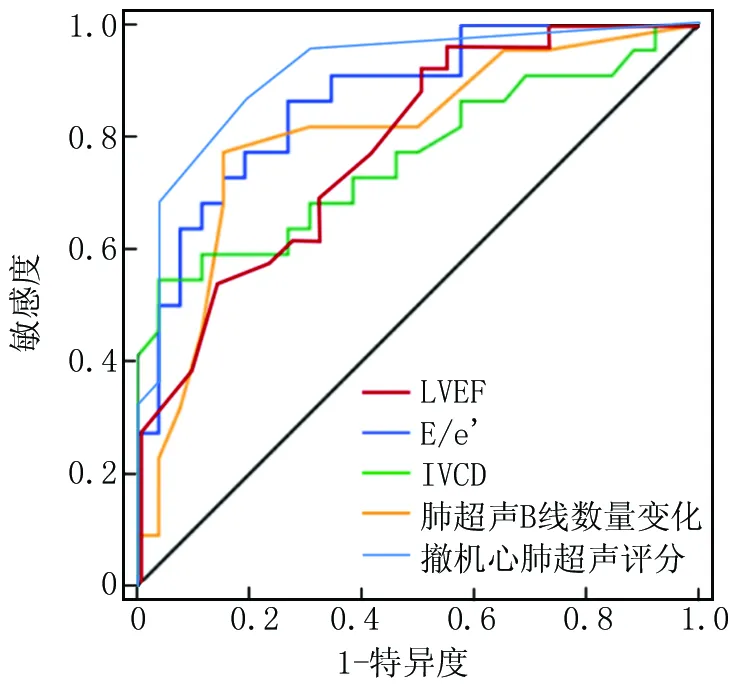
图2 心肺各超声指标、撤机心肺超声评分对心源性因素撤机失败预测的ROC曲线Fig.2 ROC curves of heart and lung ultrasound indicators and weaning heart and lung ultrasound scores for predicting weaning failure due to cardiogenic factors

表4 心源性撤机失败的ROC曲线
3 讨 论
ICU内机械通气患者发生撤机失败较常见,可导致呼吸机依赖、住院时间延长、治疗成本增加,甚至增加死亡率[9]。机械通气撤机失败原因有多种[2,13-14],包括心源性、肺源性、膈肌源性、神经源性和内分泌因素等[3],不同原因的撤机失败的治疗方向不同,准确鉴别诊断撤机失败原因是指导治疗方向的关键。心源性因素是撤机失败的常见重要因素。本研究发现,心源性组患者具有较高比例的左心室收缩功能减低(LVEF<50%)、左心室充盈压增高(E/e’>14)、容量过负荷(IVCD>20mm),表明左心功能不全和容量过负荷是心源性因素导致撤机失败的条件,其中LVEF<50%和E/e’>14是心源性因素撤机失败的独立危险因素。该研究结果与其病理生理学机制相符,心源性撤机失败的机制是在患者合并急性或慢性心功能不全的基础上,由于撤机过程引起胸腔内压的变化,右房压下降、体循环回心血量增加,心脏功能无法耐受液体过负荷而导致肺水肿和急性呼吸衰竭,即心源性因素撤机失败。既往研究发现在ICU中,心源性因素占撤机失败病例的21%~87%[3-4]。NT-proBNP作为传统ICU内鉴别心源性撤机失败的指标可有效识别撤机后心力衰竭的发生。Haji等[10]研究发现,撤机失败组患者具有较高的E/e’和前胸壁肺超声评分,表明左心功能超声指标与撤机结局有关,但该研究并未区分撤机失败的原因是心源性或其他因素,本研究在此基础上对撤机失败患者进行了细化区分。
心源性肺水肿是心—肺系统充盈压力增高的继发表现[15],当心功能无法耐受增多的回心血量时将导致液体渗漏进肺间质/肺泡。目前在床旁机械通气撤机的肺部影像学中,肺超声明显优于其他影像学工具[10]。本研究发现,观察撤机15 min肺超声B线数目的变化,心源性组中肺超声B线数目增加≥6条比例明显多于非心源性组(均P<0.05),表明心源性因素导致的撤机失败,可经肺超声发现撤机后B线数量随时间的进展而增加。Ferré等[11]研究发现,撤机前后对比,双肺前胸壁B线数量变化>6条可预测由心功能因素导致撤机失败,与本研究结果相近。本研究同样选取前胸壁作为肺超声检查部位,是基于以下原因:(1)心源性肺水肿发生时,肺间质渗出呈弥漫性分布,前胸壁区易于观察到B线替代A线、B线数量增多等变化;(2)部分撤机患者因卧床时间长,背部区域可存在坠积性肺炎或胸腔积液,无法判断血管外肺水含量是否增加;(3)ICU卧床患者不便于翻身,前胸壁扫查切面更易获取。
本研究采用二元Logistic回归分析,并根据β值权重作为评分标准,计算各组中撤机心肺超声评分,并绘制ROC曲线发现,以1.2375分为截断值,预测心源性因素撤机失败的敏感度为0.864,特异度为0.808,AUC值>0.9,表明该撤机心肺超声评分在撤机失败患者中鉴别诊断心源性撤机失败具有较高的价值。
综上所述,心肺超声技术基于心源性因素撤机失败中发生肺水肿的血流动力学特点作为理论指导,通过超声技术作为观察点,直接或间接反映撤机后心脏功能可否代偿增多的静脉血液回流、是否产生肺间质水肿。本研究的不足之处在于样本量较少,这是由于撤机失败者比例较低,且部分患者由于存在慢性肺间质病变、大量胸腔积液等予以严格剔除;此外,本研究尚未排除是否合并内分泌因素等少见情况。今后需将大样本研究综合分析作为研究方向。
利益冲突:所有作者声明无利益冲突
作者贡献声明
刘奕:设计研究方案,实施研究过程,论文撰写;赵浩天:提出研究思路,分析试验数据,论文审核;刘元琳、王晓娜:实施研究过程,资料搜集整理;薛红元、李丽:分析数据,对文章的知识性内容进行审阅与指导;龙玲:数据筛选,统计分析
