新型冠状病毒感染相关心肌损伤研究现状
2023-12-20林荣梅陆霓虹
林荣梅 陆霓虹
新型冠状病毒感染(coronavirus disease 2019,COVID-19)的大流行给全球公共卫生带来了前所未有的挑战。虽然COVID-19患者的主要临床表现是呼吸系统症状,但心血管并发症也很常见,感染新型冠状病毒(简称“新冠病毒”)可直接或间接引起心血管损伤。部分COVID-19患者在患病后数月仍存在胸痛、呼吸短促、心悸等症状,实验室和影像学检查也观察到了心肌损伤和受累的证据;此外,一些用于治疗COVID-19的药物对心血管系统也有潜在的不良反应,这些因素可能导致COVID-19患者的病亡率增加。因此,关注COVID-19患者的心血管并发症是十分必要的。《新型冠状病毒感染与心血管疾病诊疗中国专家共识(2023)》[1]中指出,COVID-19对心血管系统的影响主要涉及三大类人群:(1)因新冠病毒或相关疫苗接种引发心肌损伤的患者;(2)COVID-19对心血管疾病患者的影响;(3)COVID-19对健康人心血管系统的影响。笔者主要对因新冠病毒引发心肌损伤的情形进行阐述。
一、COVID-19相关心肌损伤的定义、分型及流行病学
COVID-19相关心肌损伤被定义为新冠病毒病原学检测结果阳性合并心肌损伤标志物 [心肌肌钙蛋白 I(cTnI)或心肌肌钙蛋白 T(cTnT)]升高超过第 99 百分位参考上限[2-3];其可以发生在心肌缺血或非缺血性心肌梗死的背景下,若能观察到cTn升高和下降的过程,则定义为急性心肌损伤[4],无症状的心肌肌钙蛋白升高、暴发性心肌炎、循环休克等都是急性心肌损伤的情形[5]。根据发病时间,可将COVID-19相关心肌损伤分为2种类型[6]:一类是发生于呼吸系统症状之后,以心脏循环生物标志物升高为主,此时心脏症状往往被呼吸系统症状掩盖;另一类是以心脏症状为主要症状,表现为急性心肌炎或暴发性心肌炎。同时,有学者提出了心肌损伤的3种模式[7]:(1)最常见的模式是肌钙蛋白轻度升高(通常<参考上限的第99百分位数),随后几天出现进一步升高或下降,这在无心脏症状的患者和住院后好转的患者中经常可以观察到。(2)第二种模式是进行性的,一些患者在入院时肌钙蛋白水平正常或中度升高(可能接近或超过第99百分位数参考上限),通常在入院后的第二周病情恶化,出现呼吸衰竭并伴有白细胞介素6(IL-6)、铁蛋白、乳酸脱氢酶(LDH)等生物标志物水平升高,肌钙蛋白水平随之升高。一般在非幸存者中可观察到这种模式,并且在症状发作后大约18.5 d死亡。(3)第三种模式是早期肌钙蛋白中度升高,随后在病程中下降;这种模式通常见于临床怀疑心肌炎的患者,主要表现为心脏症状。在《新型冠状病毒感染心肌损伤无创影像学评估中国专家共识》[8]中,则将COVID-19相关心肌损伤分为以下6种类型,分别为:心肌炎、心肌梗死、应激性心肌病、多系统炎症综合征、深静脉血栓-肺栓塞-急性右心衰竭、感染后遗症及“康复”后心肌损伤。“2种类型”及“3种模式”的分类方式奠定了确诊为“6种类型”的基础,这些分类方式有助于临床医生早期识别COVID-19相关心肌损伤,并且对指导治疗及判断预后有一定的价值。
COVID-19相关心肌损伤的发病率因研究人群而异,与研究对象的年龄、合并基础疾病及COVID-19的严重程度均有一定相关性。一项荟萃分析显示,在1527例COVID-19患者中,至少8%的患者出现了急性心肌损伤,并且重症COVID-19患者发生心肌损伤的风险是非重症患者的13倍[9]。有研究指出,大约每3例COVID-19患者中就有1例会出现某种心肌损伤表型,既往诊断为慢性冠心病的患者风险明显更高[10]。根据对住院患者资料、尸检数据和心脏磁共振成像(cardiovascular magnetic resonance imaging, CMR)数据的分析,COVID-19 发生后存在心肌损伤证据的患者比例为19%~78%[11-12],甚至有研究发现COVID-19相关心肌损伤的发病率高达89%[13]。综上,笔者认为,开展多中心、大样本的研究可能是获取COVID-19相关心肌损伤发病率客观数据的一种方法。
二、COVID-19相关心肌损伤的病因及发病机制
美国心脏病学会《2022成人COVID-19心血管后遗症专家共识决策路径》对心肌损伤的潜在病因进行了阐述,包括但不限于心肌炎、急性冠状动脉综合征(1型心肌梗死)、心肌氧供需求失衡(2型心肌梗死)、儿童多系统炎症综合征(MIS-C)和成人多系统炎症综合征(MIS-A)、应激性心肌病、细胞因子风暴、大面积肺栓塞或微肺栓塞导致的急性肺心病、慢性疾病引起的心肌损伤和急性病毒感染导致的亚临床心脏病等[3]。这些病因可以单独存在或共存,这给临床带来了一定的挑战,但心肌损伤患者预后不良是明确的。一份纳入150例患者的报告显示,33%的COVID-19患者死亡可归因于循环衰竭及呼吸衰竭,另外有7%的死亡单独归因于心肌损伤[14]。因此,识别COVID-19相关心肌损伤的危险因素是必要的,高龄、男性、心血管基础疾病、肥胖、糖尿病、高血压、免疫抑制和严重的全身性疾病都是心肌损伤的危险因素[3]。
尽管已经开展了大量研究,但COVID-19相关心肌损伤的具体机制尚不十分明确,目前认为其主要机制有以下3类(发病机制模式如图1所示)[1, 15]:(1)病毒直接侵袭心肌细胞导致细胞损伤:血管紧张素转换酶2(ACE2)是一种膜结合氨基肽酶,新冠病毒对宿主ACE2受体的独特亲和力增加了病毒直接感染血管内皮和心肌的可能性,从而引起心肌损伤[16]。(2)过度炎症反应及细胞因子风暴导致的心肌损伤:细胞因子风暴综合征的标志是淋巴细胞和巨噬细胞的持续活化和增殖的不受控制及功能失调。Lancet发布的一项研究显示,COVID-19相关心肌损伤患者的高敏肌钙蛋白I(hs-cTnI)的升高与D-二聚体、铁蛋白、IL-6、LDH等炎症标志物一致,这在一定程度上反映了过度炎症激活和细胞因子风暴的存在[17]。(3)严重低氧导致心肌氧供需失衡:严重肺部感染诱发低氧血症、呼吸衰竭、休克或低血压等都可导致心肌氧供不足,使细胞发生酸中毒,直接导致细胞凋亡。有研究发现,心脏受累程度与新冠病毒在肺部蓄积量呈正相关[18],这从侧面反映了新冠病毒引起的心肌损伤与肺部侵袭程度相关。
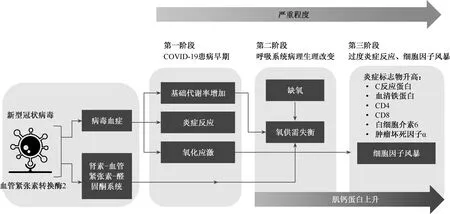
图1 COVID-19相关心肌损伤可能的发病机制
一项Meta分析指出,虽然有心血管合并症的患者更容易感染新冠病毒,但COVID-19患者心脏损伤的发病率为15%~44%,高于有心血管疾病患者的患病率(5%~15%),这表明新冠病毒可能通过不同的途径攻击心肌细胞,而并不仅仅是加剧心血管系统的受损程度[19]。目前,也有大量的研究正在进一步探究COVID-19相关心肌损伤可能的发病机制,发现不良适应性宿主免疫反应、先天性免疫途径过度激活、血栓性炎症、血栓性微血管病、内皮功能障碍,甚至是分子拟态都可能是其发病机制[20-22];应激性心肌病和缺氧性心肌损伤可能是其促进机制[23]。
三、COVID-19相关心肌损伤的临床表现
COVID-19患者的临床症状并不特异,并且只有少数的患者出现心脏症状,可伴或不伴呼吸道症状。另外,COVID-19相关心肌损伤患者病情的严重程度也存在较大差异,部分患者只有轻微的呼吸急促和疲劳感,随着病情加重,可能出现心悸、胸闷、胸痛、晕厥等典型的循环系统症状,危重患者则可能出现心源性休克、恶性心律失常,甚至死亡。《新型冠状病毒感染与心血管疾病诊疗中国专家共识(2023)》[1]中将COVID-19患者出现心肌损伤的临床表现分为两个阶段:一是固有免疫反应阶段,以发热、乏力、咳嗽、咽痛、鼻塞、流涕、味觉/嗅觉减退、腹泻等非特异性急性症状为主,症状持续≥1周;二是病程进展到1~4周时,以广泛的心脏受累为主的适应性免疫反应阶段,患者可出现呼吸困难、胸闷、胸痛、心悸、极度乏力和晕厥等症状,一般是患者就诊的主要原因。
四、COVID-19相关心肌损伤的诊断方法
大多数临床研究将心肌损伤标志物水平的显著变化作为评判COVID-19患者是否出现心肌损伤的主要标准。然而,心肌损伤标志物的水平受到感染、缺氧及肾脏功能等诸多因素的影响,因此诊断心肌损伤应当是基于心肌损伤标志物的变化情况,综合考虑患者的临床症状及心电图、超声心动图等辅助检查而得出的结果[24]。美国心脏病学会发布的专家共识也指出,COVID-19相关心肌损伤一般发生在感染后4周内,也有不少患者会在康复期出现迟发性心脏症状[3]。因此,COVID-19患者在发病期间或康复后出现胸闷、胸痛、心悸、晕厥等症状时,应尽早进行心电图、超声心动图和心肌肌钙蛋白三联检查,上述检查是判断心肌损伤的一线筛查手段。
CMR是鉴别心肌和心包受累最敏感的影像学方法。根据Lake Louis标准[25],CMR识别心肌损伤的诊断准确率为78%,该标准的内容包括:(1)在T2加权CMR图像上检测局部水肿;(2)在T1加权早期钆增强的基础上检测充血和早期毛细血管渗漏;(3)通过晚期钆增强检测坏死和纤维化。当3个CMR特征中有2个存在时具有较高的特异性和阳性预测值。在怀疑有心肌损伤的COVID-19患者中,若患者血流动力学稳定,则建议行CMR;若患者出现低血压、室性心律失常等病情不稳定的表现,建议患者先在心力衰竭中心进行评估[3]。
虽然心内膜活检(endomyocardial biopsy,EMB)是诊断心肌炎的金标准,但无论是心肌炎,还是细胞因子风暴诱导的心肌损伤,或者是心肌氧供需失衡导致的心肌损伤,活检都不太可能改变即时的临床管理,因此美国心脏病学会建议不要对疾病活动期的和心肌酶学异常的COVID-19患者常规进行EMB[3]。若患者存在心脏传导阻滞或室性心律失常且排除了阻塞性冠状动脉疾病的情况可考虑行EMB,但应避开疾病急性期[1]。
五、COVID-19相关心肌损伤的治疗及预后
心肌损伤的管理重点是识别诱因及对症支持治疗。因此,从根本上说,积极治疗COVID-19是管理COVID-19相关心肌损伤的首要任务。COVID-19相关心肌损伤的总体治疗原则是[26]:卧床休息、支持治疗、保证充分热量;维持水、电解质平衡与酸碱平衡;及时进行氧疗及呼吸支持治疗,预防和治疗并发症,根据病情严重程度制定个体化的治疗方案。对于重型、危重型患者应进行严密监护,尽早给予生命支持;轻型、中型患者可酌情进行氧疗、改善心肌能量代谢及抑制氧化应激等治疗;急性COVID-19相关心肌损伤可迅速恶化并进展为心力衰竭和心律失常;急性心肌梗死和(或)心源性休克,应尽快实施综合治疗措施和进行有效药物治疗。
(一)抗病毒治疗
经过不断研究探索,目前已经批准上市的用于COVID-19的抗病毒药物主要包括奈玛特韦/利托那韦(paxlovid)、阿兹夫定、莫诺拉韦、安巴韦单抗/罗米司韦单抗、先诺特韦/利托那韦等。然而,目前尚缺乏直接循证医学证据来指导选择抗病毒药物治疗COVID-19相关心肌损伤,可根据患者危险程度、发病时间等综合考虑。另外,部分抗病毒药物可能引起心功能不全、心律失常,或与心血管药物存在相互作用,例如先诺特韦/利托那韦可能引发窦性心动过缓;而奈玛特韦/利托那韦则适用于既往合并心血管疾病的患者,但与降脂药、降压药、抗凝药等均存在药物相互作用,因此在使用抗病毒药物时必须综合评估药物相互作用及监测心脏毒性反应。
(二)免疫调节治疗
目前,治疗COVID-19的免疫调节药物主要包含糖皮质激素和IL-6抑制剂——托珠单抗。虽然尚缺乏针对COVID-19相关心肌损伤免疫调节治疗的高质量证据,但Angus等[27]的研究,以及Ledford[28]将地塞米松用于COVID-19住院患者的研究中均发现免疫调节治疗对重症COVID-19患者有良好的疗效并且能降低合并严重并发症的COVID-19患者的病亡率。COVID-19相关心肌损伤的临床管理专家建议指出,如果存在心肌损伤,根据患者体温>38.5 ℃超过5 d或发热、胸部影像学进展迅速或符合重型标准、机体炎症反应过度激活等状态,可早期、足量给予糖皮质激素治疗[26]。此外,Sheng等[29]研究表明,Canakinumab(IL-1β 抑制剂)可减少COVID-19相关心肌损伤和炎症加重时的心脏和呼吸功能恶化。
(三)中医中药及中成药治疗
尽管中医中药治疗COVID-19的具体机制仍未完全阐明,但中医中药在改善COVID-19患者症状、降低恶化率及病亡率方面的作用是有目共睹的。在我国,超过90%的患者接受了中西医结合治疗,在病程的各个阶段都取得了良好的效果。连花清瘟胶囊(颗粒)、化湿败毒颗粒、金花清感颗粒、宣肺败毒颗粒等中成药均可用于临床治疗COVID-19患者;另外,还可根据中医辩证推荐使用不同的方剂有针对性地进行治疗。既往研究显示,芪冬颐心颗粒可以明显改善病毒性心肌炎患者的心肌酶学指标,由此推测该药在治疗COVID-19相关心肌损伤方面具有潜在价值[30]。也有研究表明,参松养心胶囊可以用于治疗COVID-19感染期间出现的心律失常[31]。
(四)病后康复
COVID-19相关心肌炎的相对风险率在发病的第1周最高,然后逐渐下降。Chen等[32]从COVID-19疫情暴发3年以来的心血管疾病专家的视角出发,建议COVID-19患者在发病后1~2周好好休息,1个月内不要参加剧烈运动;康复2周后,可先尝试低强度运动,如散步、做家务,呼吸训练恢复肺功能,伸展运动提高柔韧性,平衡训练和瑜伽运动提高稳定性,并将心率控制在极量心率(220―年龄)的70%以下,初始运动时间不超过15 min,然后逐渐增加运动量,直到恢复到病前的水平;COVID-19相关心肌炎患者应停止剧烈运动3~6个月,3~6个月后需要对心肌酶、心电图、24 h动态心电图和(或)CMR进行综合评估后,进一步制定恢复计划。
(五)预后
越来越多的证据表明,心肌损伤在COVID-19患者中很常见,并且与疾病的严重程度和预后相关[33-35]。既往两项Meta分析显示,合并心肌损伤的患者发生致死性事件的风险分别增加8.12倍[19]和21.15倍[13]。一项回顾性研究显示,心肌损伤与病亡率之间存在明显相关性,即使是与既往合并心血管疾病的、肌钙蛋白水平正常的患者相比,存在COVID-19相关心肌损伤患者的结局也更差[17]。遗憾的是,这些研究没有对心肌损伤的类型与严重不良预后的相关性进行阐述,笔者推测,症状更严重的心肌损伤的患者预后更差,后续可进一步探究心肌损伤类型与严重程度之间的相关性。Shi等[33]的研究也发现,合并心肌损伤的重症COVID-19住院患者病亡率明显高于没有心肌损伤的患者(51.2%vs.4.5%,P<0.001)。此外,有研究发现,不仅肌酸激酶、肌红蛋白、超敏肌钙蛋白和N端脑钠肽前体(NT-proBNP)等传统心肌酶学指标与COVID-19的严重程度和病亡率相关[36],可溶性ST2[ST2是广泛的白细胞介素1(IL-1)/Toll样受体(TLR)家族的成员]、和肽素、半乳糖凝集素3等新型心脏生物酶,也越来越多地被认为是COVID-19相关心血管损伤的标志物,可能与不良结局相关[37]。或许在后续的研究中可进一步探究证实新型心脏生物酶在COVID-19相关心肌损伤中的应用价值。
六、小结与展望
COVID-19相关心肌损伤发病率较高,但在临床实践中无症状或症状较轻的心肌损伤往往被忽视,当患者出现较为严重的心血管系统症状时很可能已经错过了疾病的最佳治疗时机。因此,早期识别COVID-19相关心肌损伤并进行干预是十分必要的。到目前为止,研究新冠病毒如何影响心脏的病理生理机制的文献仍然比较有限,由于新冠病毒与严重急性呼吸综合征(severe acute respiratory syndrome,SARS)病毒非常相似,所以研究人员大多以SARS病毒作为比较模型,或许后续的研究可以通过比较2个病毒的异同来进一步了解COVID-19相关心肌损伤的病因和发病机制;另一个值得进一步研究的领域是疾病的治疗,如今用于治疗COVID-19和其他类似疾病的主旨仍是支持性治疗,希望未来可以研发出特异性抑制病毒生长的新药以达到靶向治疗的目的。当前,有研究正致力于研发可以作为病毒受体诱饵的新药重组血管紧张素转换酶,虽然该研究还仅限于细胞培养和类器官阶段,但这种药物如果研发成功,将会有效降低患者的发病率和病亡率,甚至预防COVID-19相关的心血管损伤。最后,评估心肌损伤的体系也尚未健全,虽然大多数研究都以肌钙蛋白的升高来定义心肌损伤,但没有讨论这种定义的内在主旨,也没有数据来支持不同程度的肌钙蛋白升高患者的管理策略,未来可进一步开展临床随机对照研究来探索各种治疗方案与心肌损伤标志物之间的相关性,为临床用药提供更多的循证医学证据。
利益冲突所有作者均声明不存在利益冲突
作者贡献林荣梅:资料收集、分析与撰写;陆霓虹:对文章的知识性内容做审阅及指导
