白细胞介素-1在巨噬细胞抗结核分枝杆菌免疫应答及代谢重编程的作用研究进展
2023-12-20闫亚如谢建平
闫亚如 谢建平
结核病是由结核分枝杆菌(Mycobacteriumtuberculosis,MTB)引起的呼吸道传染病,目前已影响了世界上1/4的人口。《2022年全球结核病报告》显示,2021年全球新发结核病患者1060万例,与2020年相比增加了4.5%。结核病的发病率(每年每10万人口新发患者例数)在2020至2021年期间上升了3.6%[1]。
结核分枝杆菌作为一种胞内病原体,通过气溶胶传播至一个新的宿主体内后,首先被驻留在肺部的肺泡巨噬细胞和树突状细胞吞噬[2-3]。结核分枝杆菌表面的病原相关分子模式刺激宿主细胞,激活下游炎症反应。作为先天性免疫反应过程中的前线细胞,巨噬细胞在免疫监视、维持组织完整性及稳态、创伤修复、病原体防御和调节炎症性免疫应答等方面发挥重要作用[4-5]。结核分枝杆菌感染时,巨噬细胞根据刺激的不同极化为经典激活的“M1”型或选择性激活的“M2”型,或者是介于两者之间[6-8]。关于免疫代谢的最新研究表明,巨噬细胞的极化状态与代谢密切相关。巨噬细胞感染的早期阶段以M1型极化为标志,依赖糖酵解进行能量供应,并伴随着氧化/抗氧化防御应答、精氨酸代谢、生物活性脂质合成等通路的上调[9]。M2型巨噬细胞则利用氧化磷酸化和脂肪酸氧化来维持其功能[10]。那么巨噬细胞代谢重编程是如何影响炎症性反应的呢?目前巨噬细胞应对结核分枝杆菌的免疫反应和各种细胞因子所起的作用愈加清楚。已有证据表明,结核分枝杆菌感染部位代谢的改变可改变细胞因子的产生[11]。白细胞介素-1(interleukin-1,IL-1)作为先天性免疫的有效调节剂对代谢十分敏感。笔者主要综述了在结核分枝杆菌感染过程中,IL-1在巨噬细胞抗结核分枝杆菌免疫应答和代谢重编程中的作用。
一、IL-1概述
白细胞介素包括一系列的细胞因子,其中一些已经被证明在宿主-病原体相互作用的过程中起关键作用。在IL-1家族的11个成员(表1)中,IL-1已经成为越来越多的全身性和局部性炎症性疾病的治疗靶点。
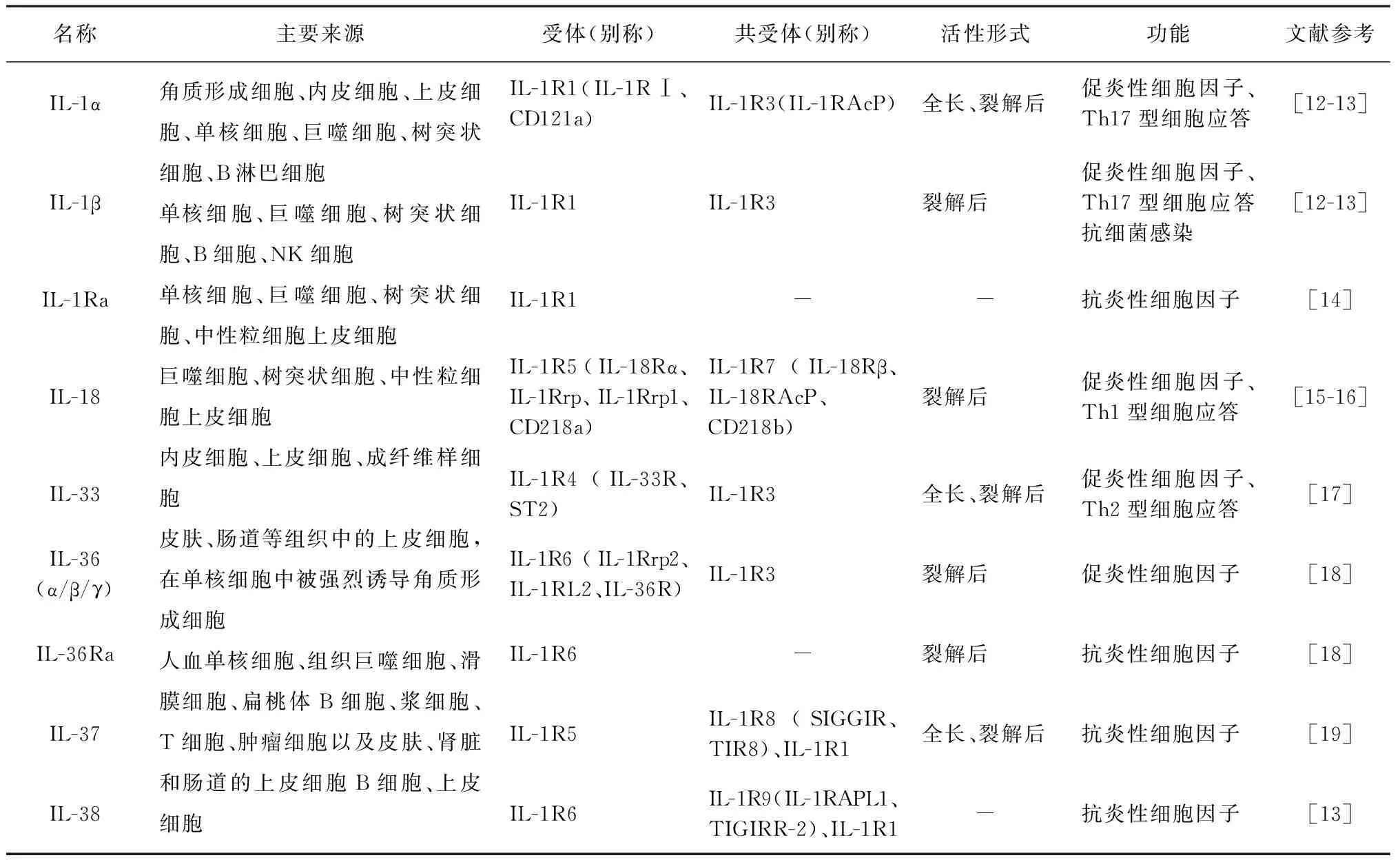
表1 白细胞介素-1家族成员比较
(一)结核分枝杆菌感染过程中IL-1的产生的调控
结核分枝杆菌感染期间IL-1的释放对宿主层面的病原体免疫防御至关重要。先天性免疫细胞,如炎症性单核细胞、巨噬细胞、树突状细胞是IL-1的主要来源[20-21]。IL-1β起初以pro-IL-1β前体的形式分泌,之后通过炎症小体和caspase-1的激活裂解为活性形式[22]。但IL-1α不需要caspase-1的处理。结核分枝杆菌感染细胞后,有多种途径可引起IL-1β的产生。免疫细胞表面模式识别受体和细菌的病原相关分子模式(pathogen-associated molecular patterns,PAMP)结合引起级联反应。细胞表面的多种受体如TLR(toll-like receptors)、NLR(nucleotide-binding domain and leucine-rich repeat-containing receptors)、CLRs(C-type lectin receptors)、cGAS等已被证明可分别与结核分枝杆菌表面成分相互作用。细胞表面Toll样受体、细胞因子受体(IL-1R、TNFα、IFNAR)识别病原相关分子模式或被内源性细胞因子诱导,从而激活核转录因子κB(NF-κB)途径导致NLRP3(NOD-like receptor protein 3, NLRP3)、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)、Pro-IL-1β、Pro-caspase-11、Pro-IL-18的激活。在结核分枝杆菌感染的过程中,caspase-1不是介导IL-1产生的唯一途径[23-25]。在树突状细胞等其他类型的细胞中,结核分枝杆菌可激活caspase-8依赖性炎症小体[24]。Dectin-1作为胞外传感器被结核分枝杆菌诱导后,导致Sky-依赖性的CARD9-Bcl-10-MALT1复合体的形成从而导致IL-1β的转录,并伴随着介导pro-IL-1β加工的MALT1-caspase-8-ASC复合体的形成与激活[26]。同样也有其他研究显示结核分枝杆菌临床菌株采用独特的独立于caspase-1的途径刺激巨噬细胞分泌IL-1β[25]。因此,IL-1β的处理和分泌是一个依赖于多个传感器和效应器的复杂过程。
(二)IL-1的加工处理和翻译后修饰
IL-1α和IL-β在基因组上相邻,位于2号染色体的长臂上,分别由不同的基因编码。根据同源序列比对发现其DNA序列的相似性为45%[27]。IL-1α和IL-1β的晶体结构已经确定。都有12个β-strand 形成的三折对称结构(β-trefoil fold)[28]。但与IL-1β不同的是,IL-1α在其N端有一个额外的β-strand,进一步稳定了整个蛋白质的结构[29]。因此,高度相似的空间折叠方式使它们都能与相同的受体结合并传输信号。IL-1α/β均以前体的形式(pro-IL-1α/β)产生。与前体形式相比,其切割后的成熟形式具有更高的活性[30]。Pro-IL-1α和pro-IL-1β的切割位点如图1所示。除上述切割位点外,IL-1β在第133、第200、第269位丝氨酸处和140位酪氨酸处发生磷酸化;在第132位赖氨酸处发生泛素化。与IL-1β相比,IL-1α有其他几个翻译后修饰位点:(1)pro-IL-1α在第82位赖氨酸处发生乙酰化,影响其亚细胞定位[31];(2)pro-IL-1α在第90位丝氨酸处发生磷酸化[32];(3)pro-IL-1α同样在第82位赖氨酸处发生N-豆蔻酰化[33],有助于其对膜的特异性靶向。IL-1α和β的加工处理方式如图1所示。
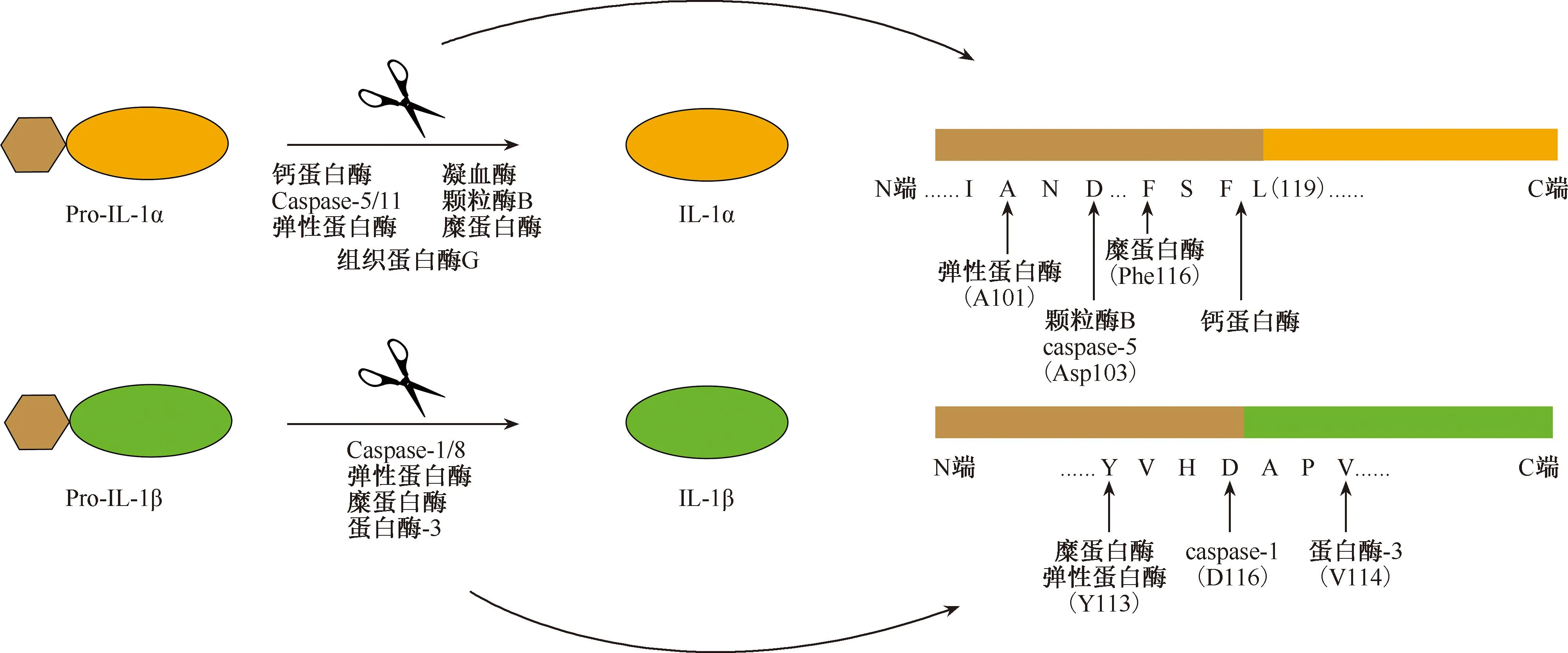
注 人源IL-1α由271个氨基酸组成,可以被钙蛋白酶(calpain)、弹性蛋白酶(elastase)、颗粒酶B(granzyme B,GzmB)、凝血酶(thrombin)、糜蛋白酶(chymase)、组织蛋白酶G(cathepsin G)和caspase-5切割。IL-1β由269个氨基酸组成,可被caspase-1、弹性蛋白酶、糜蛋白酶、蛋白酶3(proteinase 3)切割[32,34]图1 IL-1的加工方式及切割位点
(三)IL-1的分泌方式
蛋白质的分泌是细胞间进行信息传递的重要步骤。分泌蛋白N端通常具有信号肽,经内质网-高尔基体-质膜的常规途径被释放到细胞外。而IL-1α/β缺乏信号肽,以非常规途径进行分泌。Fettelschoss 等[35]提出位于细胞表面的IL-1α和分泌型的IL-1α分别受到不同的调节。膜IL-1α只需要NF-κB的激活,而分泌型的成熟IL-1α还额外需要炎症小体和caspase-1的激活。尽管炎症小体和caspase-1被证明与IL-1α的分泌有关,但是IL-1α从细胞质分泌到细胞外的途径仍然不清楚。有研究认为在IL-1β缺陷的小鼠中不能分泌IL-1α,体外实验证明了,IL-1α和IL-1β直接结合共同进行分泌[35]。Mandinova等[36]发现IL-1α的分泌依赖于Cu2+结合蛋白S100A13。S100A13被认为与fibroblast growth factor 1 (FGF1)相关。FGF1与IL-1α具有高度的蛋白质空间结构[37],因此IL-1α的释放,可能与FGF1相似,可能通过涉及Cu2+依赖性S100A13的蛋白复合物的形成,这些复合物以熔球态的形式在膜上易位[38]。与IL-1α不同,IL-1β可以以多种途径离开细胞:如分泌溶酶体介导的胞吐作用[39-40];质膜微囊泡的脱落,转运蛋白的直接释放、含有外泌体的多泡体[41]。 Evavold等[42]证实了在被激活的吞噬细胞中,GSDMD可作为成熟IL-1分泌的孔道。在GSDMD缺陷的细胞中依赖于caspase-1的IL-1β的加工过程可以正常进行,但成熟的IL-1β不能被释放到细胞外。研究显示GSDMD孔主要带负电荷,有利于成熟的IL-1通过,这说明了GSDMD除调控细胞命运之外的重要作用[43]。
二、IL-1信号途径在结核分枝杆菌感染中的作用
IL-1在结核分枝杆菌感染过程中对宿主细胞主要起保护性作用。在结核分枝杆菌感染期间,IL-1α 和IL-1β协作使宿主防御结核分枝杆菌,并与IL-1RⅠ结合后触发下游生物学反应。IL-1α/β及其受体IL-1R在结核分枝杆菌感染过程中的作用首先通过在小鼠中的敲除实验被证明[44-45]。当IL-1信号缺陷时,结核分枝杆菌感染导致宿主体内的细菌载量及被感染的细胞的数目增加,不可控的炎症反应增强[45-47]。在IL-1RⅠ缺失的条件下,被结核分枝杆菌感染的髓系巨噬细胞中TNF-RI的表达及ROS的产生受到限制,细胞控制病原体生长的能力降低[47]。此外,IL-1信号还可以介导β-葡聚糖在结核分枝杆菌感染期间诱导训练性免疫的作用,保护小鼠免受结核分枝杆菌的侵害[48]。肺泡巨噬细胞向肺间质迁移是肉芽肿形成过程中的关键步骤,由结核分枝杆菌的ESX-1分泌系统介导[3]。IL-1R信号在启动适应性T细胞反应和肉芽肿形成过程中发挥独特作用。其可以通过控制肺泡巨噬细胞迁移间接影响结核分枝杆菌传播到肺间质,并进一步激活T细胞应答,从而限制病原体的生长[49]。肉芽肿是结核分枝杆菌在宿主体内存活和扩散的部位,但IL-1α缺陷的小鼠经结核分枝杆菌感染后不能在肺部形成肉芽肿。因此,有观点认为IL-1α在结核分枝杆菌感染的背景下对细菌有利[47]。
巨噬细胞特异性IL-1β的产生在结核分枝杆菌感染的不同阶段以及在不同严重程度的结核病患者中存在差异[49-50]。使用结核分枝杆菌特异性抗原刺激人单核细胞来源的巨噬细胞发现,活动性肺结核患者和结核分枝杆菌潜伏感染者之间存在不同程度的IL-1β应答。与活动性肺结核相比,IL-1β在结核分枝杆菌潜伏感染者和未感染者中高表达[50]。分离自轻度结核病患者的菌株在刺激来自其他多个供体的巨噬细胞后可持续诱导强烈的细胞因子反应[51]。因此,IL-1的分泌水平可以作为区分不同结核病严重程度的指标。IL-1是先天性免疫的重要介质,但也能够促进炎症组织损伤。过量的IL-1与中性粒细胞的流入和肺部炎症的增加有关,进而导致细菌负荷和病亡率升高[52-53]。在结核病等慢性感染期间,IL-1对宿主有益的抗细菌作用必须与预防免疫病理的需要相平衡。
三、IL-1与代谢重编程
IL-1β作为宿主防御结核病过程中的关键细胞因子对代谢十分敏感[54-55]。在宿主抵抗结核分枝杆菌感染的过程中,宿主的代谢水平会发生重大变化,以便为胞内抗感染通路提供腺嘌呤核苷酸三磷酸(ATP)、还原型辅酶Ⅱ(NADPH)等能量。研究显示,由糖酵解驱动、miR-21靶向的IL-1β的产生过程可影响巨噬细胞对结核分枝杆菌的承载能力[56]。细胞表面Toll样受体(TLR2/4)被结核分枝杆菌相关成分激活后在24 h内可引起代谢途径从氧化磷酸化向糖酵解的转变[57-58],以及三羧酸循环(TCA)中间产物的积累。在小鼠来源的巨噬细胞中已证明代谢向糖酵解的转变对于IL-1β的转录是必要的。糖酵解过程的进行可驱动缺氧诱导因子1α(hypoxia inducible factor-1α, HIF-1α)的激活;胞内累积的琥珀酸盐能够增加HIF-1α的稳定性并促使其转位到细胞核,促进IL-1β后期转录的增加,进而限制胞内结核分枝杆菌的生长[59-62]。此外,线粒体中的琥珀酸被琥珀酸脱氢酶氧化后,电子传递链反向流动,导致线粒体活性氧的产生,同时也诱导HIF-1α介导的IL-1β的转录[63]。HIF-1α的活性同样受到谷氨酰胺代谢的调控。巨噬细胞表面TLR4受体活化后会增加细胞对谷氨酰胺的摄取[64]。谷氨酰胺作为一种非必须氨基酸能够增强免疫细胞的活化[65],是巨噬细胞M1样极化以及应对结核分枝杆菌感染所必须的[66]。其进入细胞后可以分解产生谷氨酸和α-酮戊二酸,后者进入三羧酸循环导致衣康酸和琥珀酸盐的产生。如上所述,进一步稳定HIF-1α的活性。衣康酸在巨噬细胞免疫调节过程中具有双重性。在结核分枝杆菌感染的早期阶段,衣康酸盐通过抑制琥珀酸脱氢酶的产生来增加琥珀酸的浓度[67-68],进而导致HIF-1α的表达增加,发挥促进炎症反应的作用。随着感染的进一步发展,衣康酸盐浓度升高而行使抗炎症反应的功能。衣康酸盐的衍生物如衣康酸二甲酯(dimethyl itaconate,DI)和4-辛基衣康酸(4-octyl itaconate,4-OI)均可抑制pro-IL-1β或HIF-1α的活性以发挥抗炎作用[69-70]。当巨噬细胞处于无谷氨酰胺的环境中时,IL-1β的释放减少[71]。因此,谷氨酰胺的分解代谢是结核分枝杆菌感染期间巨噬细胞代谢重编程的一个重要组成部分,影响免疫功能。
有研究显示,结核病的严重程度与IL-1,一型干扰素和类二十烷酸的变化相关。类二十烷酸是源自花生四烯酸的脂质介质,包括前列腺素(prostaglandin,PG)、消退素(resolvins)、脂氧素(lipoxins,LX)和白三烯(leukotriene,LT)[72]。已有研究表明,前列腺素E合成酶(ptges)缺陷的小鼠对结核分枝杆菌感染更为敏感[73]。IL-1可通过诱导“类二十烷酸”抑制Ⅰ型干扰素的过度产生和促进对细菌的遏制,从而赋予宿主对细菌的抗性。在没有IL-1信号的情况下,在结核分枝杆菌感染的IL-1r1-/-小鼠的肺泡灌洗液中前列腺素E2(PGE2)和前列腺素F2α(PGF2α)显著减少。因此,抑制Ⅰ型IFN及其促细菌活性是IL-1和PGE2介导宿主抗结核的主要机制[54]。综上所述,IL-1作为细胞代谢与免疫之间的桥梁,在宿主对结核分枝杆菌感染的免疫中起关键作用(图2)。
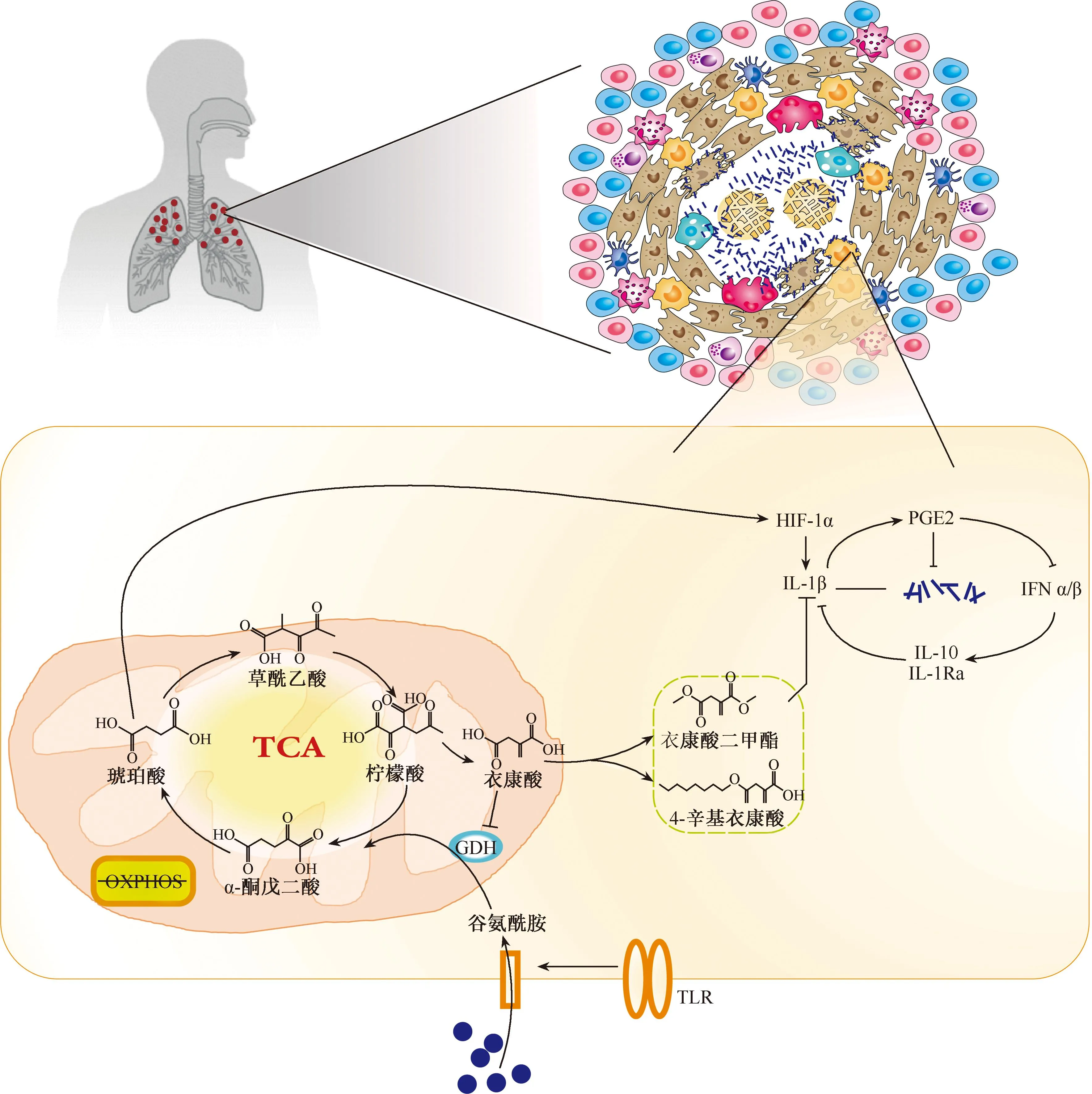
注 TCA(tricarboxylic acid cycle,TCA cycle):三羧酸循环;OXPHOS(oxidative phosphorylation):氧化磷酸化;GDH(glutamate dehydrogenase):谷氨酸脱氢酶;PGE2(Prostaglandin E2):前列腺素E2;TLR:Toll样受体图2 结核分枝杆菌感染期间巨噬细胞代谢重编程对IL-1的调控[53]
四、IL-1与其他细胞因子之间的串扰
干扰素是宿主细胞响应病原体或肿瘤细胞的存在而释放的细胞因子[74]。干扰素根据其受体种类、基因序列的相似程度和染色体位置而分为以下3种类型:Ⅰ型干扰素(IFN-α、IFNβ/ε/κ/ω)、Ⅱ型干扰素(IFN-γ)和Ⅲ型干扰素[ IFN-λ1 (IL-29)、IFN-λ2 (IL-28A)、IFN-λ3 (IL-28B)、IFN-λ4 ][75-77]。在结核分枝杆菌感染过程中,Ⅰ型干扰素被认为主要起抗炎作用,促进病原体在体内的发展。IFNα/β一方面抑制iNOS、IL-12p40、IL-1 α和IL-1 β的产生,另一方面诱导免疫抑制介质IL-10和IL1Ra (又称“Il1rn基因”)的产生,从而破坏宿主细胞对结核分枝杆菌的防御功能[78]。经结核分枝杆菌感染的小鼠使用Ⅰ型干扰素的诱导剂Poly-ICLC处理后,肺部表现出病理上的恶化及细菌负荷的增加[79]。有研究表明,经结核分枝杆菌感染的IL-1R-/-小鼠肺部,IFN-β的mRNA水平及蛋白水平均显著升高。在IL-1r-/-BMDM中阻断Ⅰ型干扰素信号后,胞内的结核分枝杆菌载量显著降低。上述IL-1对Ⅰ型IFN的抑制作用由前列腺素E2介导[54]。肿瘤坏死因子是调节胞内促进炎症反应环境的主要细胞因子之一。在结核分枝杆菌感染期间,TNF在维持肉芽肿形成方面起着至关重要的作用[80]。TNF或其受体缺失导致炎症过程加剧,细菌清除受损,最终导致结核分枝杆菌在体内的传播及宿主的死亡[81]。IL-1 可与肿瘤坏死因子发挥协同作用。结核分枝杆菌感染过程中,IL-1和TNF-α的相互依赖,控制TNF-α依赖的效应因子的功能[47]。在没有IL-1信号缺陷的情况下,结核分枝杆菌感染过程中新募集的具有Ly6Ghigh标记的髓系细胞不能上调肿瘤坏死因子受体Ⅰ (TNF-RI)和产生活性氧,导致病原体控制受损,TNF的存在对细胞没有保护性作用。上述IL-1与干扰素、TNF信号转导之间的相互依赖影响结核分枝杆菌在宿主内的结局,了解IL-1与其他细胞因子之间的相互串扰在触发宿主对结核分枝杆菌耐受的先天机制中的作用可以为开发通过调节先天免疫途径来限制活动性结核病发病率和结核分枝杆菌潜伏感染率的方法和药物提供基本原理。
五、结论
IL-1是结核病免疫应答过程的基本参与者。其最大的特点就是其在转录、转录后以及信号转导水平的复杂调控。IL-1应答的失调将导致多种免疫病理性和自身免疫性疾病的发生。目前对于结核分枝杆菌与宿主代谢之间的相互作用的深入了解,使我们意识到巨噬细胞代谢的激活和转变对于控制结核分枝杆菌感染至关重要。IL-1作为免疫反应中的关键效应因子,在结核分枝杆菌感染过程中对机体起保护作用。同时由于IL-1对代谢敏感的特殊性,将代谢重编程与免疫反应联系起来。这对于了解宿主应对结核分枝杆菌的防御机制具有较大意义。
利益冲突所有作者均声明不存在利益冲突
作者贡献闫亚如:文献检索、撰写论文;谢建平:指导和完善论文
