hUC-MSCs源性神经干细胞样细胞对大鼠脑缺血再灌注损伤的保护作用
2023-12-14王素平钟亮兰小磊翟秋月张睿
王素平,钟亮,兰小磊,翟秋月,张睿
(1 青岛市第三人民医院神经康复科,山东 青岛 266041; 2 青岛大学附属医院神经外科; 3 青岛大学附属医院神经外科监护室)
缺血性卒中发生率很高,组织纤溶酶原激活剂静脉溶栓是目前的主要治疗手段[1-3],但该治疗窗口狭窄且使出血转化的可能性增大[4-5]。临床上,脑缺血再灌注损伤可导致广泛的神经血管损伤和神经功能障碍[6-7]。由于中枢神经系统自我修复的能力有限,因此,替代方法将有望改善脑缺血再灌注的治疗[8]。神经干细胞(NSCs)能分化成神经元、星形胶质细胞和少突胶质细胞,具有补偿内源性神经细胞不足和改善细胞存活的炎症微环境的能力[9]。基于NSCs的细胞治疗成为脑缺血再灌注损伤的一种新型治疗策略。本研究将人脐带间充质干细胞(hUC-MSCs)诱导成神经干细胞样细胞(NSCLCs)后移植至缺血再灌注损伤大鼠脑内,旨在探讨NSCLCs移植对大鼠脑缺血再灌注损伤的保护作用及可能机制。
1 材料与方法
1.1 实验材料
hUC-MSCs无血清培养基购自上海弗元生物科技有限公司;上皮细胞生长因子(EGF)以及碱性成纤维细胞生长因子(bFGF)购自美国PreproTech公司;B-27TM添加剂购自美国Gibco公司;性别决定区Y-Box2(SOX2)抗体购自武汉Proteintech公司;Nestin抗体购自美国STEMCELL公司;NeuN抗体购自武汉ABclonal公司;Hoechst 33342染色液及荧光二抗购自上海碧云天公司;改良苏木精-伊红(HE)染色试剂盒购自北京索莱宝公司。
1.2 实验方法
1.2.1hUC-MSCs诱导形成NSCLCs 经青岛大学附属医院伦理委员会审议批准(QYFY WZLL 26435)、产妇知情同意后,取足月分娩的健康胎儿脐带10~15 cm(包含脐带和胎盘连接处5~6 cm)。采用机械分离培养组织块的方法分离获得hUC-MSCs,将获得的hUC-MSCs进行传代培养。取传至第6~8代的hUC-MSCs,将其接种至低吸附六孔板中,加入NSCLCs诱导培养液(DMEM/F12+20 μg/L EGF+20 μg/L bFGF+20 g/L B27),每隔2 d换一次液,诱导7 d后收集获得NSCLCs,细胞密度为1×1010/L[10]。
1.2.2动物分组及处理 雄性Sprague Dawley大鼠30只,体质量250~280 g,由北京维通利华公司(SCXK(京)2016-0011)提供,在实验动物中心适应性饲养7 d,术前禁食12 h。随机取8只大鼠作为假手术组(Sham组),剩余22只大鼠用于构建大脑中动脉闭塞/再灌注(MCAO/R)模型(MCAO/R组)及造模后NSCLCs治疗(NSCLCs组),MCAO/R组和NSCLCs组每组至少8只大鼠存活。治疗7 d后处死大鼠取脑组织用于后续研究。所有动物实验均经青岛大学和青岛大学附属医院伦理委员会批准(批准号20210720SD15020211230062,QYFY WZLL 26598)。
1.2.3MCAO/R模型构建及NSCLCs移植 大鼠称体质量,应用100 g/L的水合氯醛(0.3 mL/kg)腹腔注射麻醉以后,仰卧位固定,分离出颈总动脉(CCA)、颈内动脉(ICA)以及颈外动脉(ECA)。结扎ECA远心端,在其近心端和远心端之间剪出一缺口,将线栓由ECA缺口插入,插至深度为18~22 mm处,微感阻力即可,缺血90 min后,将线栓缓慢拔出完成缺血再灌注。NSCLCs移植方法参照已有的相关研究[11],在线栓拔出时,将注射用软管从ECA残端经CCA到达ICA,设置微量注射泵,5 min内注射100 μL的细胞悬液,注射细胞数目为1×106个。
1.2.4改良神经功能缺损评分(mNSS评分) 基于已有的相关研究,采用mNSS评分表评估各组大鼠神经行为功能[12]。mNSS评分表包括肌张力、运动、感觉、平衡和反射指标检测,总分为18分,评分越高说明神经系统损伤越严重。
1.2.5细胞免疫荧光染色 收集NSCLCs用PBS洗涤,以40 g/L多聚甲醛固定。透膜后,室温封闭1 h。加一抗SOX2和Nestin(1∶100)在4 ℃下孵育过夜。次日,滴加荧光二抗(1∶100)37 ℃孵育1 h后,用Hoechst 33342对细胞核进行染色。
1.2.6HE染色 取各组大鼠缺血皮质区域脑组织进行石蜡包埋并切片。按照说明书指示进行脱蜡水化、苏木精染色、分化液分化、返蓝液返蓝、伊红染色,脱水及透明后封片。光镜下观察,视野内苏木精所染细胞核的数目记为细胞总数,变性细胞通常表现为细胞核皱缩且着色加深。每张切片随机选取5个不重叠的视野,采用Image J软件统计损伤神经元比例,即变性细胞指数(DCI),DCI=变性细胞数目/细胞总数。实验重复3次。
1.2.7免疫组化染色 取各组大鼠缺血皮质区域脑组织石蜡切片,干燥后经二甲苯、梯度乙醇脱蜡水化。经柠檬酸抗原修复液进行抗原修复后,封闭30 min,加一抗NeuN(1∶100)4 ℃孵育过夜。次日,加荧光二抗37 ℃孵育1 h,Hoechst 33342染核后加入抗荧光淬灭剂封片。荧光光镜下观察,每张切片随机选取5个不重叠的视野,采用Image J软件统计NeuN阳性细胞数目。实验重复3次。
1.3 统计学分析
2 结 果
2.1 NSCLCs形成及鉴定
第6代的hUC-MSCs贴壁生长呈长梭形,悬浮培养诱导至第7天时,形成克隆球状NSCLCs(图1A)。细胞免疫荧光染色的结果显示,NSCLCs呈NSCs表面关键特异性抗原SOX2(绿色)和Nestin(红色)阳性(图1B)。

A:第6代的hUC-MSCs形态学(左)及诱导第7天的NSCLCs形态学(右);B:克隆球免疫荧光染色。①复合染色,②红色Nestin,③绿色SOX2,④蓝色Hoechst。比例尺50 μm。
2.2 NSCLCs治疗对MCAO/R大鼠行为学评分的影响
mNSS评分结果显示,3组mNSS评分差异有统计学意义(F=5.119,P<0.05)。两两比较结果显示,与MCAO/R组相比,NSCLCs组治疗7 d后的行为学评分显著降低(P<0.05)。见表1。

表1 各组mNSS评分、DCI和NeuN表达比较
2.3 NSCLCs治疗对MCAO/R大鼠神经元损伤的影响
缺血皮质区HE染色结果显示,Sham组神经元排列整齐,轮廓清晰,细胞核着色均匀;MCAO/R组细胞核着色加深且固缩,细胞排列无序;NSCLCs治疗后,细胞损伤情况得到改善(图2)。3组DCI比较差异有统计学意义(F=173.928,P<0.01)。两两比较结果显示, MCAO/R组DCI较Sham组显著升高(P<0.01),NSCLCs组DCI较MCAO/R组显著降低(P<0.05)。见表1。
2.4 NSCLCs治疗对MCAO/R大鼠NeuN表达的影响
大鼠缺血皮质区免疫组化染色结果显示,3组NeuN阳性细胞数目差异有显著意义(F=73.120,P<0.01)。两两比较结果显示,与Sham组相比,MCAO/R组NeuN阳性细胞数目显著减少(P<0.01);与MCAO/R组相比,NSCLCs组NeuN阳性细胞数目显著增多(P<0.05)。见图3、表1。
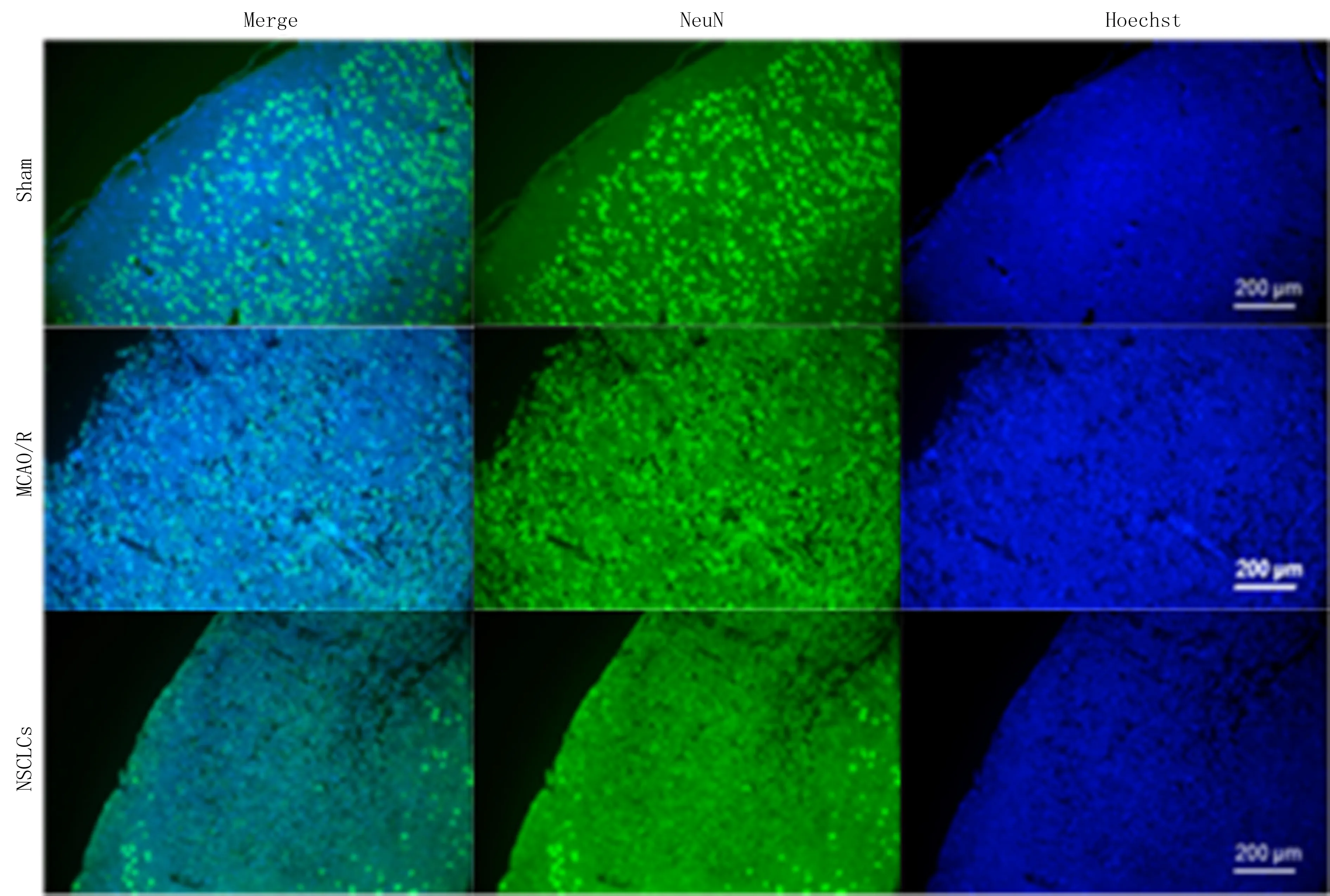
绿色荧光标记细胞为NeuN阳性细胞,放大200倍。
3 讨 论
目前,针对缺血性脑卒中,临床治疗方法主要是尽早恢复大脑局部血流供应,从而降低脑卒中发病后死亡、残疾或者功能障碍的发生率以及严重程度[13]。由于病人年龄、缺血部位和时间及局部神经细胞自我修复能力等因素存在差异,部分病人治疗后可能由于血流量的恢复而加剧脑损伤,即诱发缺血再灌注损伤,因而引起的瘫痪、感觉减退、失语、吞咽困难和认知障碍的发生率很高,加之中枢神经系统的再生能力有限,脑缺血再灌注损伤病人往往终身残疾[14-15]。研究表明,干细胞移植治疗逐渐成为脑缺血再灌注损伤的新疗法[16]。NSCs由于可以分化成多种类型的神经细胞,已成为治疗脑缺血再灌注损伤的理想候选干细胞类型[17]。然而,NSCs的获取和移植后在富含活性氧、炎症因子缺血微环境中的低存活率和低分化率限制了其临床应用[18]。因此,寻找合适的NSCs来源,探索其对脑缺血再灌注损伤的临床治疗具有重要意义。
相关研究结果表明,间充质干细胞(MSCs)在某些特定的条件下可以分化为NSCs或者神经祖细胞(NPC)[19-20]。bFGF和EGF是诱导MSCs成为NSCs的关键因子,且生长因子诱导的NSCs存活时间明显长于化学诱导者[21]。本研究在此基础上,添加EGF和bFGF诱导hUC-MSCs形成NSCLCs,并探究NSCLCs移植后对脑缺血再灌注损伤大鼠的保护作用。
动物行为学检测指标是判断脑缺血再灌注损伤治疗效果的重要指标之一[22]。本研究结果表明,NSCLCs移植后大鼠的神经行为学评分较MCAO/R组显著提高,表明NSCLCs治疗可以改善脑缺血再灌注损伤大鼠的神经功能缺损。脑缺血再灌注发生可导致神经元损伤加剧,加上神经元自身无法再生,因此,减轻神经元损伤、促进其再生是治疗脑缺血再灌注损伤的重要思路之一[14]。本实验HE染色和神经元NeuN表达检测结果显示,NSCLCs治疗可显著改善MCAO/R导致的神经元损伤,并增强NeuN表达水平。
综上所述,本研究通过细胞因子诱导法实现了hUC-MSCs向NSCLCs的诱导分化,并初步证实了NSCLCs移植对MCAO/R损伤大鼠具有较好的治疗效果,这为脑缺血再灌注损伤的治疗提供了新的思路。
