基于MRI影像组学预测乳癌NAC病理完全缓解价值
2023-12-14王晓琳韩珺琪刘晶晶钟鑫陈静静
王晓琳,韩珺琪,刘晶晶,钟鑫,陈静静
(青岛大学附属医院,山东 青岛 266003 1 乳腺影像科; 2 放射科)
自2020年以来,乳癌已超过肺癌成为女性最常见的癌症[1]。新辅助化疗(NAC)是晚期局限乳癌的标准治疗方案,NAC使肿瘤降期,并且减少了乳癌根治性手术后复发[2]。NAC的疗效根据术后标本的病理反应评估,病理完全缓解(pCR)是NAC的疗效终点,疗效达到pCR的病人预后优于未达到pCR的病人[3]。然而,相关研究显示仅有19%的病人能够在NAC后达到pCR[4],因此在化疗前对病人进行疗效预测至关重要。近年来影像组学广泛用于肿瘤良恶性鉴别、恶性肿瘤预后评估等方面[5]。多参数MRI能够监测和评估肿瘤的异质性,提供反映肿瘤生理和病理特征的宝贵信息[6]。本研究回顾性分析了两个医疗机构的病例,探讨影像组学特征及临床特征与pCR之间的联系,为乳癌病人治疗提供参考。现将结果报告如下。
1 资料与方法
1.1 一般资料
回顾性收集2016年9月1日—2021年12月31日间两个医疗机构收治、经病理证实的乳癌病人387例。纳入标准:①女性原发乳癌(经穿刺活检确诊为浸润性乳癌);②病人术前接受NAC;③NAC前1个月内行穿刺病理活检及乳房动态对比增强磁共振(DCE-MRI)检查;④病人均在NAC后接受手术治疗,完成病理疗效评价。排除标准:①DCE-MRI检查前行切检术、放化疗或手术治疗;②隐匿性乳癌;③MRI图像序列不全;④未行NAC前超声引导下穿刺活检。387例乳癌病人年龄24~70岁,平均(50.2±9.7)岁。机构Ⅰ纳入305例病人,按照7∶3的比例分为训练集和测试集;机构Ⅱ纳入82例病人作为独立的外部验证集。
1.2 检查方法
机构Ⅰ、机构Ⅱ均使用3.0 T MRI设备(GE discovery MR 750w 3.0 T,Siemens Magneton Prisma MR 3.0 T)进行MRI扫描,使用8通道相控阵体线圈。常规扫描序列:轴向T2加权成像(T2WI)、脂肪抑制T2加权成像(SPAIR T2WI)、轴向T1加权成像(T1WI)、轴向扩散加权成像(DWI)序列并且重建表观扩散系数(ADC)图以及轴向动态对比增强(DCE)序列。机构Ⅰ动态增强扫描包括蒙片在内的6次扫描,每次扫描时间100 s;机构Ⅱ动态增强扫描包括蒙片在内的8次扫描,每次扫描时间61 s。两个机构DCE-MRI对比剂均选用钆喷酸葡胺注射液,使用高压注射器经手背静脉团注,注射剂量为0.1 mmol/kg,流量2 mL/s,随后以相同流量注射20 mL生理盐水冲管。
1.3 临床及病理资料收集
由医院病历系统中收集病人临床及病理资料,临床资料包括年龄、性别、绝经状态、转移淋巴结、化疗方案及化疗周期;病理资料包括分子分型、雌激素受体(ER)状态、孕激素受体(PR)状态、人表皮生长因子受体-2 (HER-2)状态、Ki-67状态。
1.4 MRI图像分析
所有MRI图像特征均采用双盲法由两名高年资乳腺专业放射科医生在PACS工作站进行观察,并最终讨论达成一致意见,主要影像资料包括:①肿瘤T2WI信号(高、等、低信号);②蒙片期肿瘤信号(高、等信号);③时间信号强度曲线(TIC)模式(平台型、流出型);④背景实质强化程度(BPE,轻微、轻度、中度和明显强化);⑤肿瘤病灶最小和平均ADC值;⑥乳腺腺体构成(脂肪型、散在腺体型、不均匀致密型、致密型)。
1.5 影像组学分析
由具有5年乳腺放射学经验的医师使用3D Slicer(www.slicer.org)软件对增强扫描第一期、DWI和ADC序列图像进行肿瘤分割,手动逐层勾画肿瘤边缘作为感兴趣区(ROI);1个月后由另一位具有5年乳腺放射学经验的医师从训练队列和验证队列中随机选择40例病人进行第二次ROI手动分割和提取,测量观察者间相关系数(ICC),评估两名观察者之间的一致性。ICC>0.75为具有良好的一致性[7]。
对原始图像以及ROI进行预处理,对图像进行重采样(每个体素为1 mm×1 mm×1 mm),并对灰度值进行归一化处理。使用PyRadiomics 3.0.1(https://github.com/Radiomics/pyradiomics)进行特征提取,基于ROI从每个MRI序列图像中分别提取1 132个定量影像组学特征。影像组学特征筛选及模型建立:①采用Pearson相关系数选择与生物标志物高度相关的特征;②利用最小绝对收缩与选择算子(LASSO)算法选择最有用的预测特征组合;③根据选择特征的系数进行加权并线性组合计算,得到影像组学分数(Radscore)。
1.6 预测模型构建
通过对临床和影像学资料进行单因素及多因素分析并引入信息学中的Akaike信息准则(AIC)来筛选临床及影像学特征,筛选出pCR的独立预测因素建立临床模型。随后,将Radscore与临床模型联合建立综合模型并绘制列线图。
1.7 统计学分析
采用R软件(v.3.6.2, https://www.Rproject.org)进行统计学分析。对训练集资料进行单因素分析及多因素logistic回归分析;使用Pearson相关系数和LASSO分析进行影像组学特征筛选;应用ROC曲线、校准曲线、DCA曲线评价模型的预测效能。P<0.05表示差异有显著性。
2 结 果
2.1 影像组学特征提取、筛选和影像组学模型构建
基于多序列MRI(增强扫描第一期、DWI和ADC)中筛选的影像组学特征建立影像组学模型,通过Pearson相关系数筛选后保留了129个相关的影像组学特征(图1a),随后应用LASSO回归分析对保留特征进行筛选,最终影像组学模型保留了26个影像组学特征,分别为T1WI+C序列8个特征、DWI序列9个特征和ADC序列9个特征,作为最稳健的预测因子(图1b、c)。Radscore通过对所选特征的系数加权求和计算获得(图1d)。

a:Pearson相关系数分析特征的相关性热图,颜色越趋近于红色代表相关性越强(Pearson相关系数趋近于1);b:LASSO回归分析不同λ值下的交叉验证图;c:影像组学特征在模型中的系数曲线图,虚线对应最佳λ值的位置和筛选出的非零系数特征,最佳λ值处筛选出特征为26个;d:Radscore筛选的26个特征及每个特征对组学模型的贡献分布。
2.2 临床及影像学因素分析
2.2.1训练集、测试集及外部验证集临床及影像学因素的单因素分析 训练集、测试集和外部验证集中乳癌病人pCR组和非pCR组的临床因素、病理因素及影像学特征比较见表1~3。单因素分析结果显示,PR表达、ER和PR表达状态、Ki-67表达、腋下淋巴结转移、NAC方案、TIC形式最小ADC值差异有统计学意义(P<0.05)。
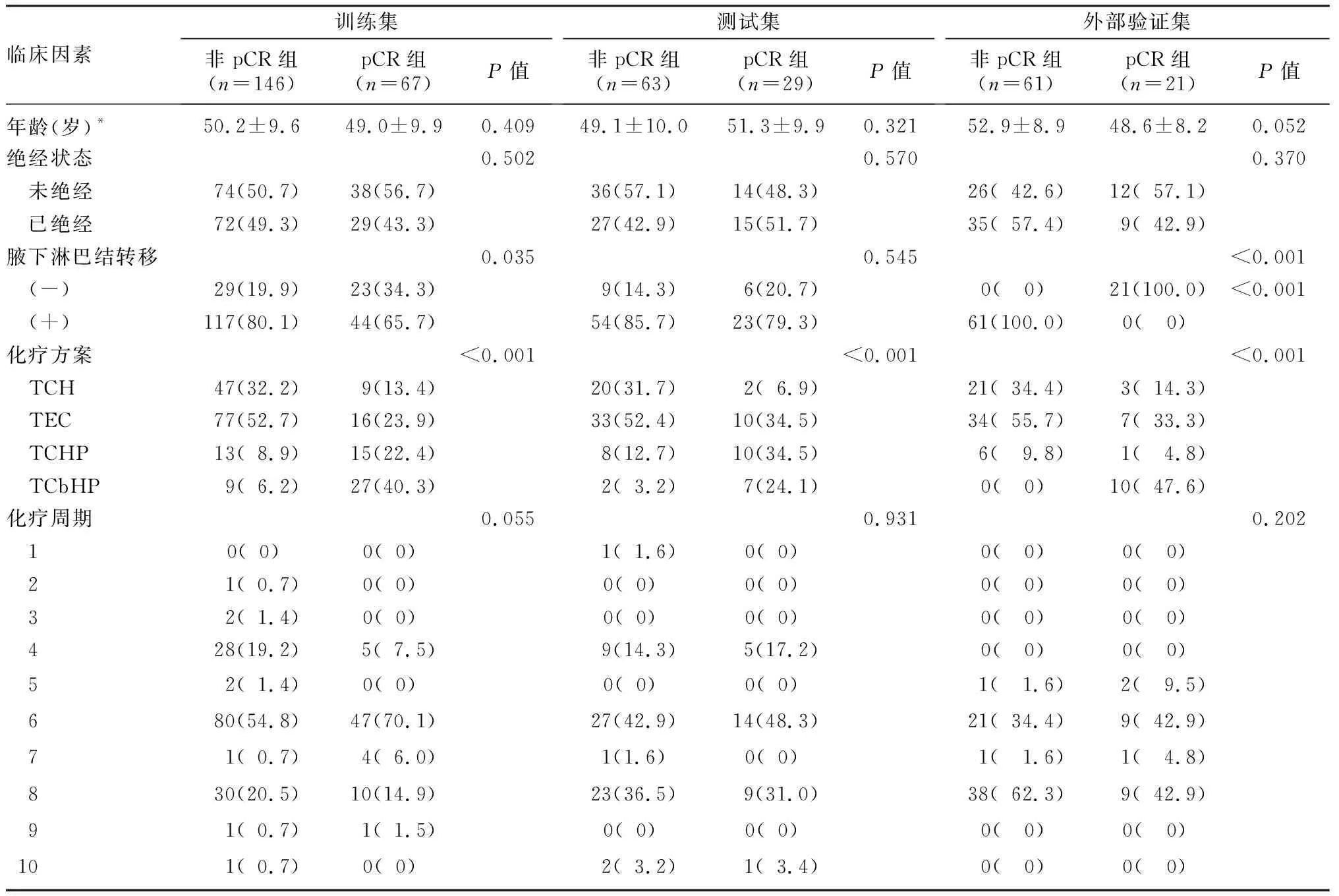
表1 训练集、测试集和外部验证集中LABC病人pCR组和非pCR组临床因素的比较(例(χ/%))

表2 训练集、测试集和外部验证集中LABC病人pCR组和非pCR组病理因素的比较(例(χ/%))

表3 训练集、测试集和外部验证集中LABC病人pCR组和非pCR组的影像表现的比较(例(χ/%))
2.2.2训练集、测试集及外部验证集临床特征多因素分析 将单因素分析有意义的变量(P<0.05)进行向后逐步logistic回归分析,根据最小AIC标准分析显示,Ki-67表达状态、NAC方案、TIC形式和最小ADC值为pCR的独立预测因素(P<0.05)。见表4。
2.3 综合模型的建立和预测效能的评估
根据筛选出的临床特征及Radscore联合建立综合模型,并绘制列线图(图2a),其中包含4个临床特征(Ki-67表达状态、NAC方案、TIC形式及最小ADC值)及Radscore。应用校准曲线评价列线图在训练集、测试集及外部验证集的表现(图2b~d),结果显示列线图在3个集合中均校正良好。
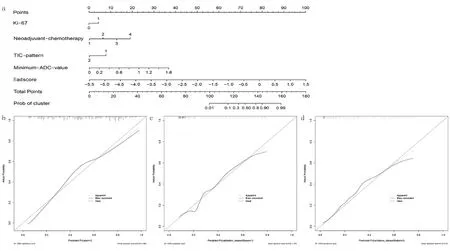
a为综合模型列线图:b~d为列线图在训练集、测试集和外部验证集的校准曲线,虚线为标准值,实线为校正值,3个集合中列线图均与标准线贴合,表明校正良好。
对影像组学模型、临床-影像模型和综合模型绘制ROC曲线和DCA曲线,评价模型对训练集、测试集和外部验证集预测效能和临床适用性。ROC曲线显示,影像组学模型AUC值分别为0.93、0.81和0.84,临床-影像模型的AUC值分别为0.88、0.86和0.74,综合模型AUC值分别为0.97、0.90和0.86,综合模型对乳癌病人NAC后pCR发生的预测效能最好。见表5。另外,DCA曲线显示,综合模型相较于单独临床模型及影像组学模型具有更大的临床净收益,且适用范围更广。见图3。

表5 不同模型对训练集、测试集和外部验证集LABC病人NAC后达到pCR预测效能
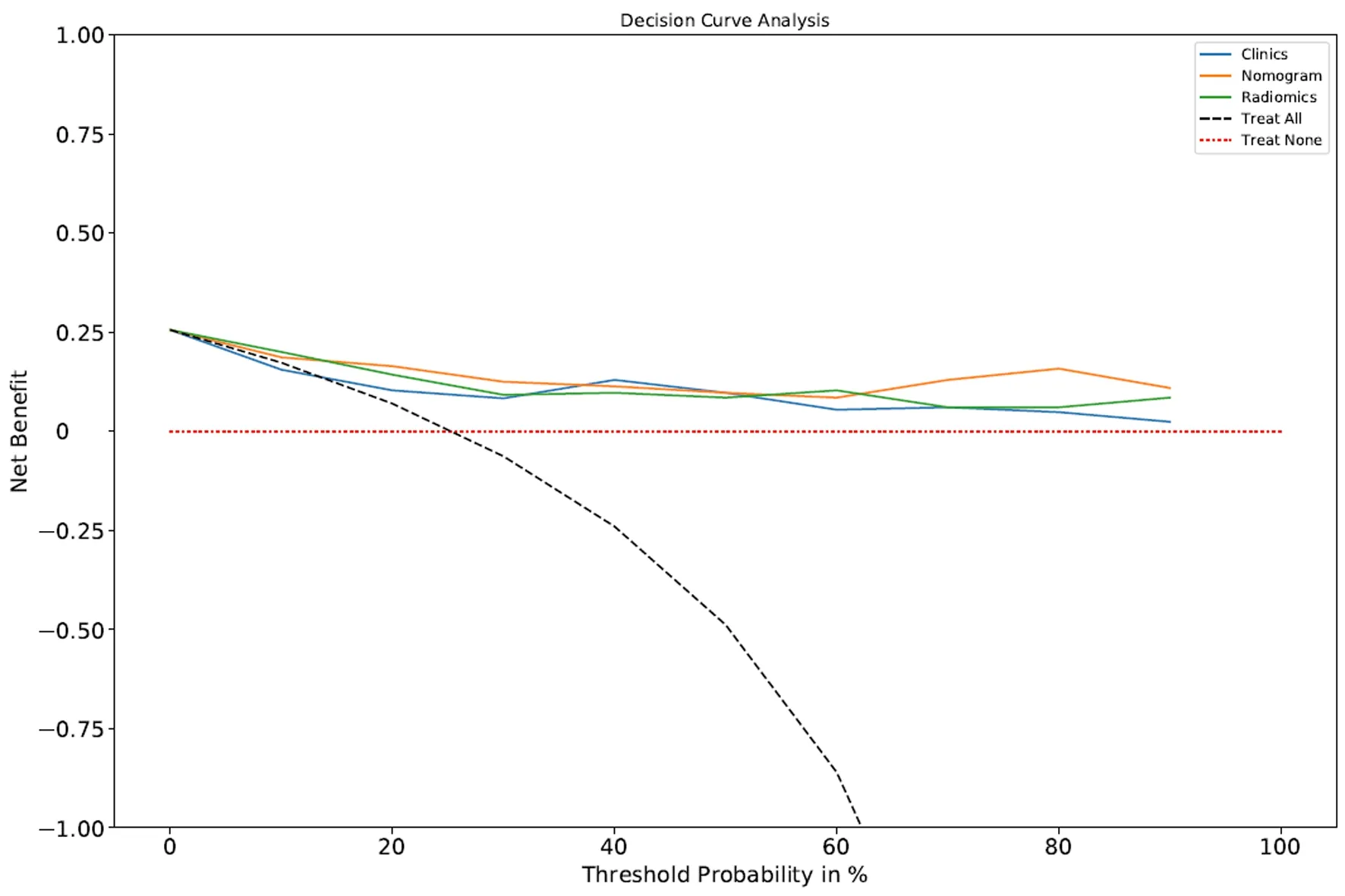
蓝色线表示临床模型(clinics),橙色线表示列线图(nomogram),绿色线表示影像组学模型(radiomics)。
3 讨 论
本文研究构建并验证了一个基于多参数MRI及临床影像特征的综合模型,以列线图的形式显示。该列线图在训练集、测试集和外部验证集中预测乳癌病人NAC后的pCR方面,均表现出良好的效能且具有良好的校准和诊断价值。
既往研究结果显示,生物标志物及影像特征参数与pCR相关[8-10]。本文研究结果显示,PR表达状态、Ki-67表达状态、ADC值是独立的pCR相关预测因子。本文研究构建了预测pCR的临床模型,结果显示,较高的ADC值与pCR有相关性,原因是ADC可反映肿瘤结构的微环境,如肿瘤细胞、水含量、纤维基质的数量和细胞膜完整性等。有研究显示,曲妥珠单抗和帕妥珠单抗联合使用可显著改善pCR[11],推断使用TCbHP化疗方案的病人更容易达到pCR,原因可能与其中包含的双靶药物(曲妥珠和帕妥珠单抗)有关。本研究观察到TIC Ⅲ型病变(即流出型病变)难以实现pCR,是由于肿瘤病灶药物流出增加,血管性/渗透性增加,使得肿瘤病灶对治疗抵抗力增大[12]。
LIU等[13]进行的一项包含586例病人的多中心回顾性研究显示,相较于临床模型,包含多参数MRI影像组学特征和临床特征的联合模型在预测pCR方面的表现更好。本文研究对多序列图像进行特征筛选和建模,经验证模型具有良好的性能,与上述研究一致,XIONG等[14]基于多个MRI序列建立了列线图(包括ADC图),列线图显示有良好的预测性能,训练队列和验证队列中AUC值分别为0.916和0.830。本研究从增强扫描第一期、DWI及ADC序列图像中分别选取了8、9及9个影像组学特征,结果表明在多序列MRI图像中增强扫描序列能够反映肿瘤血流动力学,DWI及ADC序列可以反映肿瘤异质性及肿瘤组成成分及密度,可以通过影像组学提取定量组学信息,量化乳癌肿瘤病灶的影像学表现,以此建立的影像组学模型可以用于预测乳癌NAC后pCR。
本研究建立了临床模型、影像组学模型和综合模型列线图,其中列线图在预测pCR方面表现最好,与既往研究结果相同[14-17]。此外,本文研究是一项双中心研究,在外部验证队列中,列线图预测pCR的AUC值为0.86,表明列线图是稳健的,在未来的临床试验中可以使用列线图来预测乳癌病人NAC后是否可达到pCR,从而筛选出适合接受NAC治疗的病人。
本文研究存在以下局限性:①研究进行了外部验证,队列大小限制和选择偏差无法避免,后续需要在较大样本中进行独立验证,以开发临床所需的独立预测因素;②ROI是通过手动分割来描绘的,这可能会导致序列之间的偏差,后续研究将对ROI进行半自动分割配准,减少主观勾画导致的偏倚。
综上所述,基于多参数MRI影像组学联合临床-影像因素建立综合模型及综合模型列线图,可以预测LABC病人NAC后是否可实现pCR,为临床选择治疗方案提供了新方法。
