SLC7A11 基因的生物信息学分析及其在热射病大鼠心肌组织细胞中的表达研究
2023-12-14陈丹丹武晓敏邓紫薇李佩玲李光华
陈丹丹, 武晓敏, 邓紫薇, 李佩玲, 李光华,, 耿 瑶
(1.宁夏医科大学基础医学院生理学系,银川 750004; 2.宁夏回族自治区人民医院心血管外科,宁夏医科大学第三临床医学院,银川 750004; 3.宁夏医科大学公共卫生学院,银川 750004;4.宁夏医科大学护理学院,银川 750004)
溶质载体家庭成员7A11(solute carrier family 7 member 11,SLC7A11)基因位于人类第4 号染色体[1],其编码的蛋白SLC7A11 为胱氨酸/谷氨酸反转运体的轻链亚基与重链亚基SLC3A2 组成System Xc-系统,负责维持System Xc-系统的基本转运活性[2-3],合成谷胱甘肽(glutathione,GSH),保护细胞免受氧化应激损伤,对细胞的正常生长尤为关键[4-5]。研究[6]发现,SLC7A11 表达减少,可导致GSH 合成减少、GSH 过氧化物酶4(glutathione peroxidase 4,GPX4)的活性下降,从而生成大量脂质活性氧,引起细胞发生铁死亡。SLC7A11/GPX4 信号通路是介导铁死亡的核心通路。
热射病(heat stroke,HS)的发生率和死亡率在全球范围内呈上升趋势,严重危害公众健康[7]。HS 可导致心血管系统发生多种毒性作用,如炎症反应、氧化应激及凋亡[8-9]等,但其完整的发病机制尚不清楚。现阶段,HS 治疗更多的分子机制仍有待深入挖掘。SLC7A11 诱导HS 大鼠心肌铁死亡是否发挥关键作用,是否存在研究潜能有待考究。因此,本研究通过利用各种生物信息学网络平台深入研究SLC7A11 磷酸化、N-糖基化、抗原性和免疫原性等性质,以期预测SLC7A11 受调控的可能潜在性能,并初步通过体内和体外实验探究SLC7A11 在HS 大鼠心肌组织及高温干预的H9C2 大鼠心肌细胞中的表达水平,为后续深入研究并揭示HS 所致心肌铁死亡的潜在分子机制提供理论依据。
1 材料与方法
1.1 SLC7A11 氨基酸序列
从美国国家生物技术信息中心(NCBI)数据库检索人SLC7A11 基因的相关信息,其蛋白登录号为XP_054205473.1。
1.2 主要试剂与仪器
SLC7A11 抗体(DF12509,美国Affinity Biosciences 公司)、GPX4 抗体(67763-1-Ig,北京博蕾德生物科技有限公司)、GAPDH 抗体(E-AB-20059,武汉伊莱瑞特生物科技股份有限公司);BCA 蛋白含量检测试剂盒(KGPBCA,江苏凯基生物技术股份有限公司)、总RNA 提取试剂盒[DP419,天根生化科技(北京)有限公司]、TaKaRa反转录试剂盒[RR820A,宝日医生物技术(北京)有限公司]、TaKaRa PCR 试剂盒[RR047A,宝日医生物技术(北京)有限公司]、Liproxstatin-1(HY-12726,上海皓元生物医药科技有限公司);ZRS-1JSW 智能人工气候培养室(杭州钱江仪器设备有限公司)、高速组织冷冻研磨器(上海净信实业发展有限公司)。
1.3 生物信息学分析
采用表1 所列基因分析工具[10-11]对人SLC7A11基因的氨基酸序列进行生物信息学分析。
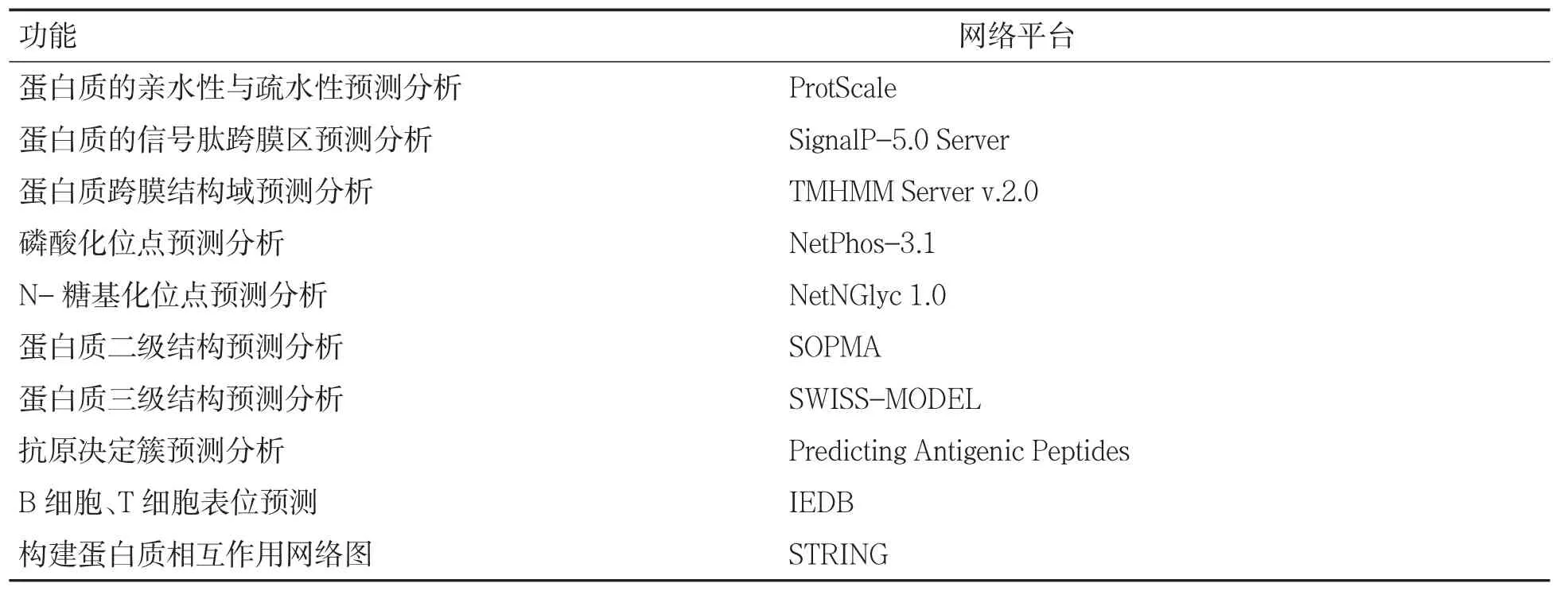
表1 人SLC7A11 基因生物信息学预测分析网络平台
1.4 实验分组及模型的构建
1.4.1 体内实验 SPF 级雄性SD 大鼠由宁夏医科大学实验动物中心提供(实验动物质量合格证号:2020-0001)。本研究经宁夏医科大学实验动物伦理委员会审批(2017-030)。将12 只SD 大鼠随机分为对照组与HS 组,每组6 只,对照组SD大鼠置于室温(25±1)℃的环境中,HS 组大鼠先置于温度(36±0.5)℃、湿度(65±5)%的人工仿真气候动物舱内使大鼠维持一定的体温,再将气候舱温度设置为(40±0.5)℃、湿度(65±5)%开始热暴露诱发HS,直至直肠温度达到42 ℃,立刻将其转移至温度为(25±1)℃的环境中恢复12 h,即模型建立成功,热暴露期间,两组大鼠均禁食、禁水。
1.4.2 体外实验 H9C2 心肌细胞株购自上海中乔新舟生物科技有限公司,实验分为对照组、铁死亡抑制剂(Liproxstatin-1)组、HS 组和HS+Liproxstatin-1 组,对照组细胞置于37 ℃培养箱培养,HS 组细胞在43 ℃培养箱中培养2 h 后,置于37 ℃环境恢复3 h,即模型建立成功,Liproxstatin-1 组和HS+Liproxstatin-1 组在置于43 ℃培养箱前2 h 加入Liproxstatin-1(25 μmol·L-1),2 h后,Liproxstatin-1 组在37 ℃环境中培养,HS+Liproxstatin-1 组细胞在43 ℃培养箱中培养2 h后,置于37 ℃环境恢复3 h,最后收取各组细胞。
1.5 Western blot 检测SLC7A11 与GPX4 的蛋白表达水平
将SD 大鼠麻醉后,取其心脏,切取100 mg心肌组织剪碎后加入1 mL 裂解液,收集干预细胞后加入适量的裂解液,置于高速组织冷冻研磨器进行充分破碎,4 ℃条件下20 000 r·min-1离心5 min,静置10 min,将提取的总蛋白在99.5 ℃加热变性。配制10%的凝胶,上样80 V 电泳,80 V转膜,用快速封闭液封闭30 min,PBST 洗3 次/10 min;加入一抗SLC7A11(1 ∶500)、GPX4(1 ∶1 000)及GAPDH(1∶5 000)4 ℃孵育过夜,PBST洗3 次/10 min;加入辣根过氧化物酶标记的山羊抗兔IgG(1∶5 000)室温孵育1 h,PBST 洗3次/10 min,最后使用ECL 超敏发光液显色曝光条带,用Image J 软件分析结果。
1.6 RT-qPCR 检测SLC7A11 与GPX4 的mRNA水平
使用天根试剂从心肌组织和心肌细胞中提取总RNA,根据说明书使用PrimeScriptTMRT Master Mix 将RNA 逆转录为cDNA。采用SYBRR Premi Ex TaqTM试剂盒进行qPCR 扩增目标cDNA,选择GAPDH 为内参。PCR 引物由武汉赛维尔生物科技有限公司设计和合成。引物序列如下:SLC7A11-F(5’-TATGCTGAATTGGGTACG AGC-3’),SLC7A11-R(3’-TATTACCAGCAGTTCC ACCCA-5’);GPX4 -F(5’-AGGCAGGAGCCAGG AAGTAATC-3’),GPX4-R(3’-ACCACGCAGCCG TTCTTATC-5’);GAPDH -F(5’-CTGGAGAAAC CTGCCAAGTATG-3’),GAPDH-R(3’-GGTGGAA GAATGGGAGTTGCT-5’)。PCR 循环如表2 所示。取各组Ct 值2-ΔΔCt作为统计结果。

表2 RT-qPCR 程序
1.7 统计学方法
采用SPSS 22.0 软件进行数据分析,GraphPad 8.0 软件绘图。符合正态分布的数据以均数±标准差(±s)表示,采用单因素方差(One-way ANOVA)分析,进一步两两比较采用Tukey 检验。P≤0.05为差异有统计学意义。
2 结果
2.1 SLC7A11 基因编码蛋白产物的疏水性、亲水性
预测SLC7A11 基因编码蛋白质的亲水性与疏水性结果显示(图1),超过50%的氨基酸疏水峰大于0,推测该蛋白可能是疏水性蛋白。其中,该蛋白质上异亮氨酸(Ile)疏水性最强(+4.500 0),精氨酸(Arg)亲水性最强(-4.500)。

图1 SLC7A11 基因编码蛋白产物的亲、疏水性预测分析
2.2 SLC7A11 蛋白信号肽跨膜区和跨膜结构域
预测分析SLC7A11 蛋白信号肽跨膜区,结果显示(图2A),SLC7A11 存在信号肽的可能性为0.864 5,其切割位点位于第29~30 位氨基酸。对SLC7A11 蛋白跨膜区域结构进行预测分析,结果显示(图2B),该基因编码产物可能存在12 个跨膜螺旋结构,跨膜螺旋中氨基酸的预期数量为256.980 47(跨膜螺旋中氨基酸数量>18 可能为跨膜蛋白),膜细胞质侧为N 端的概率为0.996 36,预示SLC7A11 可能为跨膜蛋白。

图2 SLC7A11 基因编码蛋白的信号肽跨膜区域和跨膜区结构域预测分析
2.3 SLC7A11 蛋白的磷酸化位点及N-糖基化位点预测
预测结果显示,SLC7A11 基因编码的蛋白可能含有40 个磷酸化位点(图3A),其中含有磷酸化丝氨酸位点20 个,磷酸化苏氨酸位点17 个,磷酸化酪氨酸位点3 个,并且可能存在12 个N-糖基化位点(图3B)。

图3 SLC7A11 基因编码蛋白磷酸化位点和N-糖基化位点预测分析
2.4 SLC7A11 蛋白二级结构和三级结构预测
通过预测SLC7A11 蛋白的二级结构,结果显示(图4A),其中含有α 螺旋(Hh)216 个,占43.11%;β-折叠(Ee)117 个,占23.35%;β-转角(Tt)24 个,占4.79%;无规卷曲(Cc)144 个,占28.74%。同源建模预测SLC711 三级结构,结果显示(图4B),SLC7A11 蛋白的三级结构预测与模板覆盖率为100%,模型GMQE 评分为0.80,预测模型可靠。

图4 SLC7A11 蛋白二级结构和三级结构预测分析
2.5 SLC7A11 蛋白的抗原决定簇预测分析
对SLC7A11 蛋白抗原决定簇进行预测,结果显示(图5),SLC7A11 表达蛋白的平均抗原倾向指数为1.064 1,共含有15 个抗原决定簇区域。
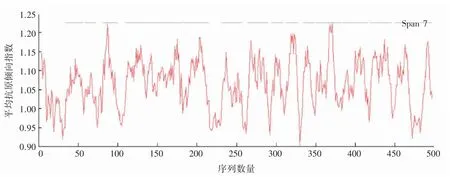
图5 SLC7A11 蛋白抗原决定簇预测分析
2.6 筛选与SLC7A11 蛋白有相互作用的蛋白
通过STRING 数据库检索与SLC7A11 蛋白相互作用的蛋白,筛选出与SLC7A11 作用关系最为密切的蛋白,结果显示(图6),SLC7A11与GPX4、CD44、SLC3A2、SLC1A7、SLC3A1、SLC1A2等蛋白存在相互作用关系,且比其他蛋白作用关系更为紧密。

图6 SLC7A11 蛋白PPI 图预测分析
2.7 各组大鼠心肌组织中SLC7A11 与GPX4 的表达水平
与对照组相比,HS 组大鼠心肌组织中SLC7A11(P<0.05)与GPX4(P<0.01)mRNA 和蛋白水平均降低(图7)。
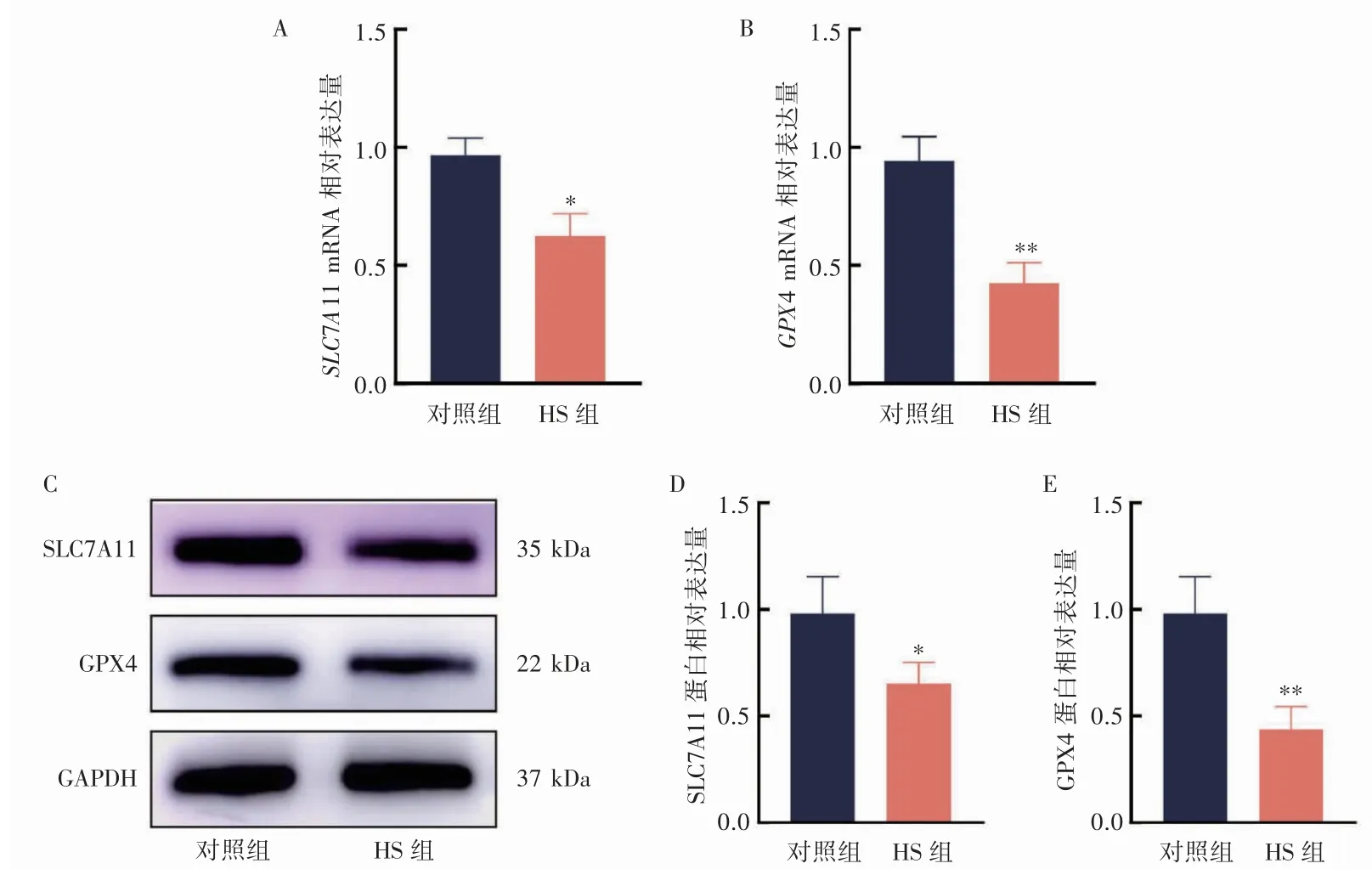
图7 大鼠心肌组织中SLC7A11 与GPX4 mRNA 和蛋白表达水平
2.8 各组H9C2 大鼠心肌细胞中SLC7A11 与GPX4的表达水平
与对照组相比,Liproxstatin-1 组SLC7A11 和GPX4 mRNA 和蛋白水平差异均无统计学意义(P均>0.05),HS 组SLC7A11 与GPX4 mRNA 和蛋白水平均降低(P 均<0.05);与HS 组相比,HS+Liproxstatin-1 组SLC7A11(P<0.05)和GPX4(P<0.01)mRNA 和蛋白水平均升高(图8)。

图8 H9C2 细胞中SLC7A11 与GPX4 mRNA 和蛋白表达水平
3 讨论
SLC7A11 为一种氨基酸转运蛋白,对维持细胞生长和氧化还原具有重要意义[4-5]。2012 年Dixon等[12]首次提出铁死亡,即铁依赖性脂质活性氧堆积导致的细胞死亡。SLC7A11 作为重要的铁死亡相关蛋白,其下调可通过抑制半胱氨酸代谢通路,导致细胞内胱氨酸水平降低和GSH 生物合成耗竭,间接抑制GPX4 的活性,进而导致脂质过氧化物堆积,最终诱导细胞发生铁死亡[6]。在心肌缺血再灌注、心肌梗死、心力衰竭、心脏移植等心血管疾病多种实验模型中,SLC7A11 所介导的铁死亡对分子和代谢调控机制均发挥关键作用,且通过抑制铁死亡可以得到改善[13-15]。HS 是一种最严重、最致命的中暑,病死率高于50%[16]。心脏被认为是HS 致机体损伤中最先、最易受损的对象之一[9]。心血管系统在HS 的发病过程中,在调节机体散热和热适应等方面发挥着至关重要的作用。研究[17]发现,HS 导致心血管功能发生异常的比例高达43.4%~65.2%。临床数据[18]显示,HS 所导致的心肌损伤疗效欠佳,预后较差,需要进一步深入挖掘HS 的发病机制,寻找新的分子标志物、新的治疗靶点为HS 的预后及靶向治疗提供新方案。现阶段,对SLC7A11 具体的调控机制尚不完全清晰,因此利用生物信息学深入研究SLC7A11 的基本性质、结构,预测其磷酸化位点、N-糖基化位点及其抗原决定簇,以期为临床中治疗热射病导致的心肌损伤提供新的研究靶点与理论依据。
SLC7A11 是含有信号肽的疏水性跨膜蛋白,参与多种心血管疾病[19-20],若将其作为干预靶点,不失为治疗HS 所致心肌损伤的潜在治疗思路。目前,对于SLC7A11 的研究主要聚焦于其沉默及过表达,关于其具体调控机制尚不完全清楚。本研究预测发现,SLC7A11 蛋白存在40 个磷酸化位点、12 个N-糖基化位点,这或许是其参与多种疾病的原因,深入探究其不同的磷酸化位点或N-糖基化位点,或许可为HS 所致心肌损伤的研究与治疗提供新的研究线索。深入探究二级结构与三级结构和致病机制间的相关性尤为重要。SLC7A11 的二级结构主要由α 螺旋、β-折叠及无规卷曲构成,具有抗原潜力。蛋白相互作用网络图预测显示,SLC7A11 与GPX4、CD44、SLC3A2、SLC1A7、SLC3A1、SLC1A2 等蛋白相互作用最为密切,这些蛋白主要与铁死亡相关疾病的发生和发展过程相关。本研究在大鼠心肌组织及H9C2心肌细胞中检测了SLC7A11 与GPX4 的表达水平,HS 大鼠心肌组织和高温干预的H9C2 心肌细胞中SLC7A11 与GPX4 表达减少。基于此,在细胞水平上加入了铁死亡抑制剂Liproxstatin-1进行探究发现,Liproxstatin-1 可改善高温干预导致的H9C2 心肌细胞SLC7A11 与GPX4 mRNA和蛋白水平的降低。因此,以SLC7A11 为靶点,以与其相互作用的蛋白为初步的研究方向进行深入研究,或许有助于对HS 所致的心肌损伤提供理论基础。
综上所述,本研究利用多种生物信息学网络平台对SLC7A11 进行预测分析,发现其是疏水性跨膜蛋白,存在磷酸化位点和N-糖基化位点且具有抗原性。HS 大鼠心肌组织和高温干预的H9C2 心肌细胞中SLC7A11 及与其相关蛋白GPX4 的表达水平减少,通过在细胞水平加入铁死亡抑制剂Liproxstatin-1 可改善SLC7A11 与GPX4 的降低,为后续研究SLC7A11 所介导的铁死亡在HS 心肌损伤中的调控机制提供新的研究思路及理论依据。
