西洛他唑抑制血小板活化改善脓毒症小鼠结肠动力的机制
2023-12-14蒋世秋檀佳璐李岩松
胡 娟, 蒋世秋, 檀佳璐, 杨 岚, 王 强, 李岩松
(1.西安交通大学第一附属医院麻醉手术部和脑科学中心,西安 710061; 2.陕西中医药大学,咸阳 712046)
脓毒症及脓毒症休克的死亡率可达60%[1]。肠道动力障碍是脓毒症的常见并发症,可导致肠道菌群聚集和移位,加重多器官功能衰竭,往往导致患者预后较差[2]。恢复肠道动力可能是改善脓毒症患者预后的重要手段之一,但尚无有效手段改善脓毒症患者肠道动力。脓毒症患者血小板呈活化状态,其分子标志物CD40 配体(CD40 Ligand,CD40L)浓度与预后呈负相关[3]。既往研究[4]发现,使用西洛他唑抑制血小板活化可降低脓毒症小鼠肠道黏膜屏障通透性,改善预后,且该作用与西洛他唑可能存在的增强心肌收缩力、扩张血管和降低炎性因子释放作用无关。肠神经胶质细胞(entericglial cell,EGC)是肠道组织中调控动力的关键细胞,已证实反应性EGC 可损伤肠道神经元并降低内毒素血症小鼠肠道动力[5]。然而,西洛他唑是否可以通过抑制血小板活化调控EGC 活性影响脓毒症小鼠肠道动力尚未见报道。基于此,本研究拟探索西洛他唑对脓毒症小鼠肠道动力的作用及其相关分子机制。
1 材料与方法
1.1 实验材料
1.1.1 动物 无特定病原体(specific pathogen Free,SPF)级C57BL/6 雄性小鼠,6~8 周龄,体质量20~25 g,购自西安交通大学医学部实验动物中心。所有小鼠饲养温度22~24 ℃,模拟正常白天黑夜环境,食物和饲料可自由获取。实验前禁食8 h,不限制饮水。实验过程遵循实验动物保护及伦理规范,并取得西安交通大学生物医学伦理委员会批准(2018-107)。将小鼠随机分为ctrl+溶剂(cmc)组、ctrl+西洛他唑(cilo)组、脂多糖(lipopolysaccharide,LPS)+cmc 组、LPS+cilo 组,每组25~30只。其中8~10 只用于结肠排珠实验和粪便性状检测,6~8 只用于血清提取和检测,4~6 只用于结肠移行性复合运动(CMMC)监测,6~8 只用于免疫印迹检测。实验中非必须处死的小鼠于实验结束后采用脱颈法执行安乐死。
1.1.2 主要试剂 西洛他唑购买自美国Med-ChemExpress 公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)ELISA 试剂盒均购自深圳欣博盛生物科技有限公司;可溶性CD40 配体(soluble CD40L,sCD40L)ELISA 试剂盒购自武汉云克隆科技股份有限公司;胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)兔抗购自GeneTex 公司;B 细胞表面抗原CD40 兔抗购自Abcam 公司;TNF 受体关联因子6(TNF receptor associated factor 6,TRAF6)鼠抗购自Santa Cruz Biotechnology 公司;三磷酸甘油醛脱氢酶(glyceraldehyde 3 phosphate dehydrogenase,GAPDH)兔抗购自ABcolonal 公司;山羊抗兔及抗鼠二抗均购自笛医生物科技有限公司。
1.2 脓毒症模型构建
小鼠适应性喂养结束后,按照前述分组及数量随机分配。在LPS+cilo 组和LPS+cmc 组,采用腹腔注射5 mg·kg-1的LPS 建立内毒素血症模型,在ctrl+cilo 组和ctrl+cmc 组小鼠腹腔注射等体积盐水作为对照。在ctrl+cilo 组和LPS+cilo组,用0.5%羧甲基纤维素钠盐(carboxymethyl cellulose sodium salt,CMC-Na)稀释西洛他唑(cilo,10 mg·kg-1),并于腹腔注射LPS 或盐水前2 h 和注射后12 h 灌胃给药。ctrl+cmc 组和LPS+cmc组小鼠仅给予等体积cmc。LPS 或盐水注射后48 h 进行后续实验检测。
1.3 肠道动力学观察
1.3.1 结肠排珠实验 实验前对小鼠禁食8 h,不限制饮水。使用异氟烷对小鼠进行吸入麻醉,用带刻度的软质塑料管将直径2 mm 的塑料珠通过其肛门推入结肠至2 cm 处。退出软质塑料管,将小鼠摆成仰卧位,待其翻正反射恢复后开始计时,以塑料珠排出肛门时间作为截直点,这段时间记录为结肠转运时间。
1.3.2 粪便干重及含水量测定 将小鼠分笼单独饲养,在早晨10~11 点禁食、禁水。收集每只小鼠该时间段的粪便并称重,记录为粪便湿重,然后将小鼠粪便放入60 ℃烘箱过夜,再次称重并将该质量记录为粪便干重。
1.4 CMMC 监测
实验前禁食8 h,对小鼠实施颈椎脱位安乐死后,沿腹正中线打开腹腔,小心游离结肠,于回盲部及直肠最远端离断,去除多余的肠系膜,结肠近端为oral 端,远端为anal 端。轻柔地挤出结肠内容物后,用K 氏液(NaCl 118 mol·L-1,KCl 4.6 mol·L-1,CaCl22.5 mol·L-1,MgSO41.2 mol·L-1,NaH2PO41 mol·L-1,NaHCO325 mol·L-1,葡萄糖5.6 mol·L-1,pH7.4)冲洗肠腔后将其置于装有K氏液的器官浴中。通过置于器官浴正上方7~8 cm高度的摄像头记录结肠的收缩活动。使用MATLAB R2018a 编写的边缘检测系统对视频记录进行分析。构建位于结肠近端-远端的每个点所在肠截面直径的时空地图,并用于量化CMMC的频率以及它们传播的速度和长度。
1.5 Western blot 检测小鼠结肠组织中GFAP、B细胞表面抗原CD40、TRAF6 蛋白表达量
取小鼠结肠组织,加入蛋白裂解液后充分研磨,超声震荡,离心后取上清,用BCA 法对结肠蛋白定量后将其煮沸变性备用。电泳并转膜后,脱脂封闭2 h。然后加入GFAP(1∶5 000)、B 细胞表面抗原CD40(1∶1 000)、TRAF6(1∶1 000)一抗过夜。第2 天加入二抗孵育后显色。使用上海勤翔ChemiScope 系列化学发光成像系统进行成像并分析条带灰度值。
1.6 ELISA 检测小鼠血清sCD40L、TNF-α、IL-1β 及结肠匀浆TNF-α、IL-1β 浓度
小鼠腹腔注射5 mg·kg-1LPS 或等体积生理盐水48 h 后,采用2%~3%异氟烷麻醉小鼠,摘取眼球取全血,室温静置1 h 后,2 000×g 离心10 min取上层血清,用于检测sCD40L、TNF-α 和IL-1β水平。采集小鼠结肠组织匀浆用于检测炎性因子TNF-α、IL-1β 水平。实验流程按相应ELISA 试剂盒说明书进行。
1.7 统计学方法
数据统计分析使用Graphpad Prizm 软件完成,计量资料用均数±标准差(±s)表示,组间比较采用单因素方差分析(Turkey 事后检验)。P≤0.05 为差异有统计学意义。
2 结果
2.1 西洛他唑抑制脓毒症小鼠血小板活化对结肠动力的影响
与ctrl+cmc 组小鼠相比,LPS+cmc 组小鼠结肠排珠时间延长(P 均<0.05),粪球数量减少(P<0.05),粪便质量和内容物减少(P<0.05);而服用西洛他唑抑制血小板活化的LPS+cilo 组小鼠与LPS+cmc 组相比结肠排珠时间缩短(P<0.05),粪球数量和粪便质量及内容物增加(P 均<0.05),见图1。

图1 西洛他唑抑制脓毒症小鼠血小板活化对肠道动力的影响
2.2 西洛他唑抑制脓毒症小鼠血小板活化对CMMC 的影响
与ctrl+cmc 组相比,脓毒症LPS+cmc 组小鼠CMMC 的频率减慢(P<0.05),范围缩小(P<0.05),速度减慢P<0.05)。服用西洛他唑抑制血小板活化的LPS+cilo 组小鼠较LPS+cmc 组CMMC 频率增加(P<0.05),CMMC 范围扩大(P<0.05),CMMC速度加快(P<0.05),改善了脓毒症小鼠肠道运动模式,见图2。
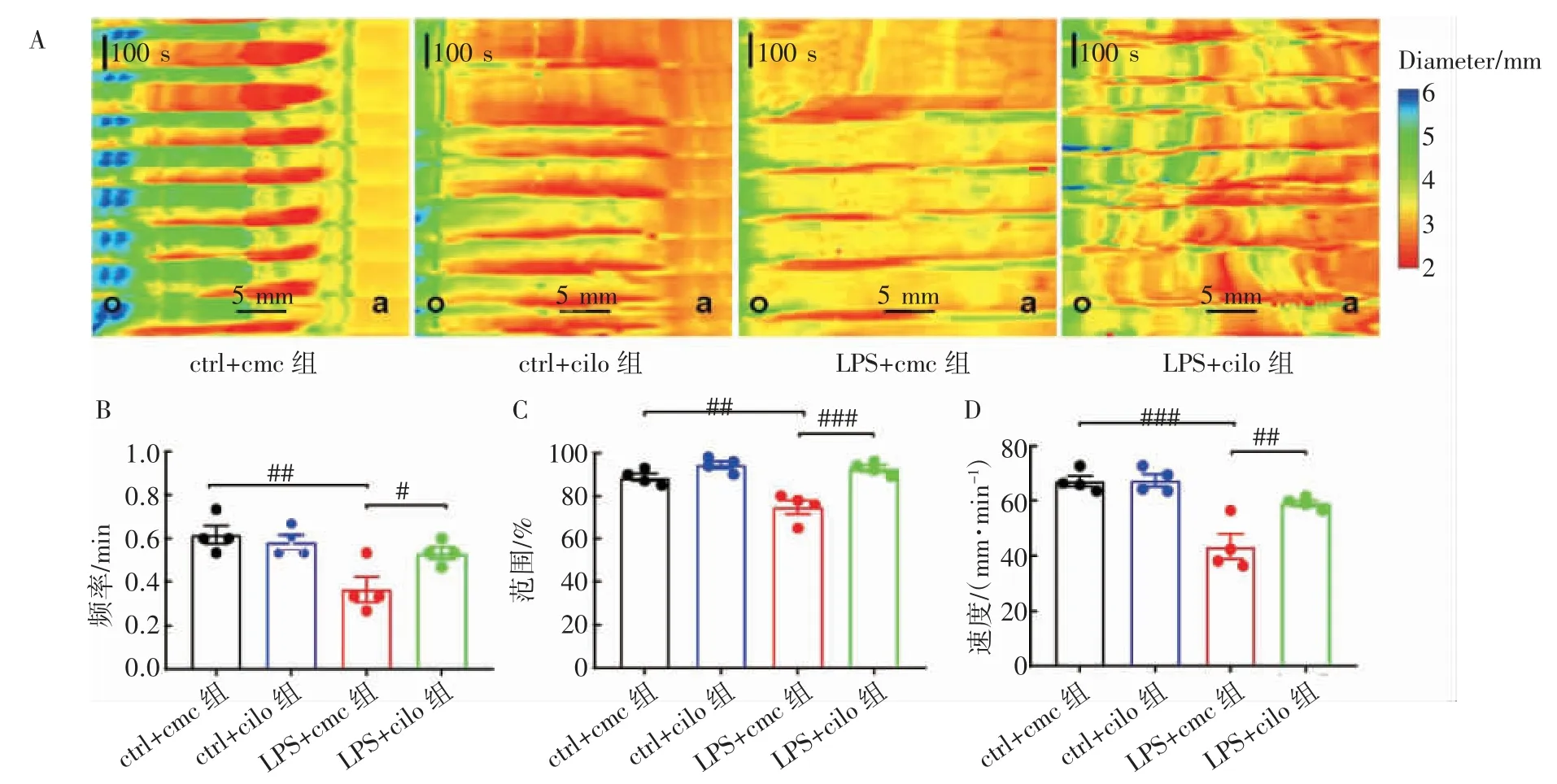
图2 西洛他唑抑制脓毒症小鼠血小板活化对CMMC 的影响
2.3 西洛他唑抑制脓毒症小鼠血小板活化对血清sCD40L 水平的影响
与ctrl+cmc 组相比,LPS+cmc 组小鼠血清sCD40L 水平提高(P<0.05),服用西洛他唑抑制血小板活化的LPS+cilo 组小鼠sCD40L 水平降低(P<0.05),见图3。
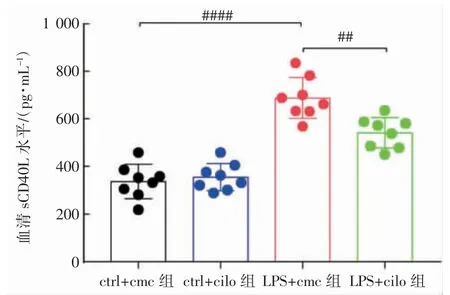
图3 ELISA 法检测西洛他唑抑制脓毒症小鼠血小板活化对血清sCD40L 水平的影响
2.4 Western blot 检测西洛他唑抑制血小板活化对脓毒症小鼠结肠B 细胞表面抗原CD40、TRAF6和GFAP 表达的影响
与ctrl+cmc 组相比,脓毒症LPS+cmc 组小鼠结肠组织匀浆B 细胞表面抗原CD40 表达增加(P<0.05),且TRAF6 及GFAP 水平均升高(P 均<0.05)。服用西洛他唑抑制血小板活化的LPS+cilo 组小鼠结肠匀浆中B 细胞表面抗原CD40、TRAF6 和GFAP 水平均较LPS+cmc 组均下降(P均<0.05),见图4。

图4 Western blot 检测西洛他唑抑制血小板活化对脓毒症小鼠结肠B 细胞表面抗原CD40、TRAF6 和GFAP 表达的影响
2.5 西洛他唑抑制脓毒症小鼠血小板活化对血清及结肠组织IL-1β 和TNF-α 水平的影响
与ctrl+cmc 组相比,脓毒症LPS+cmc 组小鼠结肠组织匀浆及血清中IL-1β 和TNF-α 水平均升高(P 均<0.05);服用西洛他唑抑制血小板活化的LPS+cilo 组小鼠结肠IL-1β 和TNF-α 水平较LPS+cmc 组均降低(P 均<0.05),但血清炎性因子水平差异均无统计学意义(P 均>0.05),见图5。
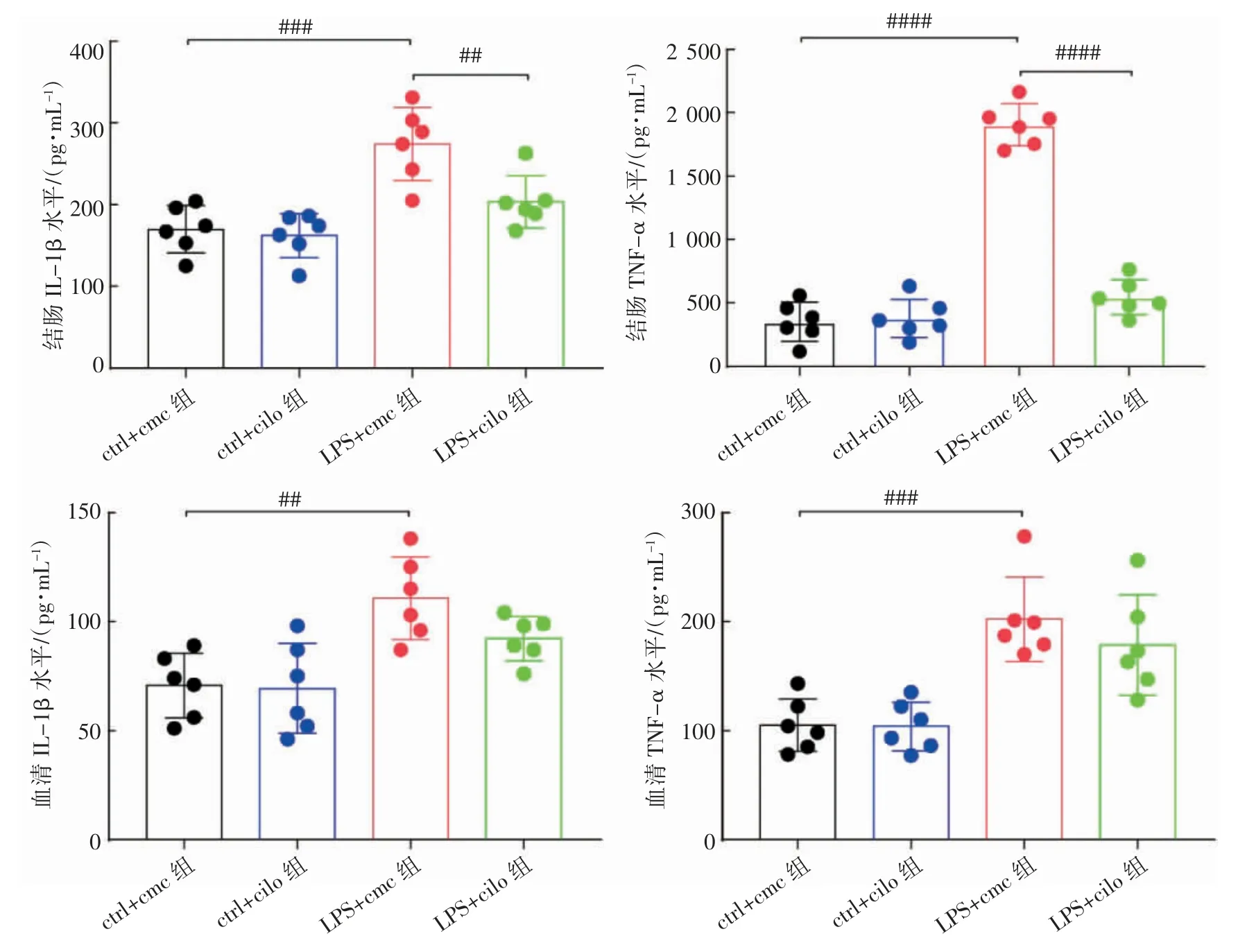
图5 ELISA 检测西洛他唑抑制脓毒症小鼠血小板活化对结肠和血清炎性因子水平的影响
3 讨论
肠道损伤往往出现在脓毒症病程早期,是多器官功能障碍综合征的重要表现[6]。肠道动力下降可致肠腔内容物堆积、压力增高、胃肠道供血供氧不足[6],进而诱发肠腔黏膜屏障损伤,导致细菌和毒素向全身转移,形成二次感染,加重或诱发多器官功能衰竭[7-8]。因此,改善肠道动力可能是改善脓毒症预后的关键策略之一。
脓毒症的动物模型一般分为3 类:细菌感染模型、内毒素模型和腹膜炎模型。盲肠结扎穿刺是一种腹膜炎模型,被认为是脓毒症研究的金标准。然而,该模型需要行腹部外科手术,可能会干扰胃肠道运动,诱导术后肠梗阻发生,进而脓毒症患者术后肠梗阻可能会掩盖镇静剂对胃肠蠕动的影响。此外,与使用细菌感染相比,LPS 诱导的内毒素模型更稳定,因此本研究对小鼠注射5 mg·kg-1的LPS 建立脓毒症模型。
血小板不仅是凝血过程的主要参与者,更为重要的是其具有强大的炎症反应调节能力,并参与天然免疫防御反应。脓毒症患者血小板往往处于活化状态,抑制血小板活化可改善脓毒症患者预后[9]。可能是基于抑制血小板活化可降低肺泡毛细血管通透性、缓解急性呼吸窘迫综合征[10],也可能是由于抑制血小板活化可改善肠道屏障功能,降低菌血症和毒血症严重性[11]。氯吡格雷和阿司匹林虽然在众多血小板激活抑制剂中脱颖而出被广泛应用于临床,但通常具有明显的胃肠道副作用和出血风险,而使用西洛他唑胃肠道出血风险低,抑制血小板的效果稳定[12]。本研究结果显示,抑制血小板活性可以增加CMMC 频率、扩大CMMC 范围、加快CMMC 速度,由此可缩短结肠排珠时间、增加粪便数量和粪球质量、降低粪便含水量,可有效促进肠道细菌及肠道毒素排出,提示抑制血小板可能是改善脓毒症肠道动力的重要策略,为后续临床研究提供了实验室依据和理论支持。
肠神经系统(enteric nervous system,ENS)是包埋在肠壁内的复杂神经网络,有调控肠道的吸收、分泌、运动、屏障、免疫等功能[13],主要由肠神经元和EGC 构成。在不同物种体内,EGC 数量是肠神经元的1 倍(小鼠)到7 倍(人类)[14],并紧密包绕在神经元周围。鉴于EGC 与中枢神经系统星形胶质细胞在形态和功能上具有相似性,有研究[15]认为其对肠道功能调控具有重要作用。前期研究[5]发现,IL-1β 和TNF-α 干预可诱导静息态EGC 转变为反应性EGC,其条件培养基可诱导肠道原代神经元突起减少、凋亡增加。在LPS 诱导的脓毒血症模型中,增加的反应性EGC及其释放的炎性因子可导致神经元减少及肠道动力下降,提示反应性EGC 可能通过释放炎性因子损伤肠神经元而抑制肠道动力[5]。因此,调控EGC可能是改善脓毒症肠道动力的又一关键环节。
临床证据表明,脓毒症患者血清中sCD40L水平较高[16],且其浓度与死亡率呈正相关[3]。血液中95%以上的sCD40L 源于活化血小板[17],并可调节内源性免疫[18]。因此,血浆中sCD40L 与CD62P 及PAC-1 一样可作为血小板活化的生物标志物[19]。由于血小板源性CD40L 可以激活星型胶质细胞和小胶质细胞,诱导高血压小鼠血脑屏障损伤[17],推测CD40L 亦可诱导EGC 向反应性EGC 转变并发挥相应作用。研究[4]证实,EGC 表达sCD40L 特异性配体CD40,也发现抑制血小板活化可降低血清sCD40L、下调CD40LCD40-TRAF6 信号通路,减少EGC 活化标志物GFAP 表达,提示抑制血小板活性可减少静息态EGC 向反应性EGC 转化。基于前期研究[5]发现,反应性EGC 条件培养基可诱导肠道原代神经元突起减少、凋亡增加,推测炎性因子可能是引起神经元损伤的重要介质,并最终导致肠道动力下降。本研究证实,抑制血小板活化可降低肠道组织TNF-α 和IL-1β 水平,但并不降低血清中这两种炎性因子浓度,提示抑制血小板活化可能通过减少反应性EGC 降低炎性因子释放水平,进而改善肠道动力。
综上所述,活化血小板通过CD40L-CD40-TRAF6 通路促进EGC 转变为活化EGC,增加后者炎性因子释放水平,最终引起脓毒症肠道动力下降。抑制血小板活化可降低EGC 活化水平,缓解炎症,为改善脓毒症肠道动力提供了新的策略。
