拮抗菌BJB01抗黄萎病的抗病效果评价
2023-12-14段平成郑凯张宇宏张国丽孙国清
段平成,郑凯,张宇宏,张国丽 ,孙国清
1.新疆农业大学农学院,棉花教育部工程研究中心,乌鲁木齐 830052;2.中国农业科学院生物技术研究所,北京 100081;3.新疆农垦科学院,新疆 石河子 832000
棉花是我国重要的经济作物,但棉花黄萎病为害严重,导致棉花大面积减产和品质下降[1]。棉花黄萎病是由大丽轮枝菌(Verticillium dahliae)引起的土传维管束病害,被称为棉花的“癌症”,可造成棉花植株萎蔫甚至枯死,该病原菌寄主广泛,易变异,危害严重[2]。当前生产上采用的化学防治可以起到一定的防治效果,但是会对生态环境造成严重的破坏。随着人们对生态环境的保护愈加重视,在棉花黄萎病的防治方面,亟需寻求一种对环境友好的防治方法[3]。已有研究发现,芽孢杆菌可作为拮抗菌使用,其对于动植物和自然环境无污染,而且防治效果更好。随着分子生物学技术的不断发展,通过基因改良技术能够进一步增强芽孢杆菌的抗病效果,有效抑制和防治黄萎病的发生。这种高效的生物防治方法,更安全有效,对环境无污染,具有广泛的应用前景。
本研究拟通过筛选、开发高效拮抗菌来防治棉花黄萎病,从而遏制病菌的危害,保护环境,以此来保障我国棉花产业健康可持续发展[4]。为了寻找最佳的生防菌剂,本研究对从棉花试验田病圃中鉴定到的高抗棉花植株中获得的拮抗菌进行筛选、鉴定,并对其防治黄萎病的效果进行评价[5-7],以期为棉花黄萎病的防治提供参考方法。
1 材料与方法
1.1 试验材料
1.1.1 试验菌株 拮抗菌BJB01 和大丽轮枝菌VD592菌种均来源于中国农业科学院生物技术研究所。
1.1.2 试验作物 供试棉花品种为‘新陆早36号’,种子由中国农业科学院生物技术研究所提供。
1.1.3 试验试剂 通用细菌DNA 提取试剂盒购自天根公司;过氧化氢酶试剂盒、硝酸盐试剂盒、吲哚乙酸试剂盒、27F/1492R 细菌通用引物均购自索莱宝公司;碘液、甲基红、氢氧化钠、3%次氯酸钠购自国药集团;溴麝香草酚蓝水溶液购自雷根生物公司。
1.1.4 试验培养基配方 LB 培养基:10 g 胰蛋白胨,5 g酵母膏,10 g NaCl,1 000 mL ddH2O(若配制为固定培养基需加入15 g琼脂);葡萄糖蛋白胨液体培养基:0.5 g 葡萄糖,0.5 g 蛋白胨,0.5 g K2HPO4,100 mL ddH2O;牛奶固体培养基:取50 mL脱脂牛奶,再称1.5 g琼脂溶于50 mL ddH2O中,将两液分开灭菌,灭菌取出后将两液倒在一起混匀;淀粉固体培养基:1 g 胰蛋白胨,0.5 g 酵母膏,1 g NaCl,2 g 淀粉,100 mL ddH2O,8 g 琼脂;葡萄糖液体培养基:1 g胰蛋白胨,0.5 g酵母膏,1 g NaCl,2 g葡萄糖,100 mL ddH2O,8 g 琼脂;木糖液体培养基:1 g 胰蛋白胨,0.5 g 酵母膏,1 g NaCl,2 g 木糖,100 mL ddH2O,8 g 琼脂;柠檬酸盐利用培养基:0.5 g NaCl,0.02 g 硫酸镁,0.1 g 硫酸二氢铵,0.1 g磷酸氢二钾,0.5 g 柠檬酸铵,8 g 琼脂,100 mL ddH2O,0.2%溴麝香草酚蓝溶液4 mL;YEB液体培养基:2.5 g 胰蛋白胨,5 g 酵母膏,5 g NaCl,2 g 葡萄糖,500 mL ddH2O;PDA 固体培养基:5 g 马铃薯浸膏,2.5 g胰蛋白胨,2.5 g葡萄糖,5 g NaCl,7.5 g琼脂,500 mL ddH2O。
1.2 试验方法
1.2.1 致病菌的生理生化分析 利用从新疆石河子棉花重病田里筛选获得的菌株,用LB固体培养基做平板划线对提取到的菌株做活性鉴定;再选取活性强的单菌落大量摇菌,做革兰氏染色试验与生理生化分析。根据芽孢杆菌可能对大丽轮枝菌产生作用的生化方式,选取乙酰甲基甲醇试验(VP试验)、葡萄糖利用试验、木糖利用试验、酪素水解试验、淀粉分解试验、吲哚产生试验、过氧化氢分解试验、硝酸盐还原试验、甲基红实验(MR试验)、柠檬酸盐利用试验以及盐浓度存活测试作为生理生化试验项目。其中吲哚产生试验、过氧化氢分解试验、硝酸盐还原试验由于涉及危险化学品的使用,故选用由索莱宝公司生产的试剂盒进行试验;VP试验、葡萄糖利用试验、木糖利用试验、酪素水解试验、淀粉分解试验、MR 试验、柠檬酸盐利用试验以及盐浓度存活测试,通过对相应培养基的配制来进行生理生化测试[3]。
1.2.2 拮抗菌BJB01的生长曲线 将提取到活性强并纯化后的BJB01 菌液1 000 μL 加入50 mL 的LB 液体培养基中,每隔2 h 测一次OD600值;当出现衰退现象后每隔6~8 h 测1 次。汇总每个生长阶段的结果并制作菌株生长曲线。
1.2.3 拮抗菌株分子生物学鉴定 使用通用细菌DNA 提取试剂盒提取拮抗菌BJB01 DNA,采用27F/1492R细菌通用引物对菌株的16S rRNA基因进行PCR 扩增,将产物送北京擎科生物公司测序。测序所得结果在NCBI 上进行BLAST 比对,并构建分子进化树。
1.2.4 菌株拮抗效果初筛 将大丽轮枝菌VD592
菌种接种于PDA 培养基上,置于27 ℃恒温光培养箱培养5 d。5 d 后取出,挑取在LB 固体培养基上的拮抗菌单菌落接种于PDA 培养基4 个角落,后继续置于27 ℃恒温光培养箱培养3~5 d。培养完成后观察抑菌圈的大小,并按公式(1)计算抑菌率[7]。
1.2.5 温室盆栽防效试验 设置3 种浓度梯度的拮抗菌液,即OD600为0.1、0.6、1.0,分别做浸种处理12 h,在27 ℃恒温温室种植,每个处理设3次重复,后于棉花长出2~4 片真叶时接种大丽轮枝菌进行侵染,并在接菌后第7天进行二次接种以确保发病率。全部接种完成后,于第14 天进行防效数据统计。统计病值,0 级:0 片真叶被感染;1 级:1 片真叶被感染;2 级:2 片真叶被感染;3 级:3 片真叶被感染;4 级:4 片真叶及以上被感染或感染后死亡。统计完成后根据对应病级的数量计算感病情况,以此确定防效[3,8-10]。同时使用菌拌土与喷洒菌剂的方式进行防效测试,试验重复3 次,试验方法按如下步骤进行。①菌拌土处理,利用浓度为OD=0.6 的BJB01 芽孢杆菌均匀拌土(微生物菌剂10 mL·kg-1土),再种植棉花(20 盆),在棉花长出2 片真叶时接种黄萎病病原菌。②喷洒菌剂处理,直接种植棉花(分两组,一组20盆),后接种芽孢杆菌,设置2组芽孢杆菌喷洒时间(分别选择棉花长出两片真叶后的第7、14 天接种),喷洒时使用喷壶均匀喷洒在棉花种植土壤上,同样也在棉花长出2 片真叶时接种黄萎病病原菌。按公式(2)~(4)测试计算温室防效。
温室盆栽防效试验后需从侵染过的健康未感病植株根部提取菌株,对得到的菌株提取基因组DNA,进行PCR 扩增并将产物送样测序,将测序结果在NCBI 上进行BLAST 比对以确认是否为同一种菌株。
2 结果与分析
2.1 拮抗菌株的鉴定
2.1.1 拮抗菌种生理生化及革兰氏染色鉴定 研究用到的拮抗菌种BJB01,是从大田健康棉花植株的下胚轴中分离到的47 种菌中,经过筛选后获得的活性最强的菌株。
先对该菌进行革兰氏染色,染色发现为蓝紫色,即其为革兰氏阳性菌。再针对该菌进行生理生化试验,进行反复多次测试后,发现该菌的VP试验、葡萄糖利用试验、木糖利用试验、酪素水解试验、淀粉分解试验、吲哚产生试验、过氧化氢分解试验、硝酸盐还原试验为阳性,MR 试验、柠檬酸盐利用试验为阴性。并且该菌在盐浓度为5%、7%时板上有明显的大量菌落存活,而超过10%时未发现明显的菌落。
2.1.2 拮抗菌生长曲线 通过绘制拮抗菌BJB01的生长曲线可进一步确定该菌在不同利用情况下获得最佳浓度的菌液的培养时间。由图1 分析发现,该菌在14 h后生长趋于稳定,在24 h后培养基中的营养成分耗尽,相应的菌浓度随之下降,但在测试时间内菌不会消亡。
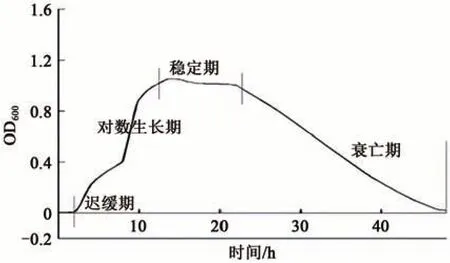
图1 BJB01生长曲线Fig. 1 BJB01 growth curve
2.1.3 拮抗菌的分子生物学鉴定 图2 观察到BJB01 的菌落呈乳白色、椭圆形,边缘整齐,向上凸起,表面光滑不透明。将提取到的BJB01 菌种涂布后进行16S rRNA 测序,测序得到的16S rRNA 拼接结果在NCBI 系统上进行BLAST 比对,利用MEGA-X 中的NJ 法构建进化树(图3),发现该菌与贝莱斯芽孢杆菌相似度极高,为99.71%,由此可确定该菌为贝莱斯芽孢杆菌(Bacillus belleiensis)。

图2 BJB01的菌落图Fig. 2 Colony map of BJB01
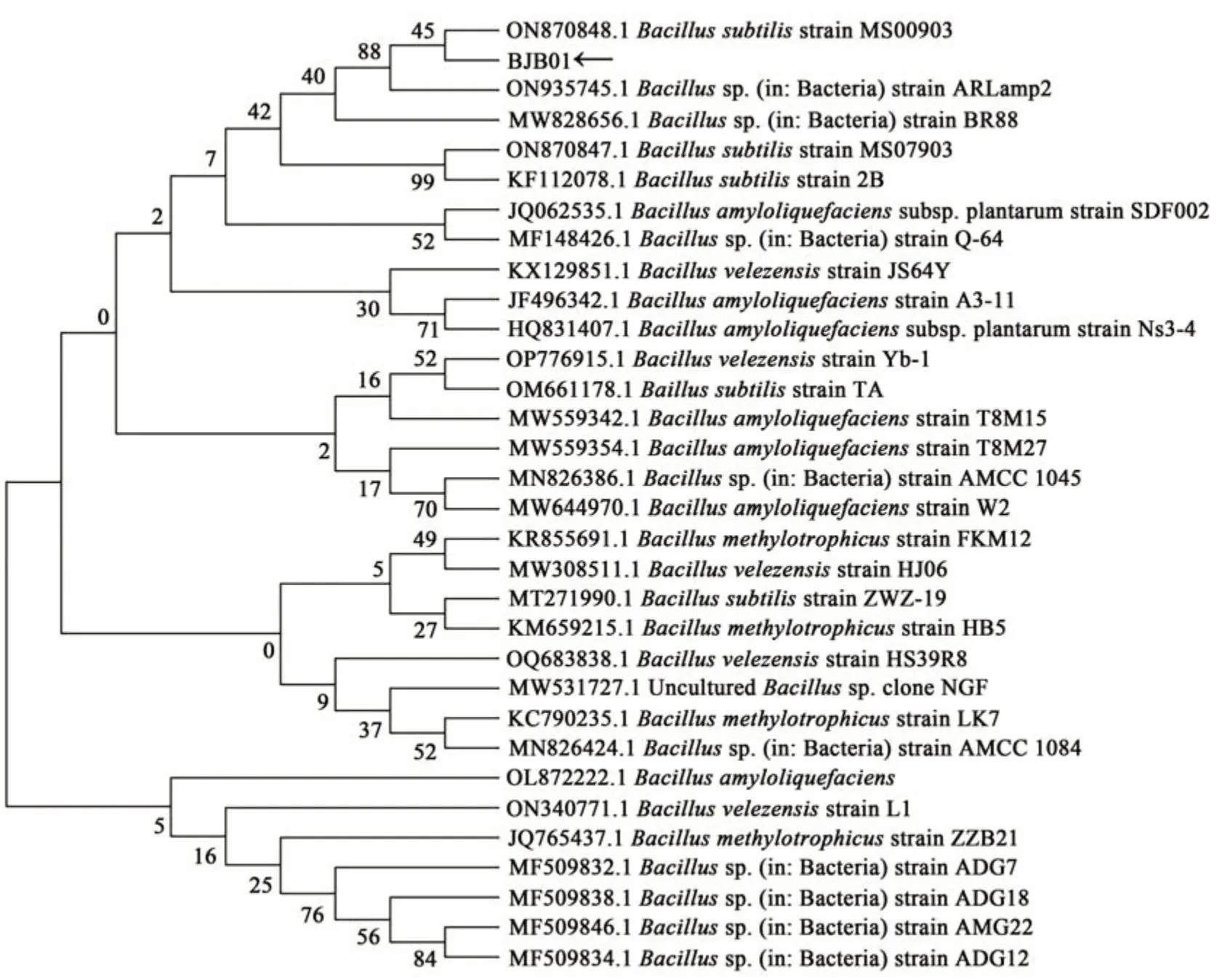
图3 BJB01分子进化树Fig. 3 BJB01 molecular evolutionary tree
2.2 平板对峙结果
将接菌后的PDA 平板在27 ℃恒温光培养箱培养21 d 后的结果如图4 所示。图4A 显示,直接接种大丽轮枝菌VD592 第25 天长满整个PDA 平板,与图4A 对照相比,图4B 的抑菌圈明显扩大,表明BJB01对大丽轮枝菌VD592具有明显的拮抗效应。结合图4的对峙情况和表1的结果分析,在接菌第21 天时,抑菌圈增大速度较快,因此可得到贝莱斯芽孢杆菌BJB01 在此时对大丽轮枝菌VD592的抑制效果最强。

表1 菌株平板对峙结果Table 1 The results of the strain plate confrontation
2.3 温室盆栽防效试验结果
根据平板对峙试验中第21 天达到最大抑菌效果的结果,于接菌第21 天进行温室防效结果统计,并针对统计结果进行数据处理。图5 左图为棉花健康植株,右图为棉花感染大丽轮枝菌VD592后的感病植株。温室抑菌试验生防效果试验结果数据见表2。
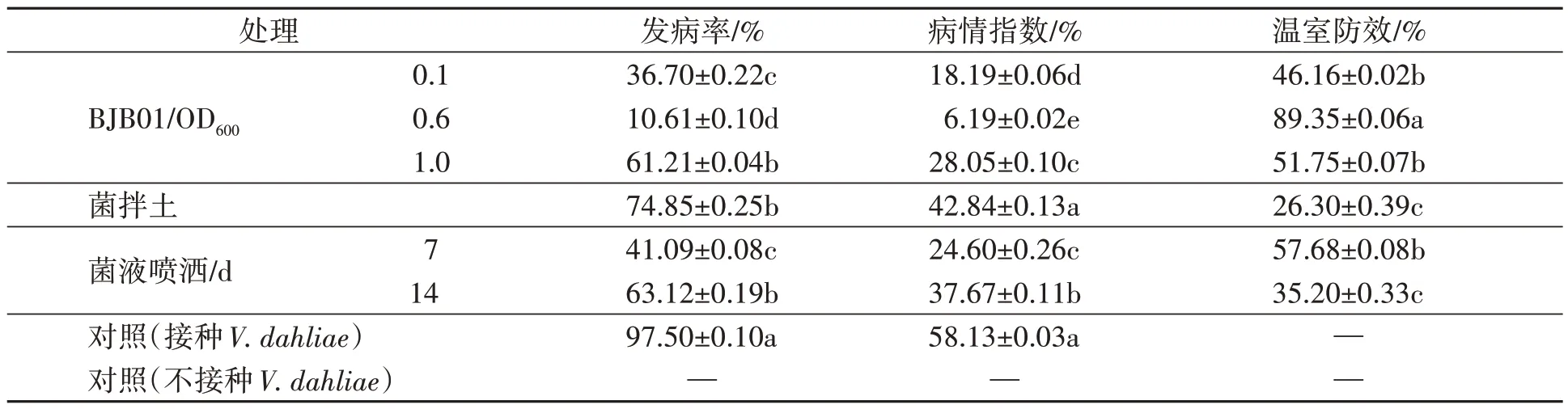
表2 温室防效结果统计表Table 2 Statistical table of greenhouse control effect results

图5 温室棉花植株感病效果示意图Fig. 5 Diagram of disease susceptibility effect of different plants in greenhouse
由表2 可知,比较不同芽孢杆菌浸种处理种子得到的数据,发现直接对种子接菌的防效较为突出,菌拌土与菌液喷洒的防护效果较低。分析3 种接菌浓度处理结果,发现当浸种用的菌液浓度即OD600值接近0.6时,菌的拮抗效果最优,且温室防效大于60%。
前期温室验证试验结束后,利用温室防效试验对OD600=0.6 时得到的最优菌株进行防效验证。根据表3 的测试结果可知,该浓度下的温室防效依旧最佳为85.91%。
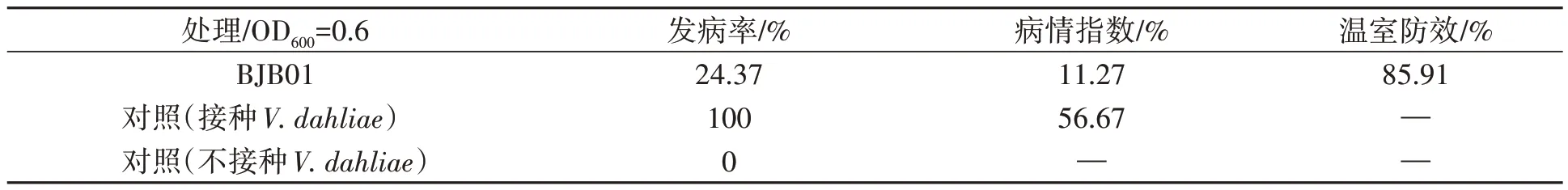
表3 最优菌株温室防效结果统计表able 3 Statistical table of optimal strains in greenhouse control effect
注:表中数据均为3次重复的平均值±标准差。
T
3 讨论
本研究利用LB 液体培养基对拮抗菌进行反复的纯化培养,并做稀释涂布以观察菌落特征,观察发现菌落为乳白色、不透明、圆形、表面干燥、边缘不整齐、有褶皱、菌落中间凹陷。将菌株进行大量培养并进行生理生化鉴定,然后将该菌提取DNA送样进行16S rRNA测序,将得到的测序结果进行BLAST 比对,发现该菌与贝莱斯芽孢杆菌相似度达99.71%,初步鉴定该菌为贝莱斯芽孢杆菌[11-13]。
平板对峙试验结果发现试验于第21 天拮抗效果更为明显;通过连续48 h测定细菌生长曲线,可以得到最佳的菌株培养时间,避免因为培养时间不足或培养时间超时导致菌株失效,试验发现14 h 后菌的活性浓度达到最佳状态,可以利用该浓度下的菌液进行种子处理[14]。
通过大量温室防效测试分析,当使用的BJB01菌液浓度接近OD600=0.6 时进行浸种处理的防效最佳,为89.35%,大于60%,符合防效有效值,表明BJB01 的防效明显。同时,根据平板对峙的结果,发现于侵染V. dahlia21 d 后,芽孢杆菌对V.dahliae的拮抗效果达到最佳。将获得的最优菌株进行再次防效测试,BJB01 的最优菌株防效为85.91%,测试结果表明获得的最优菌株可以有效防治黄萎病的发生。试验还发现使用菌拌土与喷洒菌剂的方式,抗病率较低,不如对种子进行浸种处理防效高。本研究得到了拮抗菌BJB01对棉花黄萎病防效较好,后续有望用于生物菌剂的开发,为黄萎病的防治提供了更安全有效且环境友好的防治方法。
