氢分子对咪喹莫特诱导的小鼠银屑病样皮损的抑制作用
2023-12-14朱钧锴葛玲智张超曹璨吴嘉惠穆震
朱钧锴,葛玲智,张超,曹璨,吴嘉惠,穆震*
1.泰安八十八医院皮肤科,山东 泰安 271000;2.山东第一医科大学第二附属医院皮肤科,山东 泰安 271000
银屑病是以鳞屑性红斑、斑块为特征的慢性、复发性、炎症性、系统性疾病。伴随银屑病病程的延长,患者患心血管疾病、关节炎、代谢综合征等共病的风险也大为增加,带来极大的社会负担[1-3]。银屑病的发病基础与遗传、固有免疫、适应性免疫系统有关,其中促炎因子的级联反应贯穿于疾病发生发展的整个阶段。IFN-γ 是银屑病发病的重要启动因子,TNF-α、IL-6 是参与银屑病发生和发展的重要上游因子,这些炎症因子在皮肤上,促进角质形成细胞的增殖、分化和异常表达[4-6]。随着对自身炎症性疾病和自身免疫性疾病相互作用研究的增多,发现除了免疫因素外,异常的氧化应激导致的细胞结构损伤可能是另一危险因素[7-12]。部分文献报道银屑病的发病存在抗氧化剂的减少和过氧化产物的增多,如银屑病皮损和配对的血清样本中发现SOD、CAT、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)的含量显著降低,而MDA、一氧化氮(nitric oxide,NO)、超氧阴离子(superoxide anion,O2-)的含量升高[7]。同时,有学者指出氧化应激生物标志物可用于评估银屑病严重程度、预测治疗效果和疾病的发展[13-14]。
目前,银屑病的治疗方式包括局部治疗和全身治疗。局部治疗如糖皮质激素、钙调磷酸酶抑制剂常用于早期及轻度银屑病的治疗;全身治疗包括免疫抑制剂如甲氨蝶呤、环孢素等常用于晚期及中重度银屑病的治疗。近年来,随着细胞因子在银屑病发病中地位的提升,银屑病治疗迎来了生物制剂发展的新时代,并在临床应用中取得了令人满意的疗效。尽管生物制剂的发展取得了巨大成就,但仍有一些问题尚未解决,如不良反应、治疗失败、适应症受限及价格昂贵等。氢分子是一种新型的气体信号分子,基础和临床研究发现其对多种炎症性疾病具有防治作用,可以用于治疗皮肤病如银屑病[15-16]、特应性皮炎[17]、衰老[18-19]、电击伤[20]等。针对其显示的治疗价值,本研究通过氢分子干预以探究氢分子对银屑病样皮损的作用影响,以期为银屑病的临床治疗提供经济、安全的辅助治疗方法。
1 材料与方法
1.1 实验动物
8 周龄Balb/c 雄性小鼠,体重18~22 g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2021-0006,医学实验动物合格证书编号:110011220105953464。本实验获得山东第一医科大学第二附属医院实验动物伦理委员会批准。
1.2 主要试剂和仪器
5%咪喹莫特乳膏(imiquimod cream,IMQ)(四川明欣药业);氢气呼吸机(山东淄博九辰生物科技,JC-H2-300A);新宇宙XP-3140-H2(氢气)检测仪(日本)等。
1.3 实验方法
将30 只Balb/c 小鼠背部2 cm×3 cm 区域的毛发用电动剃毛器脱毛后,随机分为空白组、IMQ组和干预组,每组10 只。除空白组皮损每日给予外用凡士林乳膏外,其余两组小鼠通过涂抹IMQ 的方法构建模型小鼠[21-22]。具体方法为背部剃毛部位涂抹5% IMQ 乳膏62.5 mg,1 次·d-1,连续给药7 d。干预组在背部每日给予5% IMQ 乳膏30 min后,将小鼠放入密封的带有进气口的玻璃树脂箱即氢气仓内,打开氢气呼吸机,通过进气管通入H2,H2流速平均为300 mL·min-1,并每隔30 min 通过H2浓度检测仪检测箱中浓度并记录,其平均浓度为35%,共给予氢气4 h·d-1(上午2 h、下午2 h)。每天处理前拍照观察并记录小鼠背部皮肤变化,依据PASI 评分标准对小鼠背部皮损进行评分。第8天,颈椎脱臼处死。取背部1 cm×1 cm 大小皮肤,立即4%多聚甲醛固定,常规法制备蜡块切片,HE 染色后显微镜下观察并Baker 评分;另1 cm×1 cm 皮肤置于RNA 稳定保存液中,进行RT-qPCR检测;余背侧皮肤保存在-80 ℃超低温冰箱中,用于后续组织蛋白提取。其中,免疫组化结果、蛋白质印迹条带使用Image J软件进行灰度分析。
1.4 检测指标
参照PASI评分标准给予小鼠背部皮肤的红斑、鳞屑、皮肤增厚的严重程度进行评分(0~4 分),3项评分累积,总计0~12分。显微镜下观察切片,测量其表皮厚度,参照Baker 评分标准评估其病理损害程度。采用石蜡切片免疫组化检测小鼠皮损中IL-6、TNF-α、IFN-γ 的表达;使用RT-qPCR 和Western blot 法分别检测各组皮损中炎症因子IL-6、TNF-α 和IFN-γ 的相对mRNA 水平和蛋白水平的表达,其中Actin作为检测mRNA 水平的内参,其他引物见表1,使用2-ΔΔCt算法计算相对表达水平,各引物序列见表1;应用MDA 和CAT 试剂盒检测皮损组织的氧化指标MDA含量和CAT活力。

表1 RT-qPCR目标基因的引物序列Table 1 Primers sequence of RT-qPCR target gene
1.5 统计分析
采用GraphPad Prism 8.0 软件进行分析。两组间比较时,采用t检验,多组间比较时,采用单因素方差分析(one-way ANOVA)统计分析,不符合正态分布或方差不齐采用非参数检验。P<0.05认为具有统计学意义。
2 结果与分析
2.1 氢分子对小鼠银屑病样皮损形成的作用
通过IMQ 诱导,成功建立小鼠银屑病模型,在此基础上展开后续研究。处死前观察其背部皮损形态学变化,发现空白组小鼠背部皮肤光滑,与IMQ 组相比,干预组小鼠背部皮损处的红斑、鳞屑及皮肤增厚程度减轻。小鼠PASI 评分结果显示(图1A),与IMQ 组相比,干预组小鼠背部皮损各项评分及总评分均显著降低(P<0.05,图1B)。这些结果提示氢分子可抑制小鼠银屑病样皮损的临床表现。

图1 氢分子对小鼠银屑病样皮损的形态学影响Fig. 1 Morphological effects of molecular hydrogen on psoriasis-like mice
2.2 氢分子对小鼠银屑病样皮损的组织病理学影响
由图2A 可见,空白组小鼠皮肤结构清晰、完整。与空白组相比,IMQ 组小鼠皮肤病理形态与临床中银屑病的组织形态相似;与IMQ 组相比干预组小鼠皮肤Munro 微脓肿消失,角化过度及角化不全现象减轻或消失,棘层变薄,其表皮厚度、红斑、鳞屑、炎细胞浸润程度均减轻,组织学Baker评分降低(图2B)。随机测量各组小鼠皮肤表皮层的垂直厚度,每个视野5 处,如图2C 所示,IMQ组小鼠表皮层厚度约为空白组的4~5倍(P<0.001),和IMQ 组小鼠相比,干预组小鼠皮肤表皮厚度较IMQ 组明显变薄(P<0.001)。结果提示氢分子可改善小鼠银屑病样皮损的组织学表现。

图2 氢分子对小鼠银屑病样皮损的组织病理影响Fig. 2 Histopathological effects of hydrogen molecular on psoriasis skin lesions in mice
2.3 氢分子对银屑病样皮损中炎症因子IL-6、TNF-α和IFN-γ表达的影响
由免疫组化结果可以看出,与空白组相比,IMQ 组小鼠皮损的表皮层IL-6、TNF-α 和IFN-γ 表达显著升高(图3A),进一步分析其光密度值(图3B),发现IMQ 组小鼠皮损中IL-6、TNF-α 和IFN-γ 3 种细胞因子在表皮表达水平明显增加(P<0.01),与IMQ组比较,干预组小鼠皮损中上述3种炎性细胞的表达均减少(P<0.05)。
2.4 氢分子对银屑病样皮损中炎症因子IL-6、TNF-α和IFN-γ蛋白表达水平的影响
通过Western blot法分析银屑病样皮损中IL-6、TNF-α 和IFN-γ 的蛋白表达水平发现(图4),与空白组小鼠相比,IMQ 组小鼠皮损中IL-6、TNF-α 和IFN-γ 这3 种炎症因子的蛋白表达水平比空白组明显升高(P<0.01),而干预组小鼠皮损中这些炎症因子的蛋白表达水平下调(P<0.05)。
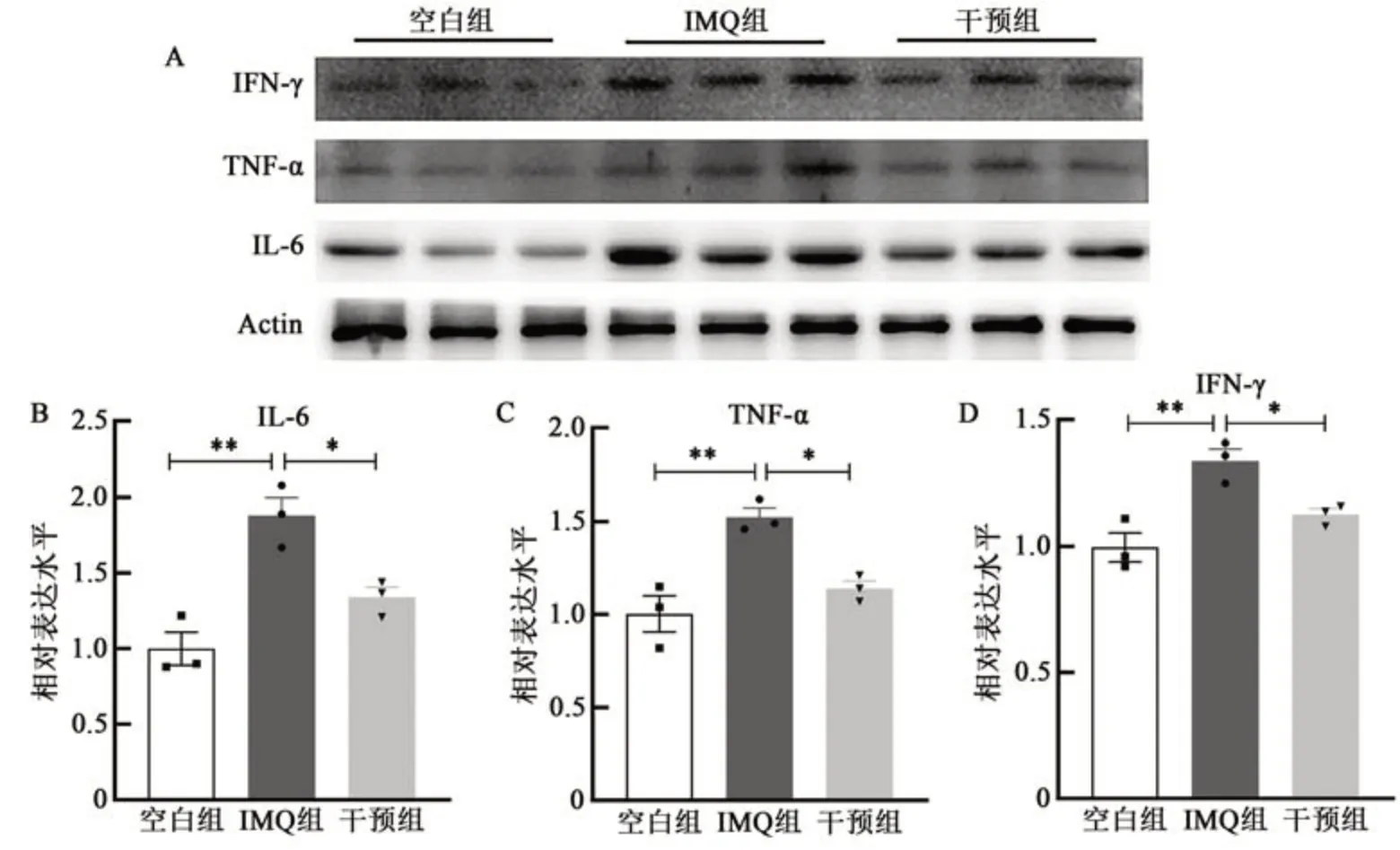
图4 氢分子对小鼠皮损中IL-6、TNF-α和IFN-γ的蛋白水平的影响Fig. 4 Effect of hydrogen molecular on the protein levels of IL-6, TNF-α and IFN-γ in mouse skin lesions
2.5 氢分子对银屑病样皮损中IL-6、TNF-α和IFN-γ的mRNA表达水平的影响
通过RT-qPCR 法测定银屑病样皮损中IL-6、TNF-α和IFN-γ 的mRNA 表达水平发现(图5),与空白组对比,IMQ 组小鼠皮损中这3 种细胞因子的mRNA 水平均明显上升,约为空白组的2~3 倍(P<0.001),而氢分子干预能抑制IMQ 诱导的小鼠炎症因子的mRNA 水平的表达(P<0.05)。结果提示氢分子可抑制银屑病样皮损中IL-6、TNF-α 和IFN-γ的mRNA表达水平,从而抑制炎症反应。
2.6 氢分子对小鼠皮损组织中MDA 含量、CAT活力的影响
通过MDA和CAT试剂盒测定发现(图6),IMQ诱导的银屑病小鼠的CAT 活力下降,MDA 含量增加(P<0.01)。与IMQ 组相较,干预组小鼠皮损中CAT活力增加(P<0.05),MDA含量降低(P<0.05)。结果提示氢分子可减轻小鼠银屑病的氧化应激反应。
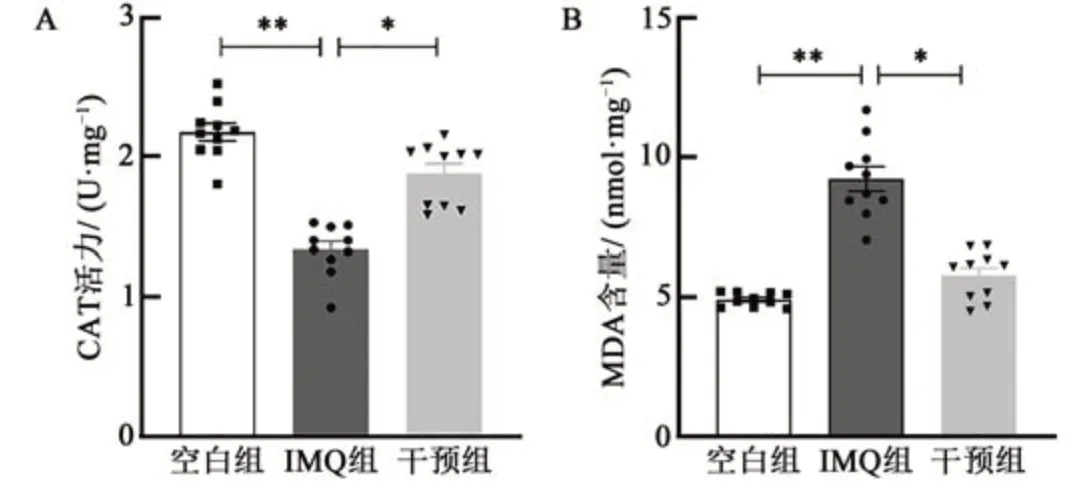
图6 氢分子对小鼠银屑病样皮损氧化指标的影响Fig. 6 Effect of hydrogen molecular on oxidation index of psoriatic skin lesions in mice
3 讨论
银屑病发病机制复杂,早期认为其发病与角质形成细胞(keratinocyte,KC)的异常增殖密切相关;随着研究的深入,研究者们发现银屑病主要是T细胞介导的异常免疫反应[1]。在遗传背景下,免疫细胞可通过分泌炎症因子IL-6、TNF-α、IFN-γ、IL-12、IL-17、IL-23和IL-1β等促发炎症因子级联反应、形成正反馈炎症环路,促进和维持其发病[23-24]。同时,氧化应激也被认为是一个易被忽视的致病因素,先前研究指出氧化应激可通过多种途径促进炎症发生,氧化应激损伤致使体内ROS增多,也可促进银屑病发病[7-8,13-14,25]。虽当下银屑病的治疗进入了生物制剂发展的新时代,但不良反应、治疗失败及适应症受限等问题尚未解决,因此,亟需探索一种经济有效的治疗方式。近年来,越来越多的学者从自然界存在的天然物质入手,证明植物抗氧化剂如原花青素[26]、异鼠李素[27]、瑞香素[28]、萝卜硫素[29]可降低炎症因子如IL-6、IL-23A、IL-17A、TNF-α 等的表达,同时降低MDA、SOD 等的含量,从而减轻小鼠银屑病样皮损。此外,研究还发现包括甲氨蝶呤、环孢素、生物制剂在内的不同的治疗方法均对患者的氧化还原能力有一定影响[14]。因此,免疫和炎症信号通路、氧化还原的复杂相互作用有待进一步研究。
皮肤是人体最大的免疫器官,从免疫方面来说,树突状细胞(dendritic cells,DC)是固有免疫和适应性免疫间的纽带,参与抗原提呈和T 淋巴细胞的激活与分化,并通过促炎因子级联反应进一步促进细胞因子的产生,形成正反馈环路,从而增强炎症过程[5]。皮肤中免疫细胞通过分泌IFN-γ、TNF-α、IL-1β 和IL-6,与浆细胞样树突状细胞(plasmacytoid dendritic cells,pDC)分泌的IFN-α共同激活并刺激髓样树突状细胞(myeloid dendritic cells,mDC),激活的mDC 又可分泌TNF-α、IL-12、IL-23等多种炎性因子并诱导T淋巴细胞的分化和成熟,活化的T 淋巴细胞可分泌IFN-γ、TNF-α、IL-17A 等[30-31]。其中,IFN-γ、TNF-α 作为重要的免疫调节因子,已证实参与银屑病的发病,且TNF-α 还可增加其他促炎因子(如白介素家族IL-6、IL-17等)的产生[31-32]。Young等[33]指出TNF-α可导致角质形成细胞中ROS 的形成,从而进一步促进细胞因子的产生。而IL-6水平的升高不仅可促进KC 的增殖和Th17 细胞的分化,而且对Treg的分化有抑制作用[24]。炎症因子是评估银屑病严重程度的重要指标,本研究证实了氢分子干预可抑制炎症因子IL-6、TNF-α 和IFN-γ 的表达,与前人的研究结果相一致[16,34-35]。
目前的研究表明氢分子可通过清除多余的ROS 和增强抗氧化酶的表达,进一步改善氧化应激[36]。氧化应激是体内氧化与抗氧化系统之间的一种失衡状态,ROS是一类重要的氧化应激产物,包括羟自由基、过氧化物、超氧阴离子等,适量的ROS 在角质形成细胞的增殖分化、细胞信号传导及组织稳态中发挥重要作用。ROS产生过多则会导致过氧化产物如MDA、4-羟基-2-壬烯醛等产生,对机体造成损伤[37]。体内消除ROS 的抗氧化体系包括酶系和非酶系,其中SOD、CAT是主要的酶系,这些酶可降低ROS 对机体的破坏作用。皮肤暴露于外界坏境中,不断受到内源性及外源性ROS的攻击引起皮肤损伤。当皮肤损伤时,炎症就会产生,当炎症得到适当调节时,就会启动皮肤自愈。目前,越来越多的研究结果认为ROS 参与了自身免疫性疾病的发生、发展[12,38]。其中,研究者指出在银屑病患者和健康对照组之间,存在抗氧化酶的不平衡,且最新研究指出银屑病的氧化还原失衡不仅存在于皮肤细胞、血浆和血细胞中,还存在于唾液中,而抗氧化剂对银屑病的治疗有积极影响[8,27]。MDA是过氧化产物之一,CAT是主要的抗氧化酶之一[39]。既往银屑病与氧化应激相关研究中,Sikar等[40]发现银屑病患者皮损MDA含量明显升高,且与PASI 评分呈一定相关性。Kadam等[9]指出银屑病患者血清中CAT 活力降低。氢分子治疗银屑病的研究于2015 年后被陆续报道,研究人员给予银屑病患者吸入氢气、口服富氢水、静脉滴注富氢氯化钠溶液(0.9%)、氢水沐浴等的方式发现氢可以降低MDA 含量,增加对氧磷酶-1(paraoxonase-1,PON-1)活性,对银屑病的治疗具有积极意义[15-17,19,34-35]。本研究结果也表明氢分子可降低MDA 含量,增加CAT 活力。因此,我们认为不同作用方式的氢分子均可能具有提高抗氧化能力和抑制炎症因子表达的作用。
本研究通过动物实验探究氢分子对小鼠银屑病样皮损的作用,初步证实氢分子能抑制银屑病样皮损的形成,降低炎症因子IL-6、TNF-α 和IFNγ 的表达,降低过氧化产物MDA 含量,增加抗氧化酶CAT 活力,为氢分子治疗银屑病提供实验基础。论文不足之处在于未进一步深入探究其可能涉及的免疫通路及氧化还原与免疫炎症信号通路的交叉点,在后续的研究中将进一步完善。
