miR-1-3p调控ANXA2表达对高糖诱导的视网膜微血管内皮细胞新生血管生成的影响△
2023-12-13巨朝娟许寅聪李康宁石笑楠熊朝晖戴明明
巨朝娟 许寅聪 李康宁 石笑楠 熊朝晖 戴明明
糖尿病视网膜病变(DR)属于糖尿病常见并发症,病理特征为视网膜微血管生成与视网膜脱落,而血-视网膜屏障破坏及视网膜新生血管形成均可增加失明风险[1]。高糖环境下人视网膜微血管内皮细胞(HRMECs)异常增殖、微血管生成可促进DR发展[2-3]。微小RNA(miRNA)属于内源性非编码RNA分子,可作为转录后调节基因表达因子,参与细胞增殖与迁移等生物学过程,有研究表明,miRNA参与DR发生发展过程,可逆转血脂异常,减缓DR发展进程,可能成为治疗DR的潜在靶点[4]。miRNA-1-3p(miR-1-3p)在内皮细胞损伤中低表达,上调其表达可减轻内皮细胞损伤,改善内皮屏障功能障碍[5]。但miR-1-3p与DR相关性研究尚未见报道。TargetScan(miRNA靶基因预测网站)预测显示miR-1-3p与膜联蛋白A2(ANXA2)存在结合位点。ANXA2在血管系统中高表达,可通过调节磷脂酰肌醇3激酶/蛋白激酶B信号通路促进视网膜血管内皮细胞损伤,参与新生血管形成过程[6]。目前对于miR-1-3p与ANXA2在HRMECs中作用及其潜在分子机制尚未明确,因此,本研究探讨miR-1-3p及ANXA2对高糖诱导的HRMECs新生血管生成的影响,为进一步揭示DR发病机制奠定实验基础。
1 材料与方法
1.1 材料与试剂
HRMECs购自上海弘顺生物公司;DMEM培养基、胎牛血清购自美国Gibco公司;D-葡萄糖购自上海生工生物股份有限公司;Spectras Max Plus微孔板读取器购自上海美谷分子仪器公司;miRNA提取试剂盒、Trizol试剂、反转录、实时荧光定量PCR(qRT-PCR)试剂盒购自北京天根生化公司;MTT试剂盒、Transwell小室、荧光素酶活性检测试剂盒、蛋白浓度检测试剂盒购自北京索莱宝科技有限公司;野生型载体WT-ANXA2、突变型载体MUT-ANXA2购自美国Promega公司;Oligofectamine转染试剂、pcDNA3.1质粒、pcDNA-ANXA2购自美国Invitrogen公司;miR-NC、miR-1-3p mimics、anti-miR-NC、anti-miR-1-3p、sh-NC、sh-ANXA2购自广州锐博生物;基底膜购自美国BD公司;兔抗人血管内皮生长因子(VEGF)、基质金属蛋白酶-2(MMP-2)抗体、内参GAPDH抗体购自美国Santa Cruz公司;HRP标记的山羊抗兔IgG二抗购自美国Abcam公司。ABI Prism 7700型荧光定量PCR仪购自美国Applied Biosystems公司;倒置显微镜购自日本Olympus公司。
1.2 方法
1.2.1 实验分组
HRMECs常规培养,待细胞融合度达到80%时,采用2.5 g·L-1胰蛋白酶消化细胞后收集细胞,将HRMECs分为Con组、高糖(HG)组、HG+miR-NC组、HG+miR-1-3p组、HG+sh-NC组、HG+sh-ANXA2组、HG+miR-1-3p+pcDNA组、HG+miR-1-3p+pcDNA-ANXA2组。Con组:采用含体积分数10%胎牛血清的DMEM培养基培养HRMECs 24 h;HG组采用25 mmol·L-1的D-葡萄糖培养基培养HRMECs 24 h[7];HG+miR-NC组、HG+miR-1-3p组、HG+sh-NC组、HG+sh-ANXA2组、HG+miR-1-3p+pcDNA组、HG+miR-1-3p+pcDNA-ANXA2组:采用Oligofectamine转染试剂分别将miR-NC、miR-1-3p mimics、sh-NC、sh-ANXA2、miR-1-3p mimics+pcDNA、miR-1-3p mimics+pcDNA-ANXA2转染至HRMECs,转染48 h后收集细胞,采用25 mmol·L-1的D-葡萄糖培养基培养HRMECs 24 h。
1.2.2 qRT-PCR实验
收集各组HRMECs并提取细胞总RNA,使用紫外分光光度计检测RNA浓度,参照microRNA Reverse Transcription kit逆转录试剂盒合成cDNA,扩增后置于荧光定量PCR仪检测,反应条件:95 ℃预变性60 s,95 ℃变性60 s,60 ℃退火30 s,72 ℃延伸 30 s,共40次循环,采用2-ΔΔCt法计算miR-1-3p、ANXA2 mRNA表达水平。重复3次,取平均值。
1.2.3 MTT检测细胞增殖
收集各组HRMECs接种于96孔板(1×104个),培养48 h后每孔加入20 μL MTT试剂,在37 ℃孵育4 h后加入二甲基亚砜150 μL,使用Spectras Max Plus微孔板读取器检测吸光度(OD)值,并计算细胞活力(%)=(不同实验处理组OD值/Con组OD值)×100%。重复3次,取平均值。
1.2.4 Transwell实验检测细胞迁移
收集各组HRMECs加入培养基吹打细胞(1×105mL),取细胞悬液加入24孔板Transwell小室上室(每孔100 μL),下室加入含体积分数20%胎牛血清培养基,于培养箱内常规培养24 h,使用棉签擦去上室表层细胞,采用甲醇固定下表层细胞30 min,5 g·L-1结晶紫染色液染色,应用倒置光学显微镜观察并计数细胞。重复3次,取平均值。
1.2.5 管腔形成实验
采用基底膜(50 μL)涂抹96孔板后置于培养箱内固化30 min,取各组HRMECs使用2.5 g·L-1胰蛋白酶消化细胞,用不含血清培养基制备单细胞悬液,取2×105个细胞接种于96孔板培养48 h,采用显微镜观察,每孔任意选取3个视野(100倍)并使用ImageJ软件统计管腔形成数目。重复3次,取平均值。
1.2.6 双荧光素酶报告实验及验证其靶向调控关系
分别构建含有结合位点的野生型载体WT-ANXA2、含有突变位点的突变型载体MUT-ANXA2,采用脂质体转染法将miR-NC、miR-1-3p mimics分别与WT-ANXA2、MUT-ANXA2共转染至HRMECs,分别记为miR-NC组(WT-ANXA2)、miR-1-3p组(WT-ANXA2)、miR-NC组(MUT-ANXA2)、miR-1-3p组(MUT-ANXA2),培养48 h后收集细胞,检测荧光素酶活性。采用脂质体转染法分别将miR-NC、miR-1-3p mimcs、anti-miR-NC、anti-miR-1-3p转染至HRMECs,分别记为miR-NC组、miR-1-3p组、anti-miR-NC组、anti-miR-1-3p组,转染48 h后收集细胞,采用Western blot实验检测ANXA2蛋白水平。重复3次,取平均值。
1.2.7 Western blot实验
收集各组HRMECs并提取细胞总蛋白,采用蛋白质印迹法检测蛋白浓度,取30 μg蛋白样品进行SDS-PAGE电泳分离,并转移至PVDF膜上,采用BSA(50 g·L-1)封闭PVDF膜2 h,4 ℃条件下加入ANXA2(1800)、VEGF(1800)、MMP-2(1800)一抗与内参GAPDH抗体(11 000)孵育过夜,次日洗涤后室温孵育二抗稀释液(13 000),使用ECL发光底物促使蛋白显像,采用BandScan软件计算蛋白相对表达量。重复3次,取平均值。
1.3 统计学处理

2 结果
2.1 miR-1-3p与ANXA2在高糖诱导HRMECs中的表达
与Con组比较,HG组miR-1-3p表达水平降低[(0.33±0.03)比(1.00±0.01)],ANXA2 mRNA及蛋白水平均升高[(4.75±0.42)比(1.00±0.02)、(0.87±0.07)比(0.39±0.04)],差异均有统计学意义(t=38.682、15.465、10.312,均为P<0.05)(图1)。
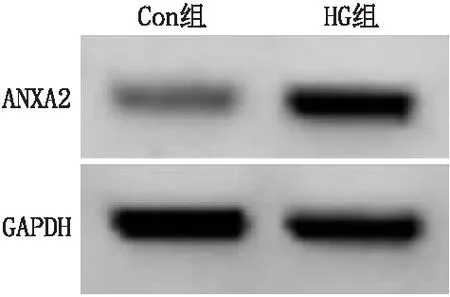
图1 Con组与HG组ANXA2蛋白表达比较
2.2 上调miR-1-3p表达对高糖诱导HRMECs增殖、迁移及新生血管生成的影响
与Con组比较,HG组细胞活力升高,迁移细胞数、管腔形成数增多,VEGF、MMP-2蛋白水平升高,差异均有统计学意义(均为P<0.05);与HG+miR-NC组比较,HG+miR-1-3p组细胞活力降低,迁移细胞数、管腔形成数减少,VEGF、MMP-2蛋白水平降低,差异均有统计学意义(均为P<0.05)(图2、图3,表1)。
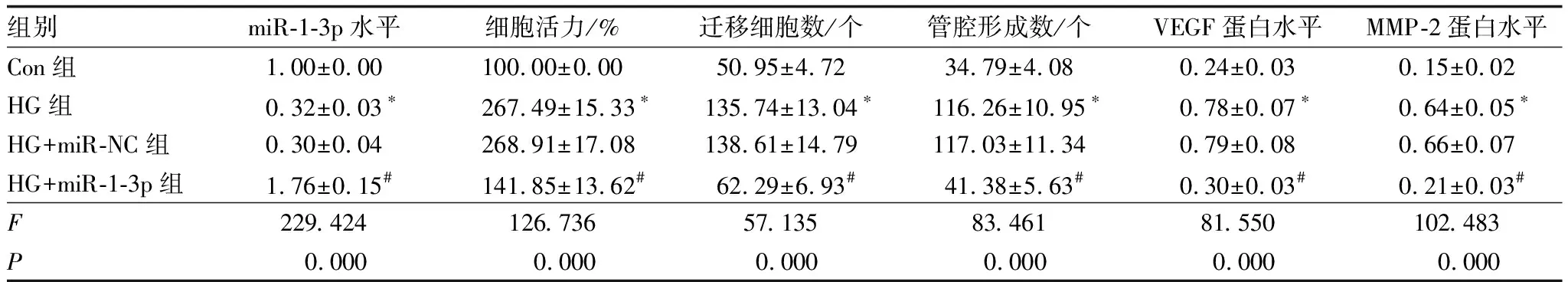
表1 上调miR-1-3p表达对高糖诱导HRMECs增殖、迁移及新生血管生成的影响
2.3 miR-1-3p靶向调控ANXA2的表达
miR-1-3p与ANXA2存在互补序列(图4A)。与miR-NC组(WT-ANXA2)比较,miR-1-3p组(WT-ANXA2)过表达可降低野生型载体WT-ANXA2荧光素酶活性,差异有统计学意义(P<0.05)(表2)。与miR-NC组比较,miR-1-3p组ANXA2蛋白水平降低;与anti-miR-NC组比较,anti-miR-1-3p组ANXA2蛋白水平升高,差异均有统计学意义(均为P<0.05)(图4B、表3)。

表2 miR-1-3p靶向调控ANXA2表达的双荧光素酶活性比较
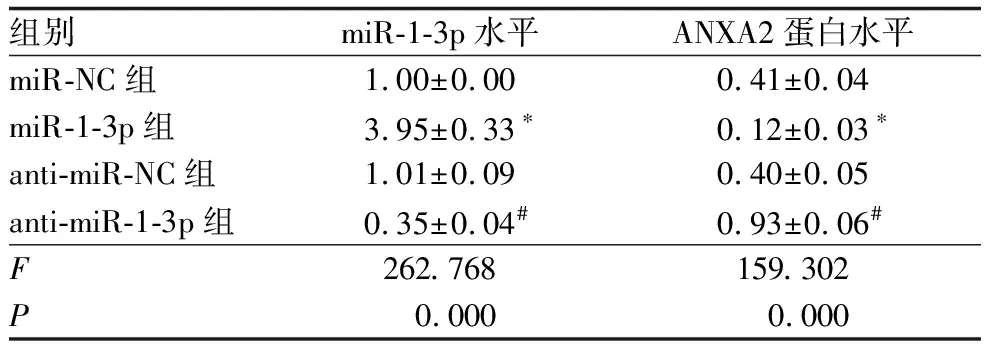
表3 miR-1-3p调控ANXA2蛋白的表达
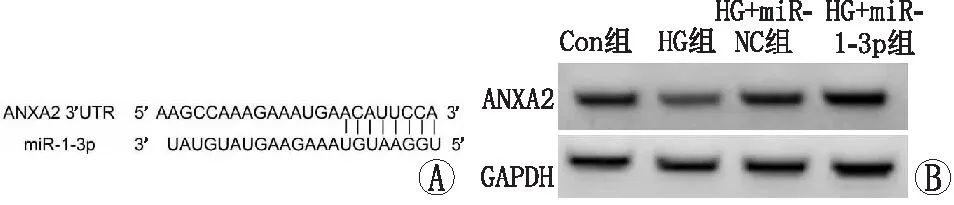
A:ANXA2的3’UTR中含有与miR-1-3p互补的核苷酸序列;B:各组ANXA2蛋白表达水平比较。
2.4 干扰ANXA2表达对高糖诱导HRMECs增殖、迁移及新生血管生成的影响
与HG+sh-NC组比较,HG+sh-ANXA2组细胞活力降低,迁移细胞数、管腔形成数减少,ANXA2、VEGF及MMP-2蛋白水平降低,差异均有统计学意义(均为P<0.05)(图5、表4)。
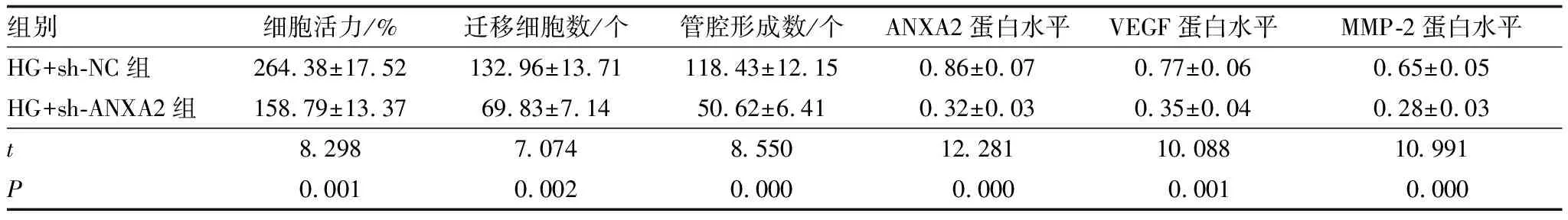
表4 干扰ANXA2表达对高糖诱导HRMECs增殖、迁移及新生血管生成的影响

A:ANXA2和血管形成相关蛋白表达;B:干扰ANXA2表达对高糖诱导HRMECs迁移的影响;C:干扰ANXA2表达对高糖诱导HRMECs新生血管生成的影响。
2.5 ANXA2过表达逆转上调miR-1-3p表达对高糖诱导HRMECs增殖、迁移及新生血管生成的作用
与HG+miR-1-3p+pcDNA组比较,HG+miR-1-3p+pcDNA-ANXA2组细胞活力升高,迁移细胞数、管腔形成数增多,VEGF、MMP-2蛋白水平升高,差异均有统计学意义(均为P<0.05)(图6、表5)。
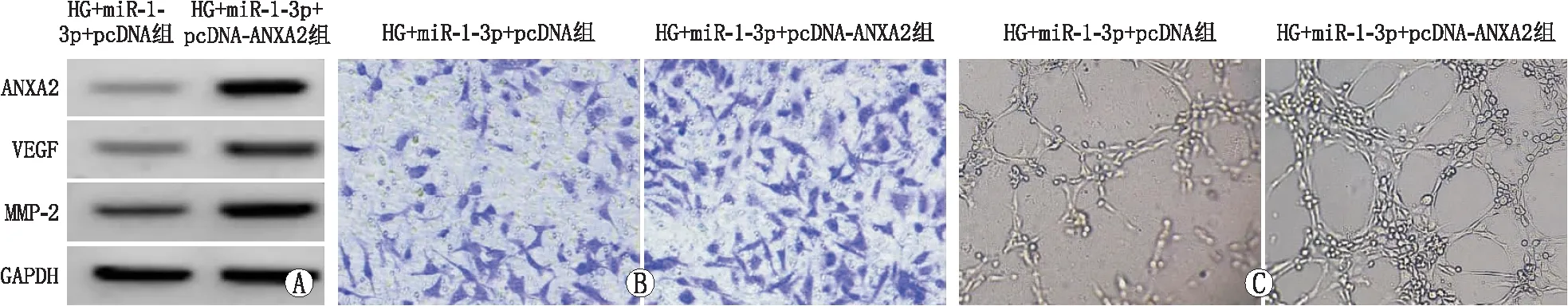
A:ANXA2和血管形成相关蛋白表达;B:ANXA2过表达逆转上调miR-1-3p表达对高糖诱导HRMECs迁移的作用;C:ANXA2过表达逆转上调miR-1-3p表达对高糖诱导HRMECs新生血管生成的作用。
3 讨论
DR发生机制可能与视网膜细胞生化代谢异常、炎性反应、氧化应激及新生血管形成等有关,还可能与糖基化终产物形成及多元醇通路活化有关[8]。miRNA可通过靶向调控靶基因表达参与DR的发生发展过程,并可调节HRMECs增殖与分化等生物学行为[9-10]。目前尚无早期发展及干预DR的方法,因而分析DR发病机制,寻找治疗DR潜在靶点,有助于提高治疗效果。
miR-1-3p属于肿瘤抑制因子,其在结直肠癌中表达下调,并可直接靶向调控酪氨酸3/色氨酸5-单加氧酶激活蛋白,调节细胞增殖、侵袭及上皮-间质转化[11]。miR-1-3p在胃癌细胞中呈低表达,上调其表达可抑制斯钙素2的表达,以减弱胃癌细胞的增殖与侵袭能力[12]。miR-1-3p在肾细胞癌中表达水平升高,且与淋巴结转移及血管侵袭密切相关,上调其表达可直接靶向纤连蛋白1抑制细胞的侵袭转移[13]。目前miR-1-3p在HG诱导的HRMECs中表达趋势及其可能作用机制尚不明确。本研究结果显示,HG诱导的HRMECs中miR-1-3p表达水平降低,细胞活力升高,迁移细胞数及管腔形成数增多,提示miR-1-3p表达下调可能促进HRMECs增殖、迁移及新生血管的生成,进而参与DR的发生发展过程。VEGF属于新生血管形成调节因子,HG条件下,VEGF表达水平升高,可诱导视网膜内皮细胞增殖、迁移及促进新生血管形成,并可招募炎性细胞,抑制细胞凋亡;MMP-2主要表达于视网膜色素上皮细胞,若炎性细胞浸润至Bruch膜附近及视网膜色素上皮细胞与基质细胞,即可促进MMP-2的表达,进而参与视网膜病变的发生过程[14-16]。本研究结果显示,HG诱导的HRMECs中的VEGF与MMP-2蛋白水平均升高,而miR-1-3p过表达可降低细胞活力,促使迁移细胞数及管腔形成数减少,并可降低VEGF与MMP-2蛋白水平,提示miR-1-3p过表达可抑制HG诱导的HRMECs增殖、迁移及新生血管生成。分析其原因可能为miR-1-3p可能通过介导炎性反应与新生血管生成参与DR的发生发展过程,而上调其表达可抑制HG诱导的炎性通路活化,减轻HRMECs损伤,改善神经元功能,并可抑制血管周围细胞外基质降解,减弱内皮细胞的移行能力。
为进一步探究miR-1-3p在DR发生发展过程中的作用机制,本研究证实,miR-1-3p基因序列存在ANXA2结合位点,并可负向调节其表达。ANXA2可通过VEGF/VEGF受体2通路介导,激活细胞外调节蛋白激酶信号通路,促进新生血管生成,并可对VEGF的表达发挥正反馈作用,抑制ANXA2可减少由VEGF诱导所致的新生血管产生,研究表明,ANXA2过表达可促进纤溶酶生成,进而增加新生血管的生成量[17]。ANXA2作为多向性的钙依赖性磷脂结合蛋白,在多种肿瘤中异常表达。研究显示,ANXA2在食道鳞状细胞癌中表达上调,可激活髓细胞增生蛋白-缺氧诱导因子-1α-VEGF信号通路,促进细胞迁移侵袭[18]。ANXA2可在脑血管内皮细胞损伤中发挥调节作用,其水平升高可增加脑内皮细胞管腔形成数,促进细胞迁移,其作用机制可能与激活蛋白激酶B/细胞外信号调节激酶信号通路有关[19]。本研究结果显示,HG诱导的HRMECs中,ANXA2的mRNA及蛋白水平升高,提示干扰ANXA2表达可抑制HG诱导的HRMECs增殖、迁移及新生血管生成。本研究进一步分析发现,ANXA2过表达可减弱上调miR-1-3p表达对HG诱导的HRMECs增殖、迁移及新生血管生成的作用。分析其原因可能为新生血管生成过程涉及蛋白酶促反应,纤溶酶可调控此过程所需酶类,血管内皮细胞表面受体可维持纤溶系统平衡,调节内皮细胞迁移侵袭,而miR-1-3p可通过靶向调控ANXA2表达介导新生血管生成通路。由此推测阻断ANXA2与纤溶酶原等的作用可能作为治疗DR的潜在途径。
4 结论
HG诱导的HRMECs中,miR-1-3p表达下调,ANXA2表达上调,miR-1-3p过表达可通过靶向调节ANXA2表达,抑制细胞增殖、迁移及新生血管生成,但其具体作用机制仍需进一步探究。
