心脑舒通胶囊及有效成分对氧糖剥夺/复氧损伤脑微血管内皮细胞屏障完整性的影响及机制研究
2023-12-12曹玉爽郭莉琛杜鑫苑柴丽娟胡利民
王 萌,曹玉爽,郭莉琛,杜鑫苑,柴丽娟,袁 庆,胡利民
(天津中医药大学组分中药国家重点实验室、方剂学教育部重点实验室、天津市中药药理学重点实验室,天津 301617)
缺血/再灌注(ischemia-reperfusion injury,I/R)脑损伤情况下,可引起大量炎症、白细胞黏附、活性氧化等级联反应,破坏血脑屏障(BBB),从而导致神经元死亡[1-2]。脑微血管内皮细胞(brain microvascular endothelial cells, BMECs)是BBB的重要细胞成分,其细胞间紧密连接蛋白功能障碍会导致BBB完整性破坏,加重脑损伤[3-4]。心脑舒通胶囊(Xinnao shutong, XNST)是中药蒺藜科属植物蒺藜(TribulusterrestrisL. T)干燥地上全草提取制成的胶囊剂,临床广泛应用于脑缺血的治疗[5]。前期研究发现,XNST及其3种单体成分(化合物Ⅱ-14A、Ⅱ-5A、原薯蓣皂苷)能促进OGD/R损伤星形胶质细胞神经因子释放[6],且能明显降低脑微血管内皮细胞炎症因子TNF-α、IL-6的释放[7]。本研究进一步通过考察其对OGD/R损伤后BMECs屏障完整性的保护作用及机制,为XNST治疗缺血性卒中的临床应用及其二次开发提供实验依据。
1 材料与方法
1.1 细胞株及实验试剂bEnd.3 细胞株(ATCC,美国);缺氧小室(STEMCELL,27310,加拿大);荧光素钠(Sigma,美国);anti-lamin-B1 (ab171123)、Claudin-5 (ab15106)、Occludin (ab31721)、ZO-1(ab96594)购于美国Abcam公司;anti-p-JNK(#4668,Invitrogen公司);anti-JNK(#9252,Invitrogen公司);anti-p38(#9212)、anti-p-ERK1/2(#9101)、anti-ERK1/2(#9102)、 β-actin(#4967)、anti-p-IκBα(#2859)、anti-I kappa B kinase (IKK)(#2697)、anti-p-IKK (#2697)、anti-NF-κB/p65(#3032)均购于美国CST公司,Hoechst 33258 (Thermo,美国)。
1.2 实验仪器37 ℃饱和湿度培养箱(Thermo,FORMA3111型,美国),倒置相差显微镜(Nikon,TE200,日本),多功能读板机(TECAN,瑞士),低温高速离心机(BECKMAN,64R型,美国),超微量核酸分析仪(Malcom,E-spect,日本),实时荧光定量PCR仪(Applied Biosystems,7500型,美国),电阻仪(MERS00002,Millipore,美国),半干转仪(Bio-rad,美国),荧光显微镜(Leica Microsystems,GER)。
1.3 方法
1.3.1药物配制 XNST(批号:Z22021965,吉林敖东股份有限公司,中国):准确称量XNST中的药粉溶于无菌超纯水,分别配制1、10 g·L-1浓度母液于100 ℃沸水中煮沸30 min后过0.22 μm一次性过滤器,用时以DMEM细胞培养液按1 ∶1 000稀释。单体化合物:①化合物Ⅱ-14A(C61H100O13),②化合物Ⅱ-5A(terrestrinin A),③原薯蓣皂苷化合物(protodioscin):称取各单体粉末溶于DMSO中配制成10 mmol·L-1母液,用时以DMEM细胞培养液按1 ∶1 000稀释,单体化合物结构式如Fig 1所示。
1.3.2细胞培养 将bEnd.3细胞培养于含有10% 胎牛血清和100 kU·L-1链霉素和100 kU·L-1青霉素的DMEM中,在5% CO2、37 ℃饱和湿度培养箱中培养。
1.3.3细胞分组和处理 对照组(control):将培养液置换为高糖缓冲液,5% CO2、37 ℃培养箱正常培养4 h,4 h后置换为DMEM培养液,置5% CO2、37 ℃培养箱中继续培养。
模型组(OGD/R):将培养液置换为无糖缓冲液,于缺氧小室内进行缺氧缺糖处理,向小室内持续充入94% N2+5% CO2+1% O2的混合气体5 min后关闭缺氧小室,将小室放入 37 ℃孵箱中培养4 h后,换成DMEM培养液,置5% CO2、37 ℃培养箱中继续培养。
加药组:课题组前期研究发现,XNST在1、10 mg·L-1浓度能明显降低OGD/R损伤bEnd.3细胞炎症因子TNF-α的释放[7],因此本研究继续以1、10 mg·L-1浓度XNST深入考察其对OGD/R损伤bEnd.3细胞屏障功能的影响。具体操作为缺氧缺糖处理同模型组,4 h后加入含XNST(1、10 mg·L-1)或化合物Ⅱ-14A、Ⅱ-5A、原薯蓣皂苷(10 μmol·L-1)的DMEM培养液,并置于5% CO2、37 ℃培养箱中培养。
1.3.4药物对OGD/R损伤bEnd.3细胞跨膜电阻值(TEER)的影响 bEnd.3细胞按1×107L-1接种于Transwell小孔上层,连续检测其电阻值变化,待电阻值达到稳定值之后,对细胞进行造模及加药处理,具体操作方法及实验分组如1.3.3所示。24 h后每孔分别从3个不同地方检测电阻值,每组3孔,同时测量无细胞的空白Transwell培养液的电阻值作为基准值。
1.3.5药物对OGD/R损伤bEnd.3细胞荧光素钠透过率的影响 待 TEER 电阻值稳定后,用 1×PBS 溶液清洗 Transwell 内外两侧各 2~3次,向内侧加入200 μL新鲜配制的含 Na-Flu(100 μg·L-1) DMEM 溶液,外侧加入0.5 mL DMEM 溶液,置于37 ℃、5% CO2恒温培养箱中避光孵育1 h。1 h后取外侧100 μL溶液于96孔黑板中,将培养板放入荧光酶标仪中测定激发波长为485 nm,发射波长为530 nm的荧光强度。
1.3.6RT-PCR法检测药物对Claudin-5/Occludin/ZO-1 mRNA影响 bEnd.3细胞接种到6孔板,细胞分组及处理如1.3.3所述。24 h后用预冷的PBS轻洗细胞3次,用TRIzol法提取RNA。并按照SYBR GREEN PCR Master Mix试剂盒说明书进行扩增,用ABI 7500 RT-PCR 仪获得每个样品反应的CT值,将mRNA水平归一化为GAPDH水平,并根据以下公式计算处理细胞相对于对照样本的阈值循环(CT)值的变化倍数:变化倍数=2(-ΔΔCT)。所有样本均重复分析3次。特异性引物对列于Tab 1。

Tab 1 Specific primer pairs
1.3.7药物对相关蛋白表达的影响 bEnd.3细胞接种到6孔板,细胞分组及处理同1.3.3所述。24 h后用预冷的PBS轻洗细胞2次。每孔加入100 μL蛋白裂解液(含1%PMSF),于冰上震荡裂解15 min,刮下细胞于4 ℃ 12 000 r·min-1离心10 min。小心吸取上清并用BCA法测定其蛋白浓度。经10% SDS-PAGE胶质进行电泳转移到PVDF膜,将所述膜在室温下用5%脱脂乳孵育2 h并且在4 ℃下用以下一抗孵育过夜:JNK、p-JNK、p38、p-p38、ERK1/2、p-ERK1/2、Claudin-5、 Occludin 、ZO-1、NF-κB/p65、I kappa B alpha (IκBα)、p-IκBα、I kappa B kinase (IKK)、p-IKK、β-actin、lamin-B1作为内参,4 ℃滚轴孵育过夜后用TBST漂洗相应PVDF膜5 min×4次。加入相应的二抗室温下孵育1 h用TBST漂洗5 min×4次。用ECL化学发光试剂对PVDF膜进行显影,使用ImageJ软件从光密度值定量分析条带。
1.3.8免疫荧光检测Claudin-5/NF-κB的表达 将bEnd.3细胞培养在24孔板上,4%多聚甲醛固定15 min,0.1% Triton-X 100渗透10 min,3%牛血清白蛋白封闭细胞1 h,加入Claudin-5和NF-κB/p65一抗孵育。用PBS洗涤细胞3次,加入抗兔Alexa Fluor®488、抗兔Alexa Fluor®555于37 ℃孵育30 min。PBS轻洗3次,Hoechst 33258孵育5 min。PBS洗涤细胞3次后荧光显微镜下拍照。

2 结果
2.1 药物对OGD/R 损伤bEnd.3 细胞TEER值及Na-Flu透过的影响如Tab 2所示,与control比较,OGD/R组能明显降低bEnd.3细胞的电阻值(P<0.01),增加Na-Flu透过率(P<0.01);与OGD/R比较,XNST(1、10 mg·L-1)及化合物Ⅱ-14A、Ⅱ-5A、protodioscin均能明显增加损伤bEnd.3细胞的电阻值(P<0.01),降低Na-Flu透过率(P<0.01)。
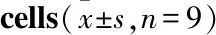
Tab 2 Effect of drugs on TEER and Na-Flu permeability in damaged bEnd.3
2.2 药物对OGD/R 损伤bEnd.3 细胞Claudin-5荧光表达的影响如Fig 2显示,control组Claudin-5荧光表达较强,且内皮细胞间紧密连接结构完整;与control组比较,OGD/R组Claudin-5的荧光强度明显降低,细胞间紧密连接破坏(P<0.01);与OGD/R组比较,XNST及化合物Ⅱ-14A、Ⅱ-5A、protodioscin均能增强Claudin-5荧光表达,改善细胞间紧密连接结构(P<0.05);与XNST组比较,化合物Ⅱ-5A、protodioscin能明显增加Claudin-5荧光表达(P<0.05)。
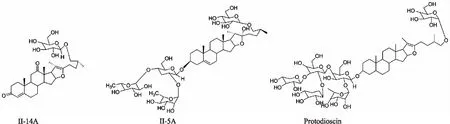
Fig 1 Structural formula of three monomer compounds
2.3 药物对OGD/R 损伤bEnd.3 细胞Claudin-5/Occludin/ZO-1 mRNA影响如Tab 3所示,与control组比较,OGD/R组能明显降低bEnd.3细胞Claudin-5、Occludin、ZO-1的mRNA表达(P<0.01);与OGD/R组比较,XNST、化合物Ⅱ-14A、Ⅱ-5A、protodioscin能明显增加Claudin-5的mRNA表达(P<0.01),XNST能明显增加Occludin的mRNA表达(P<0.05),protodioscin能明显增加ZO-1的mRNA表达(P<0.01);与XNST组比较,化合物Ⅱ-14A、Ⅱ-5A、protodioscin能明显增加Claudin-5的mRNA表达(P<0.05),protodioscin能明显增加ZO-1的mRNA表达(P<0.01)。
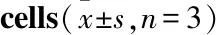
Tab 3 Effect of drugs on Claudin-5/Occludin/ZO-1 mRNA in OGD/R-damaged bEnd.3
2.4 药物对OGD/R 损伤bEnd.3 细胞Claudin-5/Occludin/ZO-1 蛋白表达影响如Fig 3所示,与control组比较,OGD/R组能明显降低bEnd.3细胞Claudin-5、Occludin、ZO-1的蛋白的表达(P<0.05);与OGD/R组比较,XNST能明显增加bEnd.3细胞Claudin-5、Occludin的蛋白表达(P<0.05),化合物Ⅱ-14A、Ⅱ-5A明显增加bEnd.3细胞Claudin-5、Occludin、ZO-1的蛋白表达(P<0.05),protodioscin明显增加bEnd.3细胞Claudin-5、ZO-1的蛋白表达(P<0.01);与XNST组比较,化合物Ⅱ-5A、protodioscin能明显增加Claudin-5的蛋白表达(P<0.01),Ⅱ-14A、Ⅱ-5A、protodioscin能明显增加ZO-1的蛋白表达(P<0.01)。
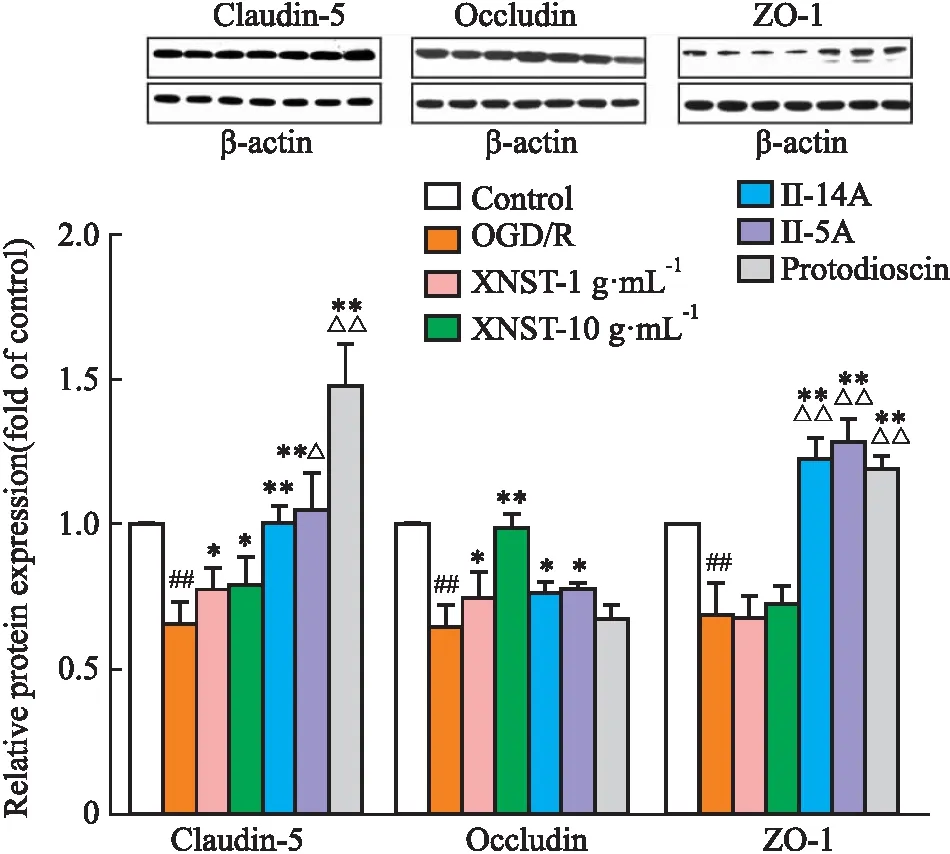
Fig 3 Effect of drugs on expression of tight junction protein in bEnd.3 cells under OGD/R n=3)
2.5 药物对OGD/R 损伤bEnd.3 细胞MAPK蛋白磷酸化表达的影响如Fig 4所示,与control组比较,OGD/R组能明显增加JNK、p38、ERK1/2磷酸化水平(P<0.01);与OGD/R组比较,XNST明显降低了p-JNK水平升高(P<0.05),但p-p38和p-ERK1/2没有降低。与OGD/R比较,化合物Ⅱ-5A和protodioscin治疗明显降低p-JNK、p-p38和p-ERK1/2表达水平(P<0.05),化合物Ⅱ-14A对p-JNK、p-p38和p-ERK1/2水平没有明显影响。与XNST组比较,化合物Ⅱ-5A、protodioscin能明显抑制ERK1/2蛋白磷酸化表达(P<0.01)。
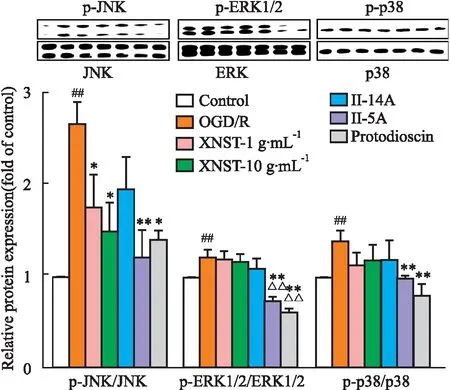
Fig 4 Effect of drugs on phosphorylation expression of MAPK protein in OGD/R injury bEnd.3 cells n=3)
2.6 药物对OGD/R 损伤bEnd.3 细胞NF-κB的核转位的影响免疫荧光染色检测NF-κB的主要亚基p65是否被转移到细胞核内,判断NF-κB是否被激活。免疫荧光结果如Fig 5所示,与control组比较,OGD/R组NF-κB/p65的核转位明显增加;与OGD/R组比较,XNST、Ⅱ-14A、Ⅱ-5A和protodioscin均能明显抑制NF-κB/p65的核转位;与XNST组比较,protodioscin能明显抑制NF-κB/p65核转位(P<0.01)。
2.7 药物对OGD/R 损伤bEnd.3 细胞NF-κB通路相关蛋白表达的影响如Fig 6所示,与Control组比较,OGD/R组细胞核中核NF-κB/p65水平明显升高(P<0.01),bEnd.3细胞质中IκBα和IKK的磷酸化水平明显增加(P<0.01);与OGD/R组比较,XNST、Ⅱ-14A、Ⅱ-5A和protodioscin的NF-κB / p65易位以及IκBα和IKK蛋白磷酸化明显降低(P<0.01);与XNST组比较,protodioscin能明显抑制IKK蛋白磷酸化(P<0.01)。

Fig 6 Effect of drugs on NF-κB protein expression in OGD/R injury bEnd.3 cells n=3)
3 讨论
既往研究和临床试验均证实,XNST对脑缺血具有明显作用,临床应用于治疗偏瘫、语言障碍、动脉硬化等[8-9]。药理学研究表明,XNST可通过抑制细胞凋亡和诱导血管生成促进急性脑缺血时MCAO/R大鼠的功能恢复[10]。BMECs具有紧密连接结构,限制细胞外物质运输到脑,对维持脑内稳态至关重要[11]。BBB通透性增加可加重脑缺血后中枢神经系统损伤的发展[12]。紧密连接蛋白Claudin-5、Occludin和ZO-1是脑内皮细胞维持紧密连接所必需的,它们可以密封相邻内皮细胞之间的细胞间隙,为循环分子形成选择性通透屏障[13]。本研究结果表明,XNST及化合物Ⅱ-14A、Ⅱ-5A、protodioscin能通过增加内皮细胞间紧密连接蛋白Claudin-5、Occludin和ZO-1的mRNA及蛋白表达水平,改善细胞间紧密连接结构,增加细胞间跨膜电阻及降低荧光素钠透过性,从而促进内皮细胞屏障完整性,其中单体化合物protodioscin对Claudin-5及ZO-1的mRNA及蛋白表达作用明显。
BMECs屏障功能受许多复杂的细胞信号通路和分子的调节[14]。MAPK是哺乳动物细胞中的Ser/Thr蛋白激酶,即c-jun N末端激酶(JNK)、细胞外信号相关激酶(ERK1/2)和p38蛋白[15]。NF-κB信号调节各种免疫和内皮屏障破坏的基因的表达,这些信号调节主要促炎细胞因子、黏附分子和紧密连接蛋白的上调[16]。本研究结果显示,XNST及化合物Ⅱ-14A、Ⅱ-5A、protodioscin明显抑制JNK、ERK1/2、p38的蛋白磷酸化,抑制MAPKs信号通路激活。且能明显抑制NF-κB核转位,抑制IκBα和IKK的磷酸化水平,表明其能通过抑制NF-κB通路激活来抑制炎症反应和发挥保护内皮细胞屏障完整性作用,其中单体化合物protodioscin对NF-κB核转位作用明显。
综上所述,本研究结果表明,XNST及化合物Ⅱ-14A、Ⅱ-5A、protodioscin可改善OGD/R损伤内皮细胞屏障完整性,稳定细胞间紧密连接结构,其机制可能与抑制NF-κB和MAPK信号通路激活有关,且单体化合物protodioscin对增加紧密连接蛋白表达及抑制NF-κB核转位作用更为明显。本研究结果可为XNST治疗脑缺血的临床应用提供药理学依据,也为从植物药中寻找具有促血脑屏障完整性脑保护作用的单体化合物提供参考。