卡维地洛调节ApoE-/-小鼠肝脏ACAD10、mTOR抗动脉粥样硬化
2023-12-12张海港
王 鹏, 袁 瑶, 张海港, 刘 雅
(陆军军医大学药学与检验医学系药理学教研室,重庆 400038)
近年来动脉粥样硬化(atherosclerosis, AS)一直稳居人类健康的 “第一杀手”,其防治已成为全世界共同关注的重大课题。越来越多的流行病学和临床研究支持非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)的病理进展与AS及其心血管事件之间的因果关联,同时NAFLD患者心血管风险与NAFLD的严重程度呈正相关[1]。由于生活方式的改变和经济的繁荣,全球NAFLD患者已超过17亿,这成为高血压、吸烟、胆固醇水平等经典危险因素严格控制之下而AS相关心血管疾病发病率仍居高不下的重要原因之一[2]。鉴于NAFLD已成为AS病程中血管损伤的持续驱动因素,因此对肝脏脂肪变性以及功能的改善很可能是抗AS的新的重要途径。
卡维地洛 (carvedilol)是第三代β受体拮抗剂,兼具非选择性β受体和α1受体的阻断作用, 广泛用于射血分数降低型心力衰竭、高血压和心肌梗死后左心室功能不全的治疗。近年研究表明,在动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular diseases, ASCVDs)患者、以及肥胖、糖尿病等动物实验中,Car均表现出传统β受体拮抗剂所不具备的代谢获益[3]。同时有大量的研究关注Car对肝脏纤维化、缺血/再灌注损伤、肝硬化、门静脉高压等多种肝脏损伤的保护作用[4],然而卡维地洛对脂肪肝的影响却鲜见报道。本研究拟初步阐明卡维地洛通过改善肝脏脂肪变性,发挥抗AS的作用。
1 材料与方法
1.1 动物与试剂本实验已通过陆军军医大学伦理委员会审查。ApoE-/-小鼠(C57BL/6JGpt-Apoeem1Cd82/Gpt)购于江苏集萃药康生物科技有限公司,动物使用许可证号为SYXK(渝)20170002;卡维地洛(纯度≥98%;索莱宝公司,C9980);羧甲基纤维素钠(毕得医药,BD01294049);高胆固醇饲料(40% kcal fat, 1.25% cholesterol, 0.5% cholic acid;Research Diets,D12109C);Acad10、Mtor和β-actin引物购自上海生工。BCA蛋白浓度测定试剂盒(碧云天公司,P0012S);2 × BeyoFastTMSYBR Green qPCR Mix(碧云天公司,D7260);小鼠脂肪酸β氧化酶(FAβO) ELISA Kit (蒙柏欧生物科技公司,MBE6046);mTOR抗体 (Cell Signaling Technology, 2983);ACAD10抗体 (购自中国武汉三鹰公司,17161-1-AP);β-actin抗体 (正能生物公司,250132);总RNA提取试剂盒(索莱宝公司,R1200);逆转录试剂盒 (Thermo Fisher,K1622);ECL发光液 (葆光生物,BG0001)。
1.2 动物分组和处理8周龄雄性ApoE-/-小鼠随机分为对照组(Control)和卡维地洛组(Carvedilol)。根据文献和预实验结果,确定卡维地洛(溶解于5 g·L-1羧甲基纤维素钠)灌胃给药,剂量为12.5 mg·kg-1[5]。同时Control组小鼠给予5 g·L-1羧甲基纤维素钠溶液灌胃,每天1次,共计10周。两组小鼠均给予高脂高胆固醇饲料喂养。
1.3 血脂水平及肝功能检测小鼠禁食过夜,取眼球血,室温放置2 h,3 000×g离心10 min取血清。用全自动生化分析仪检测总胆固醇(total cholesterol, TC)、总甘油三脂(total triglycerides, TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)、天冬氨酸转氨酶(aspartate aminotransferase, AST)、丙氨酸转氨酶(alanine transaminase, ALT)。计算AS指数(atherosclerotic index, AI) = (TC-HDL)/HDL;心脏危险因素(cardiac risk factor, CRF) = TC/HDL[6]。
1.4 血糖水平检测小鼠禁食过夜,取鼠尾血用血糖仪检测空腹血糖(fasting blood glucose, FBG)。糖耐量检测(glucose tolerance test, GTT):小鼠禁食16 h,给予葡萄糖2 g·kg-1腹腔注射,分别于注射前(0 min),注射后15、30、60、90、120 min取鼠尾血检测血糖值。胰岛素耐量测试(insulin tolerance test, ITT):小鼠禁食6 h,给予胰岛素0.5 U·kg-1腹腔注射,分别于注射前(0 min),注射后15、30、60、90、120 min取鼠尾血检测血糖值。
1.5 头臂干、肝脏、胰腺和脂肪组织HE染色取小鼠头臂干、肝脏、胰腺和睾丸上脂肪组织,切成2 mm×1 mm×1 mm小块,4% 多聚甲醛固定24 h,制备石蜡切片,脱蜡染色,脱水封片,光学显微镜下观察病理形态学改变,并利用软件(Image-Pro plus Version 6.0; Media Cybernetics, Silver Spring, MD)计算头臂干AS斑块面积及血管内、中膜比值。分别对肝脏[7]、脂肪和胰腺组织病理学改变进行评分[8]。
1.6 肝脏油红O染色肝脏组织4% 多聚甲醛固定24 h后冰冻切片,油红O染色40~60 min,60% 异丙醇脱色,苏木素染液复染30 sec,水洗后光学显微镜观察,并利用软件(Image-Pro plus Version 6.0; Media Cybernetics, Silver Spring, MD) 计算油红O染色面积。
1.7 肝脏脂肪酸β氧化酶检测取少量肝脏组织,加入适量生理盐水并低温匀浆,3 000 r·min-1离心10 min取上清。肝脏脂肪酸β氧化酶水平按ELISA检测试剂盒说明进行,酶标仪检测在450 nm处的吸光度。
1.8 Real-time PCR检测肝脏组织Acad10和MtormRNA的表达PBS冲洗肝脏组织,加入裂解液,低温匀浆裂解,加入0.2 mL氯仿,12 000 r·min-1离心10 min取上清至吸附柱,多次漂洗后得到总RNA。用逆转录试剂盒将RNA逆转为cDNA。用2×BeyoFastTMSYBR Green qPCR Mix试剂和引物配制反应体系对cDNA进行扩增和定量分析,采用2-△△CT法进行计算。所有小鼠基因引物序列见Tab 1。

Tab 1 Sequences of primers
1.9 Western blot检测肝脏组织ACAD10和mTOR蛋白表达肝脏组织用PBS冲洗后加入IP裂解液,低温匀浆裂解。4 ℃ 14 000×g离心5 min取上清,BCA法测定蛋白浓度。电泳、转膜、封闭,于4 ℃ 孵育抗体:ACAD10(1 ∶300)、mTOR(1 ∶1 000)、β-actin(1 ∶10 000)过夜。37 ℃孵育山羊抗兔(1 ∶2 000)、马抗鼠(1 ∶1 500) 二抗2 h后,ECL发光液显影,ImageJ软件分析蛋白相对含量。

2 结果
2.1 卡维地洛减轻ApoE-/-小鼠AS损伤本实验用高脂高胆固醇饲料喂养ApoE-/-小鼠建立AS模型,头臂干HE染色表明Carvedilol组小鼠AS斑块面积较Control组明显减少(P<0.01),动脉损伤包括内皮细胞脱落、内弹力膜断裂、平滑肌细胞增殖、迁移等明显改善,此外动脉内-中膜比值(P<0.05)较Control组明显降低(Fig 1)。
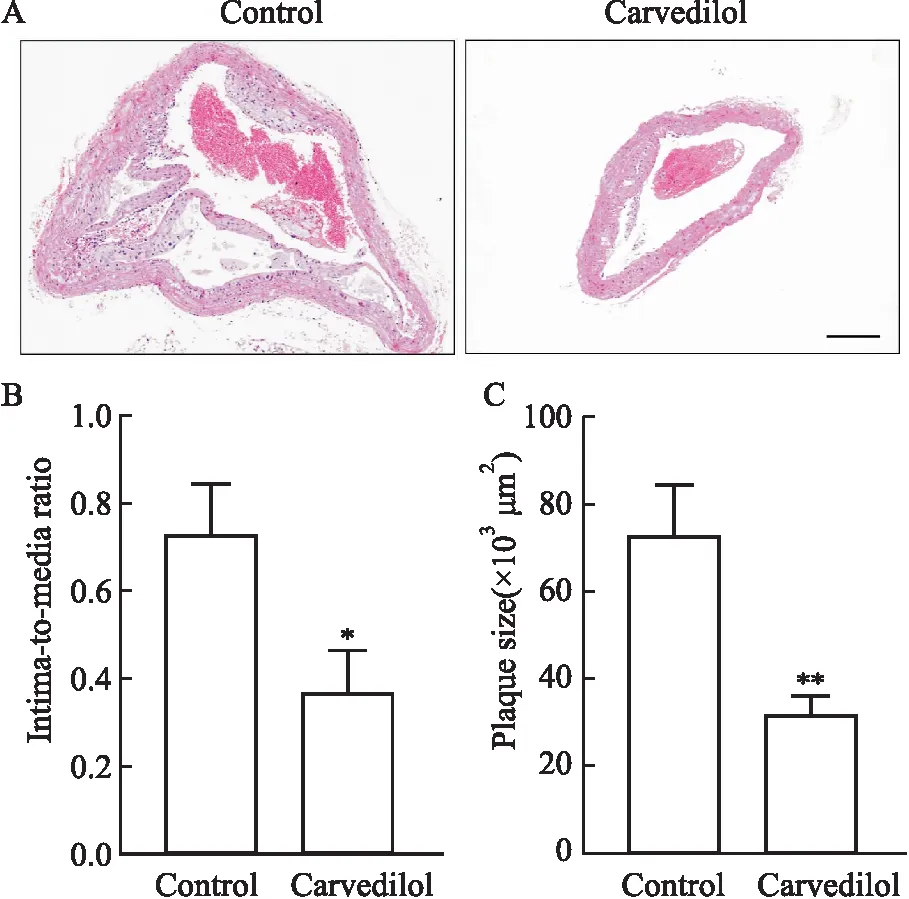
Fig 1 Carvedilol reduced severity of atherosclerosis
2.2 卡维地洛对ApoE-/-小鼠血脂水平的影响如Fig 2A所示,与Control组相比,Carvedilol组ApoE-/-小鼠外周血中TC、TG、LDL含量与Control组无统计学差异,但是HDL的含量明显升高(P<0.05)。AI和CRF是公认的灵敏度最高的AS及相关心血管疾病易感性的预测指标,在本实验中卡维地洛可明显降低ApoE-/-小鼠AI (P<0.05)和CRF (P<0.05) (Fig 2B)。
2.3 卡维地洛对ApoE-/-小鼠血糖水平的影响两组ApoE-/-小鼠空腹血糖(FBG)未见显著差异。但GTT结果表明,给予葡萄糖腹腔注射后30 min开始至120 min,Carvedilol组小鼠血糖水平一直较Control组明显降低(P<0.05);ITT实验则发现与Control组相比,Carvedilol组小鼠胰岛素注射后15 min至60 min,血糖水平均明显下降(P<0.05或0.01),但是在胰岛素注射后90 min血糖水平开始升高(P<0.01),持续至120 min (P<0.05)。可见卡维地洛明显增强胰岛素敏感性和葡萄糖稳态,从而提升了ApoE-/-小鼠在AS病程中应对血糖变化风险的能力(Fig 3)。
2.4 卡维地洛改善ApoE-/-小鼠肝脏损伤如Fig 4A,B所示,Control组小鼠肝脏表现出典型的脂肪样变性,包括肝脏内广泛的脂质空泡沉积,伴有明显的淋巴细胞浸润,评分提示病变相当于中度NAFLD;然而卡维地洛几乎完全逆转了ApoE-/-小鼠肝脏组织结构的损伤,评分提示为轻度NAFLD,与Control组小鼠相比,NAFLD评分明显下降 (P<0.01);肝脏油红O染色表明Carvedilol组肝脏脂质含量较Control组明显减少(P<0.01) (Fig 4C)。外周血ALT (P<0.01)和AST(P<0.01)水平也较Control组明显降低(Fig 4D,E)。
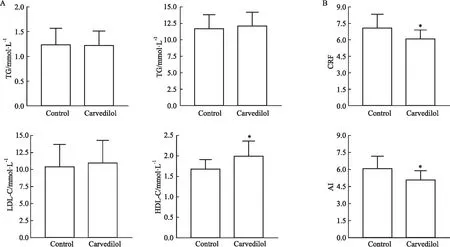
Fig 2 Effects of carvedilol on level of blood lipids in ApoE-/-

Fig 3 Effects of carvedilol on blood glucose
2.5 卡维地洛对ApoE-/-小鼠肝脏脂肪酸β氧化水平的影响如Fig 5所示,Carvedilol组小鼠肝脏脂肪酸氧化水平较Control组明显升高(P<0.01),提示卡维地洛能够减轻ApoE-/-小鼠肝脏线粒体脂肪酸氧化的损伤。

Fig 4 Carvedilol alleviated liver injuries and improved
2.6 卡维地洛对ApoE-/-小鼠胰腺和脂肪组织的影响Control组胰腺结构紊乱、疏松,胰腺组织腺泡细胞间隔水肿,可见脂滴和炎症细胞浸润,导管周围有实质性坏死,而Carvedilol组小鼠胰腺组织紧实,细胞和管腔基本保持正常结构,并未发现明显的脂质浸润。睾丸上脂肪组织HE染色显示,Control组脂肪细胞明显增大,形态不规则,呈大空泡状,细胞壁变薄、间隙增宽,血管几乎被增大的脂肪细胞挤压不见,而Carvedilol组小鼠脂肪细胞大小适中,其间血管分布正常。Carvedilol组小鼠胰腺组织病理学评分和脂肪细胞大小较Control组均显著下降(P<0.01),提示卡维地洛可显著减轻AS小鼠胰腺和脂肪组织的损伤 (Fig 6)。
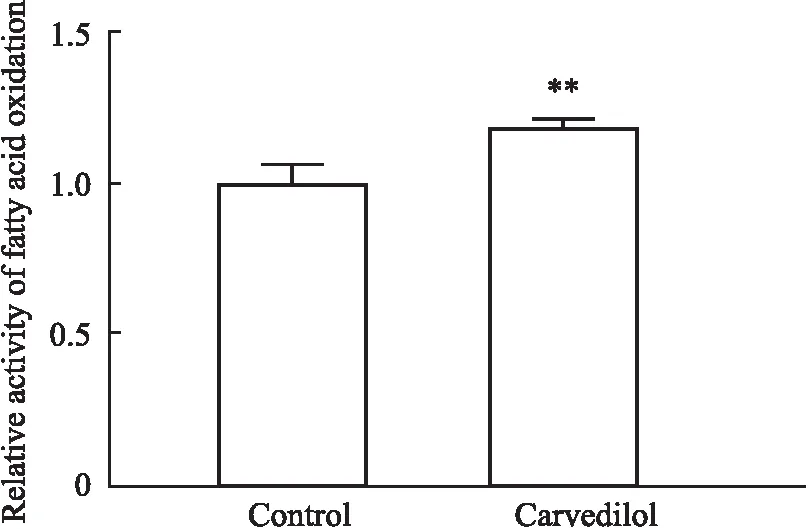
Fig 5 Effect of carvedilol on hepatic fatty acid

Fig 6 Effects of carvedilol on damages of pancreas and adipose
2.7 卡维地洛对ApoE-/-小鼠肝脏Acad10 和Mtor mRNA表达的影响与Control组比较,Carvedilol组肝脏Acad10 mRNA表达水平明显升高(P<0.01)而Mtor mRNA表达明显下调(P<0.01) (Fig 7)。
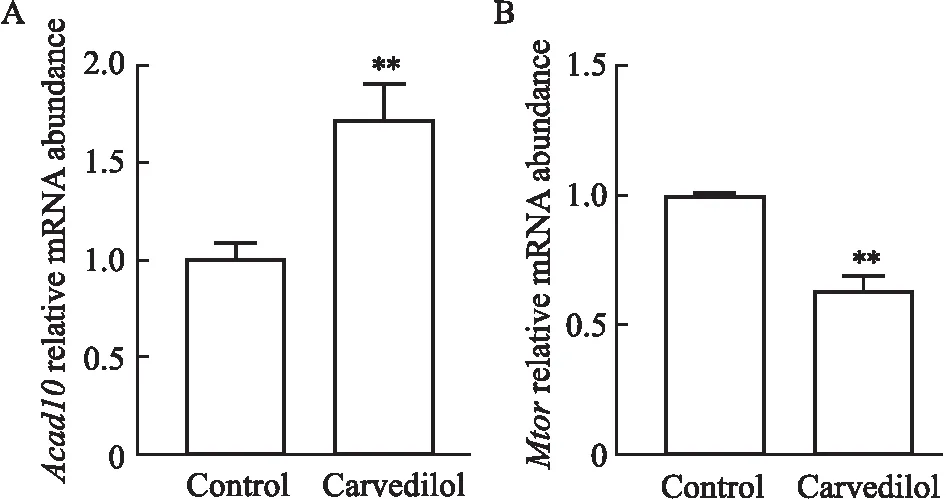
Fig 7 Effects of carvedilol on mRNA expression
2.8 卡维地洛对ApoE-/-小鼠肝脏ACAD10和mTOR 蛋白表达的影响Carvedilol组肝脏ACAD10蛋白表达较Control组明显上调(P<0.05),而mTOR蛋白表达水平明显下降 (P<0.01) (Fig 8)。

Fig 8 Effects of carvedilol on protein expression
3 讨论
本实验用高脂高胆固醇饲料喂养ApoE-/-小鼠建立AS模型,同时给予卡维地洛灌胃10周,小鼠AS斑块面积即显著减少,动脉损伤明显减轻,提示了卡维地洛具有抗AS作用。卡维地洛可明显升高AS小鼠外周血HDL-C水平,并几乎可以完全逆转AS小鼠肝脏组织表现出的典型的脂肪样变性。Chen等[5]研究表明了卡维地洛可显著增强Huh-7细胞中ATP结合盒转运子蛋白A1(ATP-binding cassette transporter A1, ABCA1)表达。ABCA1是关键的胆固醇逆转运蛋白,肝脏ABCA1表达的升高有利于胆固醇向循环转运,从而导致外周血HDL-C水平升高,并减少肝脏脂质累积。卡维地洛同时减轻了AS小鼠胰腺、脂肪组织的损伤、显著增加糖代谢的能力,这都有利于改善NAFLD[9]。目前众多的临床证据支持NAFLD与AS的联系,一项包含27项研究的荟萃分析,通过颈动脉内膜中层厚度、内皮功能障碍、冠状动脉钙化和动脉壁硬度测量,在调整了年龄、性别、体质量指数、吸烟、LDL、胰岛素抵抗和代谢综合征等经典危险因素后,发现NAFLD是亚临床AS的独立危险因素,而且NAFLD患者颈动脉斑块出现的频率更高,提示脂肪肝可能在AS的发病机制中发挥重要作用;此外,ASCVDs也已成为NAFLD患者最常见的死亡原因[10]。因此卡维地洛减轻肝脏脂肪变性,很可能是其实现AS保护的重要途径。
酰基辅酶A脱氢酶 (acyl-CoA dehydrogenases, ACADs)是一组结构相似的线粒体黄素酶,参与脂肪酰基辅酶A (acyl-CoAs)衍生物的β-氧化,已证实人类基因组包含ACAD家族的11个成员,具有一系列底物特异性和组织表达谱。其中ACAD10是ACAD家族的新成员,2004年由中国学者首先克隆,随后Jerry Vockley实验室预测ACAD10在线粒体β-氧化中对长链底物具有最大活性;通过构建ACAD10-/-小鼠发现ACAD10的缺失导致的最显著的特征是肥胖、糖耐量异常以及外周胰岛素抵抗,同时其外周血酰基肉碱表达谱的改变符合长链脂肪酸β-氧化受损的表现[11]。一项全基因组关联研究(genome-wide association study, GWAS) 证实了皮马印第安人2型糖尿病的高发与Acad10变异相关;Acad10基因多态性成为高血压遗传易感性增加的决定因素[12]。在本研究中,卡维地洛升高AS小鼠肝脏脂肪酸β-氧化酶水平,同时明显增强肝脏组织ACAD10 mRNA和蛋白表达水平,即可增强对长链Acyl-CoA的催化。长链脂肪酸的堆积被证实可以直接插入线粒体内膜,造成线粒体嵴缺陷,使电子传递链功能受损[13]。近年越来越多的证据表明线粒体脂肪酸代谢功能障碍与AS密切相关。因此,尽管目前尚缺乏直接的实验室和临床证据证实ACAD10具有AS保护作用,仍有理由推测卡维地洛可能上调肝脏组织ACAD10来纠正AS病程中糖脂紊乱。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)作为细胞能量代谢的重要传感器和控制器,与细胞生长和代谢密切相关,同时在AS、NAFLD等疾病中发挥着重要作用[14]。Wu等[15]研究表明,二甲双胍限制RagC通过核孔进入细胞核活化,阻断了RagC介导的mTOR激活,从而促进ACAD10表达的增加;mTOR抑制剂雷帕霉素也可诱导ACAD10表达上调。Wu 等[16]发现二甲双胍呈剂量依赖性抑制HaCaT细胞mTOR的表达,同时伴有ACAD10表达的升高,应用鱼藤酮抑制线粒体复合体可产生同样的效应。然而mTORC1的过表达几乎可以逆转二甲双胍诱导的HaCat细胞中ACAD10表达的增加,因此mTORC1的抑制可导致ACAD10的上调。Allen 等[17]通过特异性mTOR结合和功能测定证实了卡维地洛为新型的mTOR抑制剂,这与本实验中卡维地洛可显著下调AS小鼠肝脏mTOR表达的结果一致。总之,卡维地洛可通过抑制肝脏mTOR激活、上调ACAD10参与糖脂代谢,从而缓解脂肪肝,发挥抗AS作用。然而,卡维地洛调控mTOR与ACAD10的上下游关系尚缺乏直接证据,ACAD10对肝脏代谢功能的调控机制亦亟待深入研究。
