ACT001通过STAT1/CIITA/MHC-Ⅱ通路发挥抗炎抗氧化活性治疗脓毒症引起的急性肺损伤
2023-12-12周杰诗李伊楠刘慧娟
盛 磊,周杰诗,韩 旭,李伊楠,刘慧娟,孙 涛
(南开大学药学院,天津 300350)
急性肺损伤(acute lung injury,ALI)为中度或轻度的急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),表现为进行性低氧血症、呼吸困难和呼吸功增加[1],可由脓毒症(Sepsis)或创伤等肺外原因引起,因其高发病率和死亡率,严重威胁人类健康。目前临床上尚无特异性的治疗方案,一般针对症状采取机械性通气供氧进行支持性护理,但疗效不佳,死亡率仍高达40%[2],因此急需有效治疗药物的出现。ACT001是二甲基胺含笑内酯(dimethylaminomicheliolide,DMAMCL)的富马酸盐形式,其易溶于水、原料廉价易得、制备工艺简单成熟、成药性好[3-5],具有抗多种肿瘤、白血病和免疫调节活性,且作为治疗胶质母细胞瘤(glioblastoma,GBM)的孤儿药,目前已被批准进行多项临床试验(ACTRN12616000228482,澳大利亚和新西兰;ChiCTR-OIC-17013604,中国)。
NF-κB是脓毒症病理进程中促进炎症反应发生和扩大的关键因子,外源性刺激因子如脂多糖(lipopolysaccharide,LPS)与Toll样受体(Toll-like receptors,TLRs)结合,激活核因子NF-κB,增加一系列促炎基因的表达,进而促进一系列炎症因子如:TNF-α、IL-6等的生成与释放[6],引起免疫因子风暴;过量的炎症因子继续诱导活性氧(reactive oxygen species,ROS)的产生和氧化应激[7],共同导致肺部的损伤与衰竭。
有大量研究报道ACT001能通过抑制NF-κB相关通路发挥一系列生物活性:ACT001可以通过抑制AKT磷酸化抑制小胶质细胞NF-κB核易位,从而抑制NLRP3炎症小体活化,实现下调小胶质细胞的神经炎症反应[8];ACT001可以直接结合IκκB,抑制其磷酸化,从而抑制NF-κB信号通路实现抑制胶质母细胞瘤生长[9]。
基于以上背景我们评价ACT001对脓毒症引起的急性肺损伤的保护作用并探究其药理机制,为急性肺损伤的研究与临床治疗提供新的方案。
1 材料
1.1 细胞RAW264.7(小鼠单核巨噬细胞白血病细胞)购自南京凯基生物科技发展有限公司;
1.2 药物与试剂RPMI 1640培养基、胎牛血清、胰蛋白酶、青/链霉素购自 Gibco 公司,ROS检测试剂盒、一氧化氮检测试剂盒和总SOD活性检测试剂盒(WST-8法)购自碧云天生物技术有限公司;TNF-α、IL-6 EILSA检测试剂盒购自武汉三鹰生物技术有限公司;RNA提取试剂盒购自上海雅酶生物科技有限公司;ACT001由南开大学陈悦教授提供。
1.3 实验动物实验动物品系为SPF级C57BL/6(6-8周)小鼠,购自北京维通利华实验动物技术有限公司,实验动物使用许可证号为:SYXK(津)2019-0001。
2 方法
2.1 小鼠急性肺损伤模型的建立及给药治疗本研究建立腹腔注射LPS的小鼠脓毒症急性肺损伤模型。对小鼠进行分组,分为:对照组(control)、模型组(LPS)、ACT001低剂量治疗组(ACT001-L)和高剂量治疗组(ACT001-H)。d1模型组和治疗组小鼠按30 mg·kg-1腹腔注射LPS,对照组不做处理,治疗组造模2 h后分别按照低剂量100 mg·kg-1,高剂量200 mg·kg-1腹腔注射ACT001溶液,每24 h再次给药治疗。自造模起,每12 h观察小鼠生存状态,并记录小鼠体温等数据。
2.2 细胞培养及分组RAW264.7细胞用含有10%胎牛血清和1%青链霉素混合液的RPMI 1640培养基置于37 ℃,5% CO2培养箱中进行培养,取对数生长期的细胞进行实验,设置①对照组(control):正常培养的RAW264.7细胞组;②模型组(LPS):LPS浓度为1 mg·L-1;③ACT001低剂量治疗组(ACT001-L):LPS浓度为1 mg·L-1,ACT001浓度为5 μmol·L-1;④ACT001高剂量治疗组(ACT001-H):LPS浓度为1 mg·L-1,ACT001浓度为10 μmol·L-1。
2.3 小鼠肺泡灌洗液的收集造模24 h后,将小鼠安乐死,仰卧固定于操作台上,暴露气管,酒精棉球消毒,滞留针缓慢插入颈部气管约1/3处,用预冷PBS冲洗肺部3次,每次0.4 mL,收集肺泡灌洗液(BALF)。灌洗液转入EP管后立即置于冰盒中,1 000 r·min-1、4 ℃离心5 min,取得的上清用于蛋白质含量的测定,下层沉淀用红细胞裂解液处理后用流式细胞术检测中性粒细胞水平。
2.4 组织病理学评估急性肺损伤程度造模第7天将各组小鼠安乐死,取肺组织用10%福尔马林固定,流水冲洗,常规脱水、石蜡包埋切片后进行苏木精-伊红(HE)染色,在显微镜下观察肺组织的损伤情况。
2.5 肺湿干比测量造模24 h后,将小鼠安乐死,取出完整的肺立即称重为湿重,随后将肺组织置于EP管中开盖于烘箱中60 ℃烘至恒重即为干重。湿重除以干重即为肺湿干比。
2.6 流式细胞术
2.6.1MHC-Ⅱ检测 取给药培养24 h后的各组细胞,吸弃培养基,PBS清洗2次,加入胰酶消化后加完全培养基终止消化,800 r·min-1离心5 min,PBS重悬得到单细胞悬液,加入MHC-Ⅱ抗体,4 ℃孵育45 min,离心弃上清,再加二抗4 ℃避光孵育30 min,PBS清洗后过滤网,用流式细胞仪进行检测。
2.6.2中性粒细胞检测 取肺泡灌洗液离心后得到的细胞沉淀用红细胞裂解液处理,PBS重悬得到单细胞悬液,加入Ly6G和CD11b抗体避光孵育45 min,PBS洗去抗体后过滤网,用流式细胞仪进行检测。
2.6.3ROS检测 制备同“2.6.1”中的单细胞悬液,按照ROS检测试剂盒说明书进行处理,最后用流式细胞仪进行检测。
2.7 ELISA取上述收集到的血清和培养基上清,严格按照ELISA试剂盒说明书检测IL-6、TNF-α的含量。
2.8 Western blot细胞培养给药24 h后,提取各组细胞总蛋白,采用BCA蛋白定量法检测各组细胞蛋白浓度,99 ℃灭活蛋白10 min,SDS-PAGE凝胶电泳,转膜,5%脱脂奶封闭3 h,一抗4 ℃孵育过夜,二抗室温孵育2 h,ECL显色并用成像仪进行显影。
2.9 qRT-PCR用RNA提取试剂盒提取给药培养24 h后的各组细胞的总RNA,参照逆转录试剂盒说明书合成cDNA,引物序列由擎科生物合成,详见Tab 1。加入cDNA模板对Arg-1、iNOs、SOD基因进行PCR扩增,以GAPDH为内参照,采用△△CT值法测定各基因表达水平。

Tab 1 Primer sequence for real time PCR
2.10 NO含量和总SOD活性的测定取给药培养24 h后的各组细胞,取上清按照一氧化氮检测试剂盒说明书测定NO含量,取细胞按照总SOD活性检测试剂盒检测总SOD活性。
2.11 质谱分析取给药培养24 h后的各组细胞,提取总蛋白质,胶内酶解,多肽在0.1%的甲酸中重新悬浮,离心,并注入三重四离子阱和Orbitrap质谱仪,所有MS原始数据均使用MaxQuant进行分析。

3 结果
3.1 ACT001对小鼠急性肺损伤模型的治疗作用
3.1.1ACT001改善急性肺损伤小鼠的一般生活状态,延长生存期并维持体温恒定 ACT001结构如Fig 1A所示,在体内代谢为活性成分含笑内酯(micheliolide,MCL)(Fig 1B),建立脓毒症诱发急性肺损伤模型后给药,实验过程中观察小鼠一般生活状态:对照组小鼠行为活跃,皮毛柔顺、有光泽,呼吸平稳,排便正常;与对照组小鼠相比,模型组小鼠行动迟缓,多数呈蜷缩状,汗毛直立,出现寒颤,肛门处有粪便凝固粘连毛发;ACT001治疗组小鼠随治疗剂量增加,生存状态较模型组有明显改善。
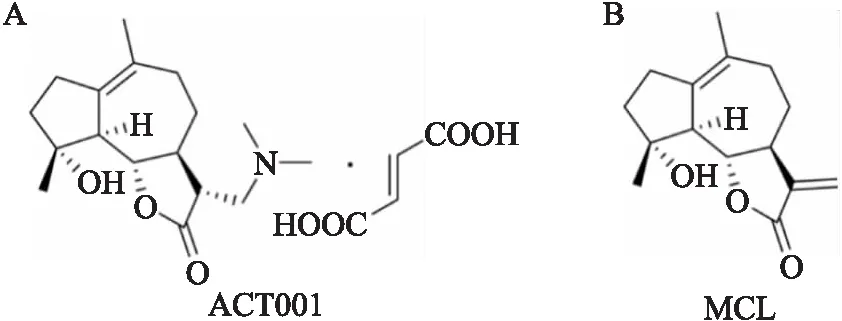
Fig 1 The chemical structure of ACT001 and MCL
生存情况显示:模型组小鼠在造模的60 h内出现了大规模的死亡,与之相比,治疗组小鼠,尤其是高剂量组的死亡率明显降低(Fig 2A)。实验中发现小鼠的死亡往往伴随着较低的体温(<33 ℃),与对照组相比,模型组在造模后48 h内平均体温明显降低(P<0.01);与之相比,治疗组小鼠的体温提高且稳定,尤其是高剂量治疗组在造模后24、36、48 h较模型组都有显著性差异(P<0.01)(Fig 2B)。可见ACT001在急性肺损伤的早期和症状高峰期就能发挥良好的治疗作用,抑制疾病进展。
3.1.2ACT001改善急性肺损伤小鼠肺组织病理 HE染色(Fig 3A)结果显示:对照组小鼠肺组织结构正常,肺泡结构完整且排列整齐,肺泡间隙无出血和炎性细胞浸润现象;模型组小鼠肺组织结构紊乱,肺泡结构被明显破坏,出血严重,可见大量炎性细胞浸润;高剂量治疗组小鼠较模型组情况得到了极大改善,出血与炎性细胞浸润明显减轻,肺泡结构相对完整,低剂量治疗组仍有轻微出血现象,但仍明显优于模型组。肺损伤评分(Fig 3B)结果与HE染色结果相一致。由此可见,ACT001剂量依赖性地改善LPS诱导的急性肺损伤。
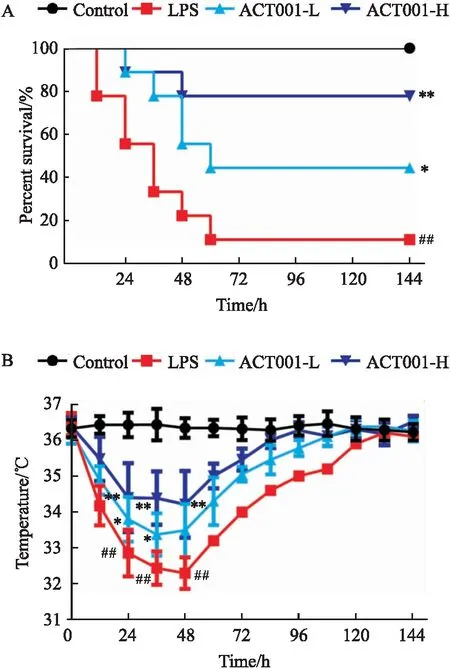
Fig 2 Effect of ACT001 on percent survival and temperature
3.1.3ACT001缓解急性肺损伤小鼠肺水肿情况 模型组小鼠因肺组织结构受损、肺泡结构被破坏,出现严重的出血和炎性渗出,由Fig 3C可见其肺湿干比较对照组明显上升(P<0.01),呈现肺水肿状态。在ACT001的治疗下,肺湿干比较模型组降低,其中高剂量治疗组下降程度更加明显(P<0.01),可见ACT001剂量依赖性地改善急性肺损伤小鼠肺水肿情况。
3.1.4ACT001改善肺组织中蛋白质渗出和中性粒细胞浸润 流式细胞术检测肺泡灌洗液中中性粒细胞水平,结果显示:模型组小鼠肺泡灌洗液中中性粒细胞水平较对照组明显增加(P<0.01),而在接受ACT001治疗后,低、高剂量治疗组肺泡灌洗液中中性粒细胞水平均大幅度下降(P<0.01)(Fig 4A,B);BCA法检测BALF中蛋白质浓度(Fig 4C),结果显示:模型组蛋白质浓度较对照组明显增加(P<0.01),而在ACT001作用下剂量依赖性降低(P<0.01);综合以上结果表明:ACT001可缓解急性肺损伤小鼠肺部的蛋白质渗出和炎性细胞浸润。
3.1.5ACT001降低急性肺损伤小鼠血清中炎症因子浓度 ELISA检测血清中炎症因子水平(Fig 4D,E),结果显示:模型组的TNF-α及IL-6含量较对照组均明显升高(P<0.01),而在高剂量ACT001治疗下明显降低(P<0.01)。
3.2 ACT001改善LPS诱导的RAW264.7细胞炎症反应
3.2.1ACT001促进RAW264.7细胞M2 抗炎极化,抑制M1促炎极化 Western blot结果如Fig 5A所示,以β-actin为内参,在LPS刺激下,RAW264.7细胞的iNOs蛋白相对表达水平明显上升,而在ACT001作用下,其表达水平剂量依赖性下降,Arg-1的蛋白表达水平趋势与之相反。qRT-PCR(Fig 5B)结果和Western blot结果相一致。共同说明:ACT001剂量依赖性地促进RAW264.7细胞M2抗炎极化,抑制M1促炎极化。
3.2.2ACT001抑制RAW264.7细胞产生 NO Griess法测定各组RAW264.7细胞产生的NO水平,如Fig 5C所示,模型组与对照组相比,LPS诱导的RAW264.7细胞中NO浓度明显上升(P<0.01);ACT001低、高剂量组与模型组相比,NO含量均明显下降(P<0.01)且呈现剂量依赖性。
3.2.3ACT001抑制RAW264.7细胞产生炎症因子 ELISA检测各组RAW264.7细胞产生的相关炎症因子水平(Fig 5D),结果显示:LPS炎症模型组的TNF-α及IL-6水平较对照组明显升高(P<0.01),而在ACT001影响下剂量依赖性降低(P<0.01)。
3.3 ACT001改善LPS诱导的RAW264.7细胞氧化应激
3.3.1ACT001清除ROS 流式细胞术检测各组RAW264.7细胞产生的ROS水平,结果如Fig 6A,B所示:LPS刺激下,ROS阳性的细胞比例较对照组明显增加(P<0.01),而在ACT001影响下,与模型组相比,ACT001低、高剂量组ROS阳性细胞比例分别下调约11.1%和33.4%(P<0.01)。
3.3.2ACT001促进SOD mRNA的表达,增加SOD活性 qRT-PCR检测各组RAW264.7细胞的SOD mRNA的表达水平(Fig 6C),总SOD活性检测试剂盒检测总SOD活性(Fig 6D),两者结果相一致:模型组较对照组的SOD mRNA水平和蛋白活性下降(P<0.01),ACT001低、高剂量组较模型组均上升(P<0.01)。
3.4 ACT001主要通过MHC-Ⅱ途径改善急性肺损伤提取各组不同处理RAW264.7细胞的蛋白质进行质谱检测及KEGG通路富集分析(Fig 7A),将在模型组中上调的通路与给药后下调的通路取交集发现,ACT001可能主要是通过影响抗原处理与呈递通路发挥治疗脓毒症诱发的急性肺损伤的作用。
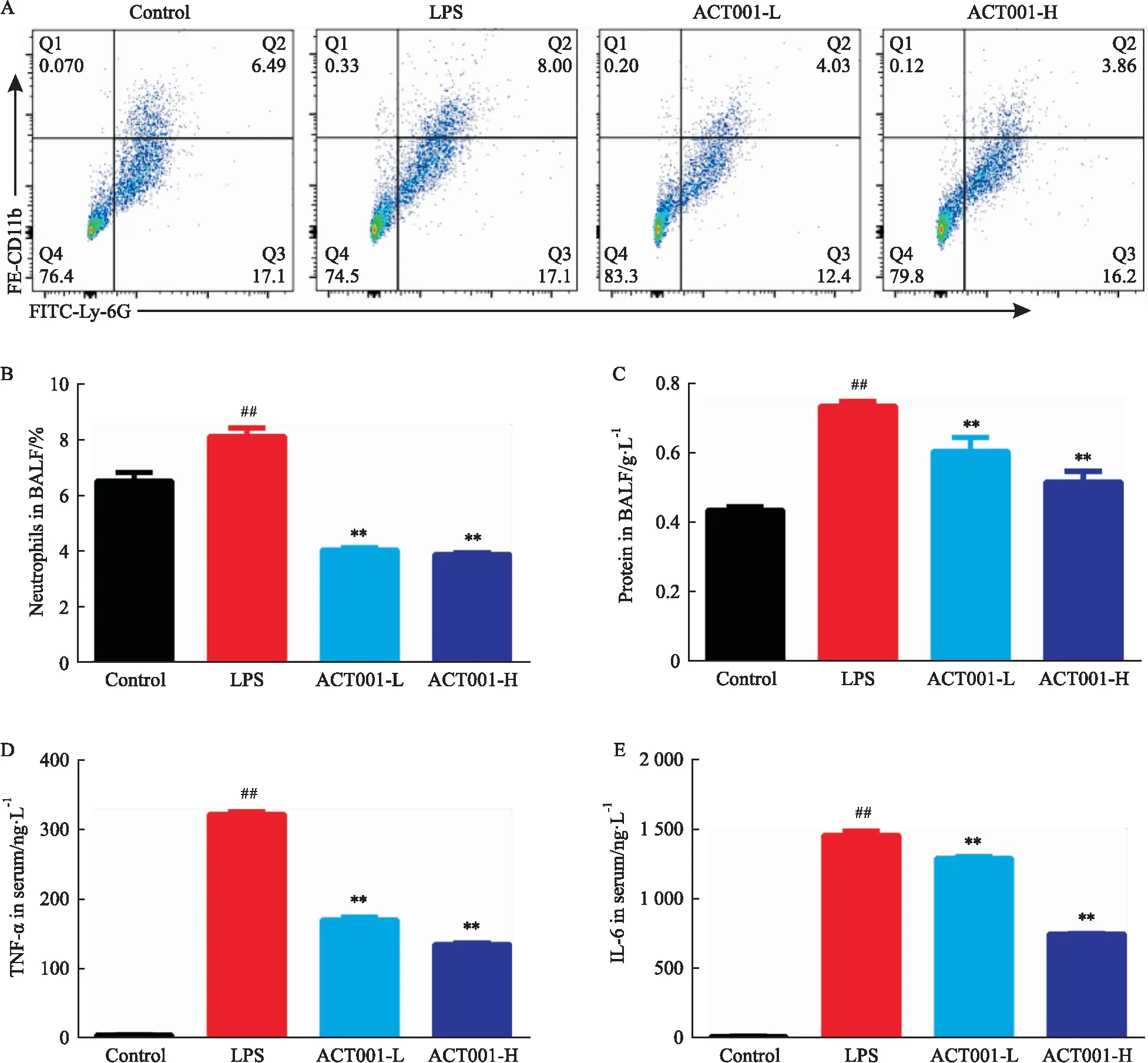
Fig 4 Effect of ACT001 on BALF and inflammation factors in serum in LPS-induced ALI
Western blot检测抗原处理与呈递通路中关键蛋白p-STAT1、CIITA和MHC-Ⅱ的表达水平,发现LPS刺激下,RAW264.7细胞中p-STAT1、CIITA和MHC-Ⅱ的蛋白表达水平明显增加,而在ACT001作用下,尤其在高浓度ACT001环境中,三者的蛋白水平明显下降(Fig 7B);进一步地,我们标记了RAW264.7细胞表面的MHC-Ⅱ蛋白,用流式细胞术进行分析验证,结果(Fig 7C,D)与Western blot结果相一致。综合以上结果表明ACT001能够通过抑制STAT1的701位酪氨酸磷酸化,抑制转录因子CIITA产生,从而抑制MHC-Ⅱ的表达,抑制抗原处理与呈递过程发挥抗炎、抗氧化作用,最终实现治疗脓毒症诱发的急性肺损伤。
4 讨论
脓毒症仍然是重症监护病房(intensive care unit,ICU)死亡的主要原因,也是一项重大的全球公共卫生安全挑战。脓毒症会引起多器官损伤衰竭,而肺是其首先损害的重要器官,可导致急性肺损伤,最终导致死亡[10]。革兰阴性菌的LPS结合细胞表面Toll样受体,引起过度的先天性免疫反应,在肺部表现为产生大量的炎症因子、引起免疫细胞的招募和活化并产生过量的ROS[11],导致血管通透性增加、正常内皮屏障功能持续丧失以及肺泡结构受损,正常的肺微循环遭到破坏,导致富含蛋白质的肺水肿积累,影响肺换气功能,表现为进行性动脉低氧血症、呼吸困难和呼吸功明显增加,最终导致个体死亡[12]。其药物开发大多都停留在临床前阶段,临床上也缺乏十分有效的药物,因此,寻找有效的靶点与药物是当前急需解决的问题。

Fig 5 Effect of ACT001 on anti-inflammatory activity of RAW264.7 cells under LPS
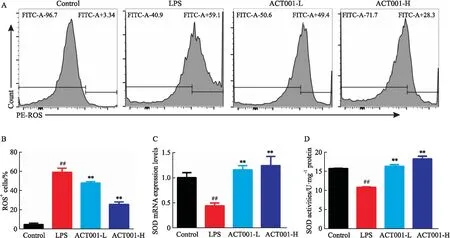
Fig 6 Effect of ACT001 on antioxidative activity of RAW264.7 cells under LPS
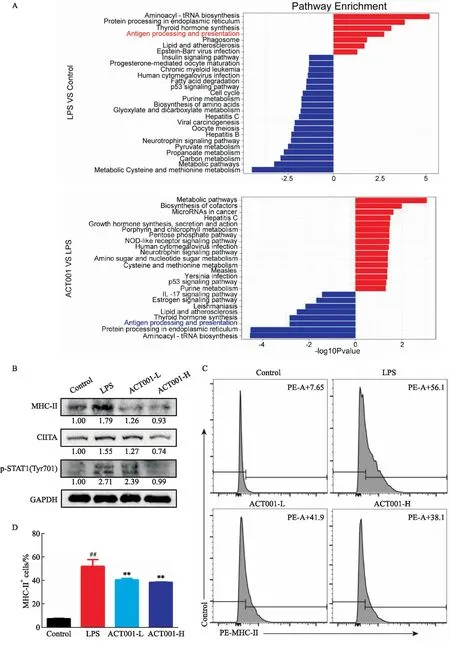
Fig 7 Effect of ACT001 on different pathways of RAW264.7 cells under LPS
急性肺损伤的病理生理进程复杂,目前还没有完全阐明其发病机制,可由创伤感染等因素引起,所以本研究采取腹腔注射LPS的方式引起的全身免疫因子风暴,构建小鼠急性肺损伤模型。其病理进程中大量免疫细胞如中性粒细胞、巨噬细胞、淋巴细胞在肺部被招募和激活[13],其中中性粒细胞在急性肺损伤的进程中发挥着核心作用[14],其活化可增加肺泡-毛细血管屏障的通透性,导致ROS产生,增加局部炎症从而导致肺组织损伤[15]。本研究结果显示:在个体水平上,ACT001维持模型小鼠体温恒定,提高存活率;在组织水平上,ACT001能明显减轻肺部的中性粒细胞浸润,保护肺泡结构,减少渗血和蛋白质渗出,改善肺水肿情况,降低血清中炎症因子水平,并呈现出剂量依赖性。全面而有力地证明了ACT001对脓毒症引起的急性肺损伤具有良好的治疗作用。
大量证据[13,15-16]表明,炎症反应和氧化应激是急性肺损伤病理进程中对机体造成损伤的两种重要途径:外源性物质结合相关受体,如TLRs,通过病原体相关分子模式(pathogen-related molecular patterns,PAMPs)或损伤相关分子模式(damage-related molecular patterns,DAMPs),激活核因子NF-κB,诱导一系列炎症因子释放引起免疫因子风暴;免疫因子的大量产生进一步诱导氧化应激和ROS的产生[7],导致个体的肺血管内皮损伤,引起出血和免疫细胞浸润,最终导致死亡。
NF-κB-诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOs)-NO信号通路是一条重要的氧化应激通路,而iNOs也是RAW264.7细胞促炎M1极化的标志物。Western blot和qRT-PCR结果共同表明:ACT001促进LPS处理的RAW264.7细胞由促炎M1极化类型向抗炎M2极化类型转变,降低NO、IL-6、TNF-α的产生与释放,抑制炎症反应扩大。ROS的流式细胞术结果显示:在ACT001治疗下,接受LPS刺激的RAW264.7产生的ROS大幅度下降,且呈现剂量依赖性;通过对总SOD活性和SOD mRNA的表达水平进行检测,推测可能是ACT001促进SOD的产生来发挥清除ROS的作用。从而证明了ACT001对炎症反应和氧化应激这两条关键损伤通路都能发挥良好的治疗作用。
最后通过质谱检测并进行KEGG通路富集,探究ACT001治疗急性肺损伤的机制,发现抗原处理与呈递通路在LPS刺激下明显上调而在ACT001处理下发生下调,推测其是ACT001发挥作用的关键通路。巨噬细胞是专业抗原呈递细胞之一(antigen-presenting cells,APCs),组织相容性复合体2(MHC-Ⅱ)是其抗原处理与呈递过程中的重要分子,磷酸化的STAT1可生成二聚体,激动MHC-Ⅱ基因的转录因子CIITA,从而促进MHC-Ⅱ基因的转录、翻译,生成大量MHC-Ⅱ蛋白[17];抗原在溶酶体等细胞器处理下产生抗原肽,与MHC-Ⅱ分子在细胞内结合,并被运输到细胞膜上,被CD4+T细胞识别结合,进而引起下游的一系列免疫反应,包括炎症和氧化应激等[18]。我们使用Western blot检测了p-STAT1、CIITA和MHC-Ⅱ的蛋白表达水平,证明了ACT001可以抑制STAT1的701位酪氨酸磷酸化,抑制CIITA的产生,从而抑制MHC-Ⅱ基因的表达,抑制抗原处理与呈递;我们还进一步通过流式细胞术检测不同处理下细胞表面带有MHC-Ⅱ蛋白的RAW264.7细胞比例,结果也与Western blot结果相一致,进一步证明了ACT001对MHC-Ⅱ通路的抑制作用。
综上所述,ACT001可以通过抑制STAT1的701位酪氨酸磷酸化,抑制CIITA的产生,从而抑制MHC-Ⅱ基因的表达,抑制抗原处理与呈递通路,在炎症反应和氧化应激层面都发挥活性,有效缓解脓毒症引起的急性肺损伤的肺水肿、蛋白质渗出和炎性细胞浸润等肺部损伤,维持个体体温稳定,提高存活率,从而治疗脓毒症引起的急性肺损伤。
此外ACT001也具有良好的生物安全性和稳定性,并且原料廉价易得,有望作为“老药新用”型药物开发成为治疗脓毒症引起的急性肺损伤的新药。