基于网络药理学和分子对接探讨芪术抗癌方治疗原发性肝癌的分子机制
2023-12-12马梦情孙嘉玲冯文杏韩志毅孙新锋马文峰陈剑平周小舟
马梦情, 孙嘉玲,胡 锐,3,冯文杏,韩志毅, 孙新锋,马文峰,张 卫,陈剑平,周小舟
[1. 广州中医药大学第四临床医学院,广东 广州 510006;2.深圳市中医院国家临床肝病(中医)重点专科,广东 深圳 518033;3. 澳门科技大学中医药学院,澳门 999078;4. 深圳市中医院中药制剂研究重点实验室,广东 深圳 518033]
原发性肝癌(primary liver cancer,PLC)属于恶性肿瘤,发病率逐年增加,死亡率位居全球癌症第二[1]。西医对于PLC的治疗方式有限,且大部分患者发现时已处于中晚期,治疗上以介入、放化疗为主,后期副作用较大,易复发以及预后差[2]。随着中医药在癌症中的参与度逐渐增加,中医在改善肿瘤患者症状、生活质量以及缩小病灶等方面存在独特优势[3]。中医认为肝癌致病主要与正气亏虚,脏腑功能气血失衡,气机郁滞,痰瘀酿毒久羁,从而有形肿块盘踞腹内。芪术抗癌方(Qizhu anti-cancer prescription,QZACP)由广州中医药大学第四临床医学院肝病专家周小舟教授拟定,已应用于临床近十年,并获得了国家发明专利(专利号:ZL20161 0843303.9)。该方针对PLC本虚标实的基本病机,以扶正抗癌为基本治疗原则,其中黄芪、白术、党参补脾益气,山药健脾补肾,鸡内金既可软坚又可散结,柴胡疏肝行气,莪术、白花蛇舌草活血逐瘀,炙甘草调和诸药,全方共奏健脾益气,活血化瘀之效[4]。前期研究表明,QZACP联合经肝动脉化疗栓塞术(Transcatheter Arterial Chemoembolization,TACE)较单纯TACE相比可以改善PLC患者的生活质量,延长存活时间[5]。并通过体外实验发现QZACP方可以影响肝癌细胞上皮间质化[6],但其相关机制尚未阐明。网络药理学利用大数据平台从多层面阐述中药复方的作用机制,通过确定药物-疾病的共同靶点,蛋白互作,相关通路富集分析以及分子对接预测和体内实验,为验证QZACP治疗PLC提供有效及合理依据,为进一步研究提供新思路。
1 材料与方法
1.1 网络药理学研究
1.1.1数据库与软件 研究所用数据库与软件,见Tab 1。
1.1.2芪术抗癌方成分及靶点的筛选 通过中药系统药理学数据库(TCMSP)检索出QZACP中黄芪、白术、白芍、柴胡、山药、薏苡仁、白花蛇舌草、莪术、鸡内金、甘草十种药物的靶点成分。以生物口服利用度OB≥30%、药物相似性DL≥0.18对成分进行筛选。由于TCMSP数据库获得“莪术”相关化合物较少,另外没有“鸡内金”的相关化合物,因此利用BATMAN-TCM数据库,以截止值Score cutoff ≥20且P-value cutoff<0.05为筛选条件,得到成分在Pubchem及Swiss Target Prediction数据库将靶蛋白进行处理。将各数据库筛得的成分相关靶点去除重复后合并,得到QZACP的成分靶点数据集,利用Uniprot数据库将得到的靶蛋白名称进行处理。
1.1.3原发性肝癌(PLC)靶点的收集及药物靶点预测 在OMIM、Drugbank、GeneCards数据库中分别检索关键词“hepatocellular carcinoma”“Liver cancer”来获取PLC的疾病靶点。通过Uniprot数据库中将靶点简称进行处理,并构建PLC的疾病靶点数据集。取QZACP筛得成分和PLC的交集靶点后绘制venn图。
1.1.4中药复方网络构建 对QZACP成分与PLC的交集靶点进行处理,通过Cytoscape 3.9.1软件构建QZACP-有效成分-交集靶基因的药物调控网络图;QZACP、有效成分及交集靶基因用“节点”表示,“节点”之间的相互连接用“边”表示。
1.1.5PPI蛋白互作网络关系图构建 通过String网站构建PPI网络,生物种属选择“homo sapiens”,设置网络参数“medium con fidence”>0.400,同时去除游离无连接的节点,其他参数的设置保持默认,绘制得到PPI网络[7]。在PPI网络中,利用节点的大小及颜色深浅凸显Degree值大小,边的粗细情况则反映了组合分数(combine score)的大小。通过CytoNCA插件对核心聚类蛋白进行分析得到核心作用靶点。

Tab 1 Related databases and application software
1.1.6GO功能及KEGG通路富集分析 借助DAVID平台对交集基因进行GO功能富集分析和KEGG通路富集处理,以P<0.001为筛选条件进行关键靶基因的GO功能富集分析。根据P值排除宽泛通路后,筛选出前20者使用R 4.1.1软件进行可视化,另外通过KEGG通路分析得到通路图。
1.1.7分子对接 利用分子对接研究QZACP的关键成分与核心靶点,首先在PubChem 数据库获取化合物的2D结构,并通过Chem3D优化为3D结构,进行能量最小化处理后保存为mol2格式。在PDB数据库下载核心靶点的pdb格式,利用pymol软件去水处理。通过AutoDock-Vina软件对分子对接获得结合能,最后Pymol进行可视化处理。
1.2 体内实验验证
1.2.1材料与试剂 人肝癌细胞Huh-7购自广州速研生物科技有限公司。雄性BALB/c裸鼠,4-6周龄,购于广东省医学实验动物中心;一般饲养,恒温(23±2) ℃,湿度在40%~60%,照明昼夜交替,自由饮水与进食。QZACP(黄芪20 g、炒白术15 g、柴胡10 g、白芍10 g、薏苡仁30 g、淮山15 g、鸡内金10 g、莪术10 g、白花蛇舌草10 g、炙甘草5 g)中药材由深圳市中医院提供。EGFR(GB111504)购买于Servicebio生物技术公司;AKT1(A5023)购买于selleck公司;STAT3(ab68153)、山羊抗兔IgG H&L(ab6721)购买于Abcam公司。本实验经中科产业控股(深圳)有限公司动物福利伦理委员会批准,批准号:20220070。
1.2.2动物模型构建及给药 将裸鼠随机分为模型组和QZACP组,每组4只。收获对数生长期的人肝癌细胞Huh-7,使用PBS将细胞悬液浓度调整为1×1010L-1,于每只裸鼠右侧腋窝皮下注射125 uL细胞悬液。于造模后第2天灌胃给药,根据人与鼠药物剂量换算公式算出小鼠每日给药剂量,QZACP组每日按21.2 g·kg-1灌胃,模型组每日给相同剂量的生理盐水灌胃[8]。于第8天开始隔天用游标卡尺测量皮下瘤的长和宽,使用公式:体积=长×宽2×0.5,计算肿瘤的体积,绘制肿瘤生长曲线。于造模第20天,用异氟烷吸入麻醉,留皮下瘤组织用于进一步检测。
1.2.3HE染色 取出肿瘤组织,4%多聚甲醛固定组织48 h左右,梯度乙醇及二甲苯脱水,每步15~20 min,石蜡包埋备用。切片后用HE进行染色、封片,在显微镜下观察组织病理学改变。
1.2.4蛋白印迹法测定细胞内相关蛋白的表达 利用RIPA裂解液提取组织蛋白,BCA法测定蛋白浓度并计算,使用SDS-PAGE电泳分离蛋白并转移到PVDF膜上,转膜成功后,在5%脱脂牛奶中封闭1 h后,与STAT3(1 ∶1 000)、EGFR(1 ∶1 000)、AKT1(1 ∶1 000)抗体在4 ℃摇床中孵育过夜,次日TBST洗膜3次后,与二抗(1 ∶2 000,羊抗兔)室温下孵育1 h,检测到的蛋白质用使用超敏ECL发光溶液显影后分析。

2 结果
2.1 QZACP成分及靶点筛选通过TCMSP数据库搜索QZACP的相关药物的所有化学成分,共得到184个活性化合物。在TCMSP数据库未查到鸡内金,然后利用BATMAN-TCM数据库检索鸡内金活性成分7个,并通过BATMAN-TCM补充莪术成分6个。删除重复成分后共获得QZACP活性化合物177个,通过SwissTarget数据库检索得到上述成分的的靶点,删去重复值后得到关键靶点有625个。
2.2 PLC靶点及药物可能作用的靶点通过OMIM、drugbank、GeneCards3个数据库获得8 227个,删除重复值后得到452个。将疾病基因与药物靶点作Venn图,得到共有靶点98个,见Fig 1。

Fig 1 Venn diagram of drug-disease target intersection
2.3 中药-活性成分-靶点-疾病网络关系构建利用Cytoscape3.6.1,将QZACP筛选得到的625个交集靶点、相关活性成分以及PLC的靶点构建"中药 -活性成分 -靶点 -疾病"网络图。并通过Analyze network计算获得相关节点的度值(Degree)、中心性(Betweenness centrality),度值越大则表示该化合物发挥治疗作用的可能越大。Analyze network分析显示关键活性成分主要为Quercetin(槲皮素)、3,22-dihydroxy-11-oxo-delta(12)-oleanene-27-alpha-methoxycarbonyl-29-oic acid(甘草酸苷)、Denudatin B(白玉兰素B)等(Tab 2)。

Tab 2 The potential active ingredients of QZACP
2.4 PPI蛋白互作网络图构建将获得的数据录入String数据库中进行蛋白互作,然后用Cytoscape 3.9.1进行分析获得Degree值,见Fig 2。平均degree值为44.7,图中degree值越大则颜色越深点越大。并利用CytoNCA插件对关键蛋白进行分析,以Betweenness、Closeness、Degree等3个值为筛选条件,经过两次筛选获得10个核心基因作用网络,见Fig 3。
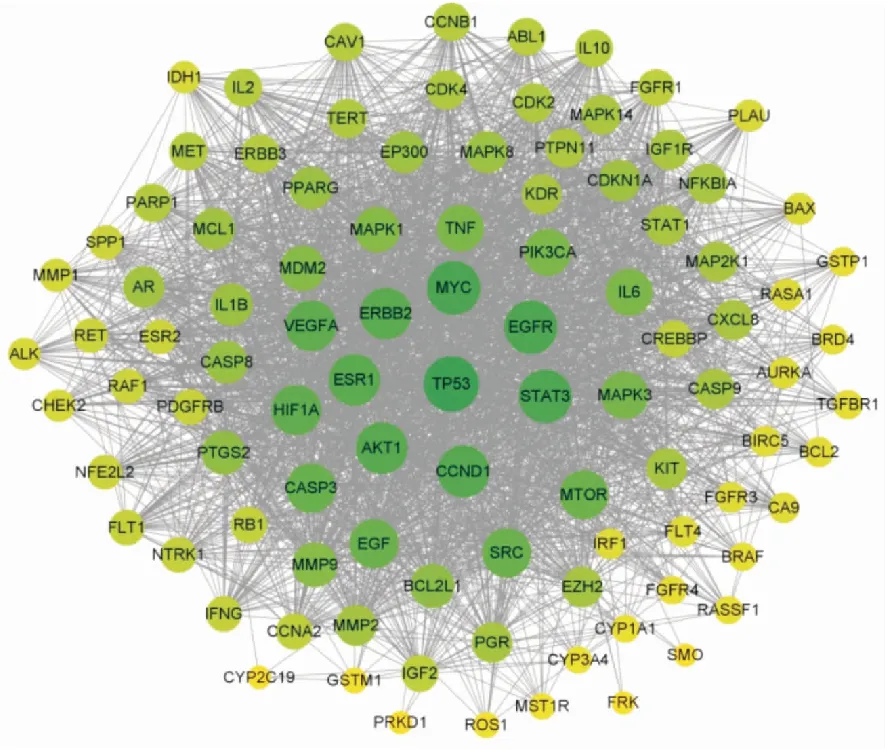
Fig 2 Network diagram of potential target
2.5 GO富集分析和KEGG通路富集分析通过DAVID进行GO富集分析共得到861个分析条目,其中生物过程有681条,细胞组成有59条,分子功能有121条。分析前20的GO条目发现,QZACP治疗PLC可能对信号转导、基因表达的正向调控、凋亡过程的负调控、细胞增殖的正调节、转录的正调控等生物过程密切相关;分子功能集中在ATP结合、酶结合、蛋白酪氨酸激酶活性、蛋白质结合等方面;细胞组分有胞核、胞质基质等(Fig 4)。KEGG富集分析筛选到162相关通路,主要与癌症通路、PI3K/Akt通路、MAPK通路、肿瘤中的微小RNA、人乳头瘤病毒感染等密切相关,见Fig 4。根据中药-成分-靶点图、PPI蛋白互作、KEGG通路富集结果,选择STAT3、EGFR、AKT1为接下来对接预测的关键蛋白。
2.6 分子对接Quercetin(槲皮素)、3,22-dihydroxy-11-oxo-delta(12)-oleanene-27-alpha-methoxycarbonyl-29-oic acid(甘草酸苷)、Denudatin B(白玉兰素B)与STAT3、EGFR、AKT1等关键蛋白进行了9次分子对接(Tab 3),结果显示关键靶点与成分化合物均有较好的结合能。Quercetin是健脾药物共有的活性成分,STAT3与Quercetin的结合能力较强。3,22-dihydroxy-11-oxo-delta(12)-oleanene-27-alpha-methoxycarbonyl-29-oic acid(甘草酸苷)与STAT3、EGFR、AKT等靶点均有较好的结合能力及稳定性。通过Pymol软件将分子对接结果进行优化如Fig 5可知Quercetin与STAT3中的LYS-344、GLU-331、THR-341这3个氨基酸有较强的氢键作用。3,22-dihydroxy-11-oxo-delta(12)-oleanene-27-alpha-methoxycarbonyl-29-oic acid与AKT1中的GLN-113、TRP-80、SER-56这3个氨基酸有较强的氢键作用。说明槲皮素与甘草酸苷对QZACP药效发挥作用有重要影响,为研究QZACP对PLC的作用机制提供了理论参考。
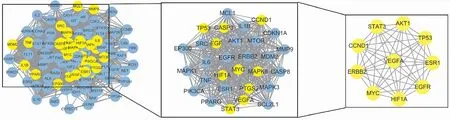
Fig 3 Core gene screening
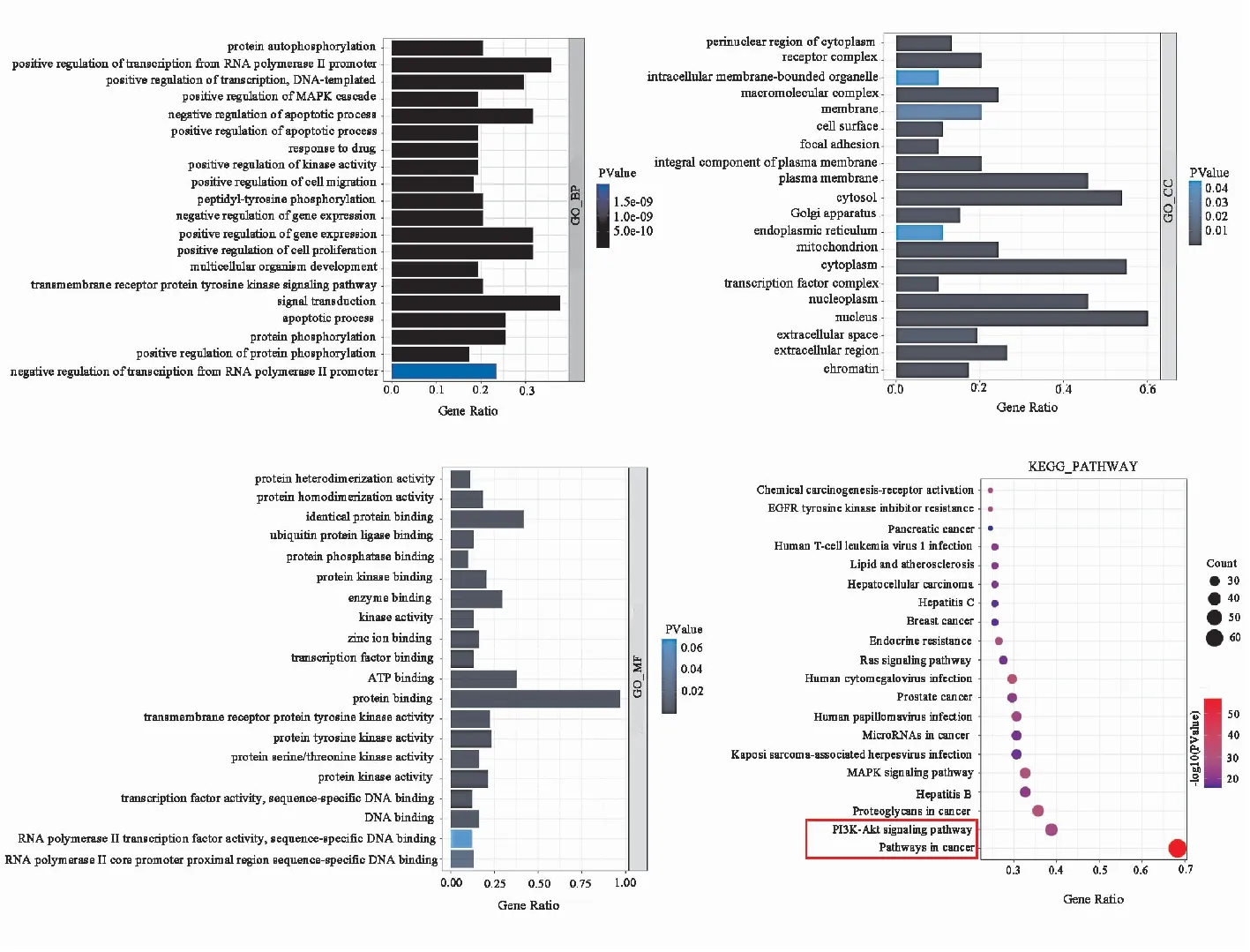
Fig 4 Visual analysis diagram of biological process,cell composition,molecular function and KEGG
2.7 动物实验经20 d治疗后,模型组、QZACP组肿瘤质量分别为(1.16±0.19) g、(0.57±0.07) g,与模型组相比,QZACP组肿瘤质量明显降低(P<0.01)(Fig 6A)。模型组、QZACP组肿瘤体积分别为(1.2±0.4) cm3、(0.3±0.1) cm3,与模型组对比,QZACP组肿瘤体积明显减小(P<0.05)(Fig 6B、C)。此外,经QZACP处理后,与模型组相比,原位移植瘤中的STAT3、EGFR、AKT1等蛋白的表达均明显降低(Fig 6D)。HE染色后显微镜下可见原位移植瘤的面积也随QZACP剂量增加逐渐减少 (Fig 6E),QZACP组肿瘤细胞减少,细胞形态较为完整(红色箭头处);模型组肿瘤细胞较多,细胞核明显增大,核仁明显,肝板排列紊乱,血管较多(红色箭头处)。

Fig 5 Molecular docking diagram
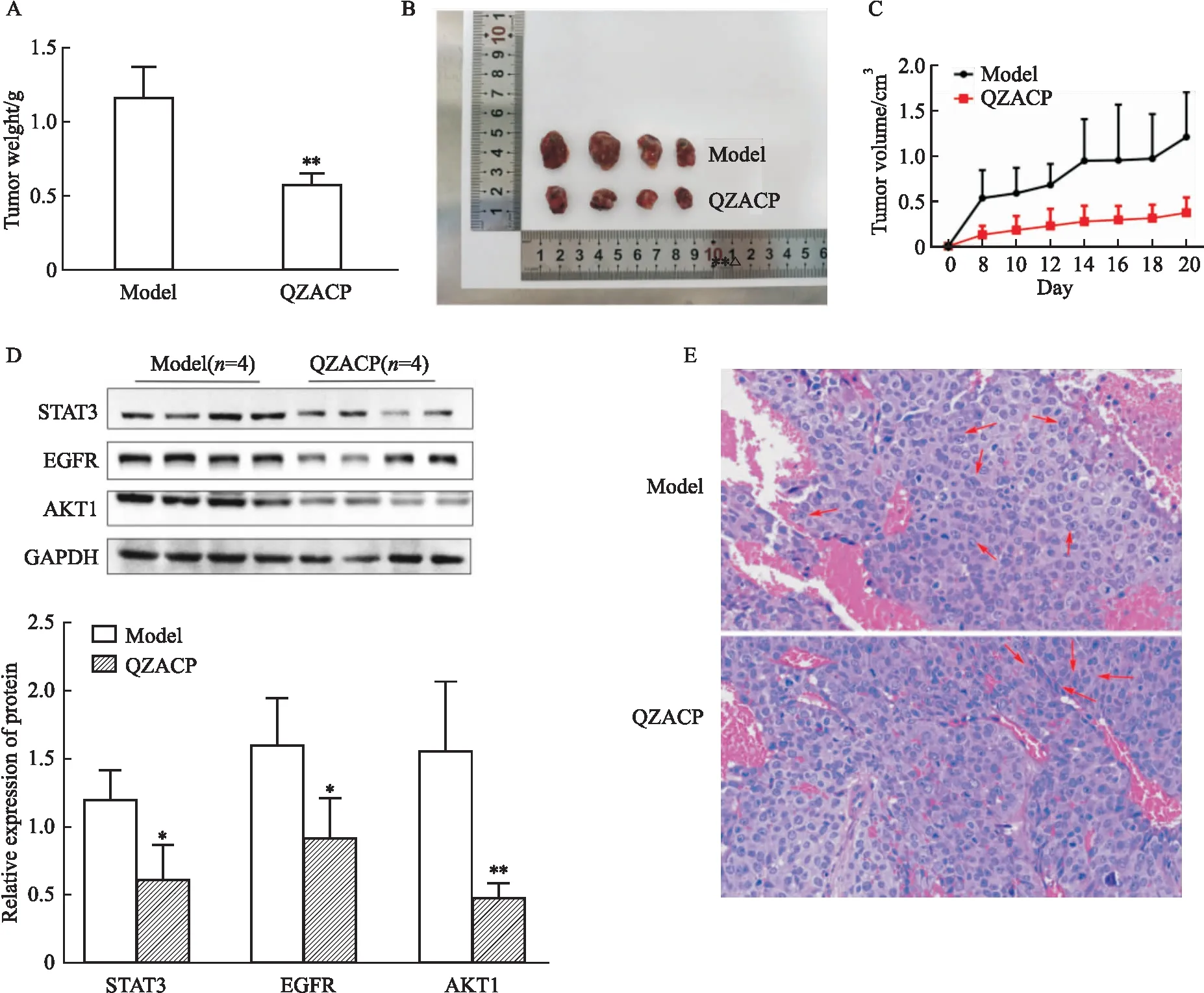
Fig 6 In vivo test
3 讨论
本课题组成员在前期研究中多角度阐述了QZACP对PLC的调控。通过回顾性研究发现,中药QZACP联合TACE较单纯TACE可以提高BCLC B期和C期HCC患者的KPS评分,提高1年、3年、5年的生存率,表明QZACP联合TACE可提高BCLC B期和C期HCC患者的生活质量,并延长其存活时间[5]。实验研究发现,QZACP通过调控肝癌上皮间质化来延缓肝癌进展[6]。
本研究通过分析发现,槲皮素、甘草酸苷、白玉兰素B可能是QZACP治疗PLC的关键成分化合物。其中在黄芪、白花蛇舌草、柴胡、炙甘草等中均含有槲皮素,该活性成分在该方中含量较高,结合关键靶点较多,抗癌作用较为明显(Tab 2)。槲皮素可以促进乳腺癌细胞发生凋亡[9]。此外,郑岩松等[10]发现,槲皮素能够通过降低SMMC-7721细胞迁移及侵袭活性,增加E-cadherin表达,降低N-cadherin和Vimentin蛋白,阻止或缓解肝癌细胞发生上皮间质转化。甘草酸苷可以特异性地与半聚体PGRMC1结合,抑制了PGRMC1和EGFR之间的相互作用,从而抑制了癌症进展所需的EGFR介导的信号传导,另外其可以明显增强了EGFR抑制剂厄洛替尼或顺铂(CDDP)诱导的人结肠癌HCT116细胞的死亡[11]。PAF是一种血小板活化因子,可以明显增强了乳腺癌细胞迁移和乳腺癌介导的破骨细胞的生成,白玉兰素可以作为天然PAF拮抗剂可通过部分阻断PAF/PTAFR信号通路而有效减弱乳腺癌的进展[12]。白玉兰素B是白玉兰素的异构体,但目前在肿瘤方面的研究仍然有限。该方治疗PLC的关键靶点有STAT3、EGFR、AKT1等,在癌症中EGFR常见的下游信号转导通路为PI3K/Akt、MAPK信号通路[13],而AKT为PI3K/Akt信号通路的核心。AKT又称为蛋白激酶B(PKB),是在如葡萄糖代谢、凋亡、细胞增殖转录及细胞迁移等多种细胞过程中起到重要作用的一种丝氨酸/苏氨酸特异性蛋白激酶,有研究表明AKT通路是IL-8诱导癌细胞迁移、侵袭和转移的主要下游信号通路[14],Sun等[15]研究发现,敲除IL-8 降低了整合素β3、p-PI3K和p-Akt的水平,减弱了肝细胞癌细胞侵袭力。转录激活因子(STAT3)是调节抗肿瘤免疫反应的核心,NF-κB信号传导是炎症引起的致癌和抗肿瘤免疫的重要信号通路,而STAT3与NF-κB之间的相互作用促进了肿瘤进展[16]。

Tab 3 Docking and binding of compounds in QZACP with target
通过KEGG富集分析发现,PI3K/Akt是芪术PI3K/Akt信号通路图谱抗癌方治疗PLC可能的关键通路(Tab 4,Fig 7)。Zhao等[17]研究表明,FGFR3与表皮生长因子受体(EGFR)共表达,FGFR3 通过促进 EGFR 磷酸化来激活PI3K/Akt信号的传导,以促进卵巢癌的顺铂耐药性。Ma等[18]发现,CD73产生的腺苷与腺苷A2A受体(A2AR)结合并激活Rap1,后者可以将P110β招募到质膜并触发PIP3的产生,从而激活PI3K/Akt信号通路,以促进肝细胞癌的上皮-间质转化、转移及进展。这提示了调控PI3K/Akt信号通路可能是抑制PLC侵袭扩散的缘由所在。总之,PI3K/Akt信号通路可能是QZACP治疗PLC的关键。
分子对接结果显示,QZACP的关键化合物与STAT3、EGFR、AKT1等蛋白靶点匹配良好,并通过了动物实验进行了进一步探索,初步证明了QZACP的药效机制。根据PPI蛋白互作及KEGG通路富集结果,PI3K/Akt通路可通过介导STAT3、EGFR等上游因素来影响肝癌的生物学功能。但是槲皮素、甘草酸苷等活性成分单体通过PI3K/AKt信号通过对肝癌影响的研究目前尚有限,下一步研究中可进一步验证槲皮素、甘草酸苷等通过PI3K/AKt信号通路来影响肝癌的发生发展。

Fig 7 Map of PI3K/Akt signaling pathway
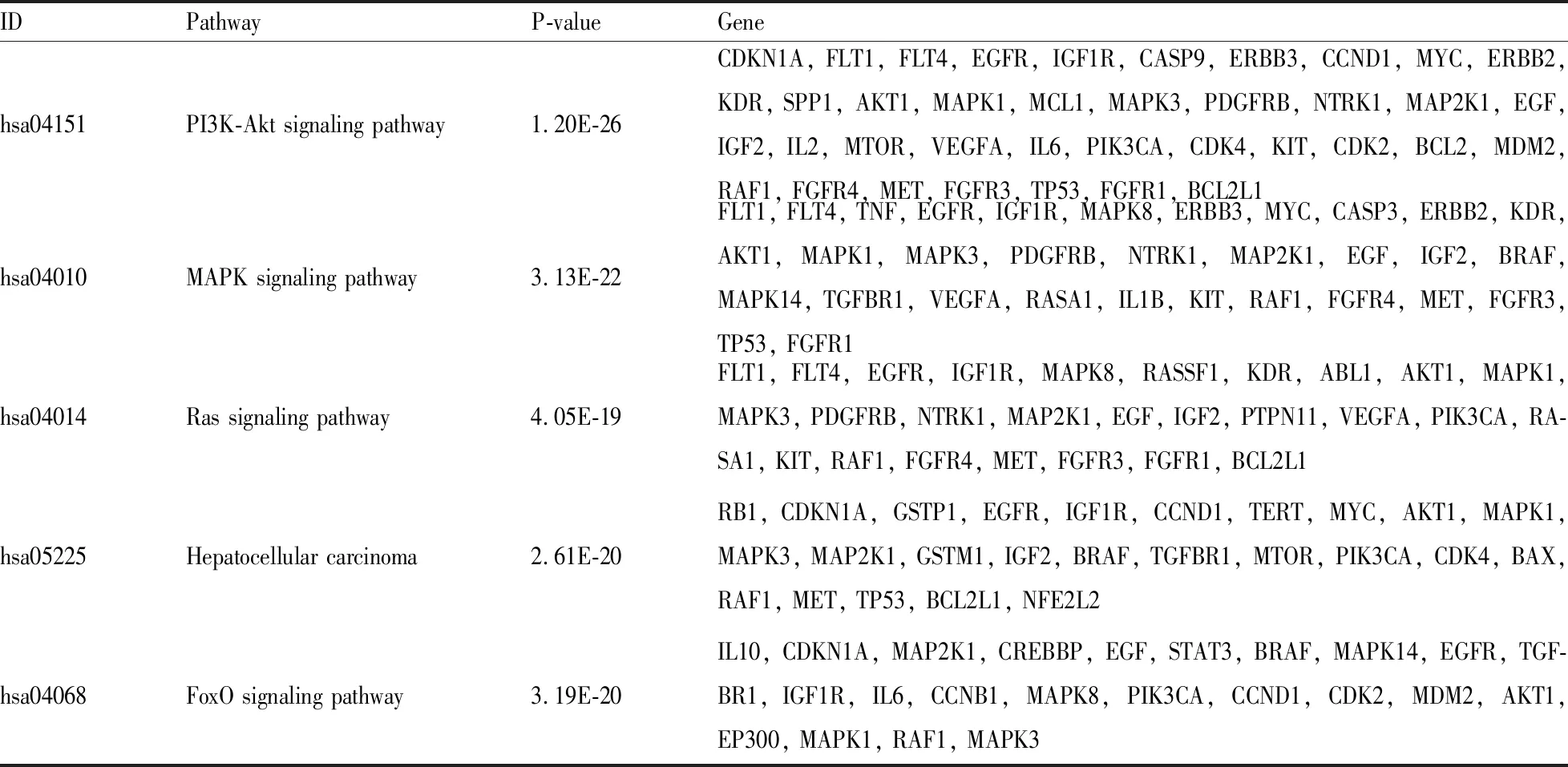
Tab 4 Signaling pathway of QZACP in treating PLC
综上所述,QZACP治疗PLC以“扶正抗癌”为基本治疗原则,具有益气活血等作用,具体的药效机制可能与PI3K/Akt信号通路有关。随着现代化科技进步,网络药理学通过各大平台数据库、生物信息学预测等对中药复方进行现代化阐述,为后续团队实验验证提供了方向,并具有较好的创新性。中药及活性单体多靶点、多途径的优势对于临床诊疗具有一定的意义,但其具体机制有待团队进一步验证与挖掘。
