化学遗传学调控高血压大鼠室旁核促肾上腺皮质激素释放因子神经元对前交感神经元兴奋性的影响
2023-12-12马宏宇郭鑫淇杜梓硕王浩然马会杰
马宏宇,郭鑫淇,张 荧,高 璐,杜梓硕,王浩然,马会杰
(河北医科大学基础医学院生理学教研室,河北 石家庄 050017)
根据“十二五”期间高血压抽样调查数据,中国成年人(18岁以上)高血压(收缩压≥140 mmHg/舒张压≥90 mmHg,1 mmHg=0.133 kPa,或者服用高血压治疗药物超过2周)患病率约为23.2%,即我国约有2.45亿高血压患者[1]。高血压作为一种常见的心血管疾病,不仅患病率高,还会引起严重的心、脑、肾等并发症,是脑卒中、冠心病等心血管疾病的主要危险因素。下丘脑室旁核(paraventricular nucleus, PVN)作为调节神经内分泌功能和心血管交感紧张性的关键脑区[2],含有加压素能和催产素能大细胞、神经内分泌性小细胞以及调节交感神经活动的前交感神经元[3]。既往研究表明,PVN投射于延髓头端腹外侧区(rostral ventrolateral medulla, RVLM)和脊髓中间外侧柱(intermediolateral column, IML)的前交感神经元,在调节交感传出活动和血压水平中起重要作用[4]。高血压发生时PVN前交感神经元过度兴奋,然而其过度兴奋的原因仍未知。相关研究显示,自发性高血压大鼠(spontaneously hypertensive rat, SHR)PVN促肾上腺皮质激素释放因子(corticotropin-releasing factor, CRF)神经元数量和CRF mRNA水平明显升高[5],然而CRF神经元过度兴奋对前交感神经元兴奋性的影响尚不清楚。
化学遗传学主要是通过对G蛋白偶联受体(G protein coupled receptor, GPCR)进行改造,使其成为只能被外源性配体特异性激活的受体,即只由设计性药物激活的设计性受体(designer receptors exclusively activated by designer drugs, DREADDs)[6]。目前大量研究证明,以DREADDs为基础的化学遗传学可用于操控各类神经元的兴奋性,如谷氨酸能神经元、γ氨基丁酸(γ-aminobutyric acid, GABA)能神经元和多巴胺能神经元[7]。在此基础上,配合CRF神经元启动子特异性腺相关病毒可将上述DREADDs序列引入CRF神经元特异性区域并大量表达。典型的DREADDs有Gq、Gi、Gs、Golf和β-arrestin,化合物叠氮平-N-氧化物(clozapine-N-oxide, CNO)作为配体能够激活上述受体,进而触发不同的GPCR级联反应[8]。其中应用最广泛的是Gq受体偶联的人M3毒蕈碱型DREADD(hM3Dq)和Gi受体偶联的人M4毒蕈碱型DREADD(hM4Di)两种。CNO作为配体与hM3Dq结合后,可通过磷脂酶C(phospholipase C, PLC)系统相关通路引起神经元兴奋效应;与hM4Di结合后,可通过腺苷酸环化酶(adenylate cyclase, AC)系统相关通路引起神经元抑制效应。
本研究旨在观察室旁核CRF蛋白表达水平以及CRF神经元数量,应用化学遗传学技术调控大鼠PVN CRF神经元兴奋性,使用全细胞膜片钳技术观察对PVN前交感神经元兴奋性的影响,验证高血压时CRF神经元通过神经微环路对前交感神经元的调控作用。
1 材料与方法
1.1 动物SPF级正常血压Wistar Kyoto大鼠和SHR大鼠购自北京维通利华实验动物技术有限公司,体质量260 g~280 g,动物许可证号:SCXK(京)2016-0006。动物分笼饲养,自由饮食饮水,环境温度18 ℃~24 ℃,相对湿度45%~55%,每天光照时间12 h,所有实验均经河北医科大学实验动物使用伦理委员会审核批准。实验过程中所有的动物均按照动物伦理学要求处置。
1.2 主要试剂CRF抗体购自中国武汉爱博泰克公司,β-actin抗体购自中国武汉Proteintech公司,CyTM3结合的羊抗兔抗体购自美国Jackson ImmunoResearch,化学遗传学腺相关病毒AAV(PHP.eB)-hsyn-DIO-hM3D(Gq)-eGFP和AAV(PHP.eB)-hsyn-DIO-hM4D(Gi)-mCherry购自上海吉凯基因技术有限公司;CRF神经元启动子特异性腺相关病毒AAV1/2-Rat CRF promoter-Cre购自Genedetect;荧光示踪剂FluoSpheres购自Invitrogen,DiI购自Sigma;其他生化试剂均为进口分装或国产分析纯。
1.3 蛋白印迹实验检测PVN CRF表达使用2%~3%的异氟烷麻醉WKY和SHR大鼠,断头取出脑组织,切除小脑、脑干以及前1/3端脑,剩余部分以及脑干部分迅速放入低温(0~4 ℃)的0.9%生理盐水中,使用振动切片机(VT1000S, Leica, Germany)切取包含PVN脑区的冠状面脑片(600 μm),随即根据图谱位置取PVN放入冻存管中,在液氮中快速冷冻。提取各组样本总蛋白,每组上样量为20 μg,经10% SDS-PAGE凝胶电泳后电转移至PVDF膜。5%脱脂奶粉室温封闭2 h,加入兔抗CRF抗体(1 ∶1 000),室温孵育3 h。TBST洗膜后加羊抗兔IgG(1 ∶5 000),室温孵育1 h,TBST洗膜,滴加 ECL发光剂,于 ChemiScope S6成像系统中显影,并对条带进行定量分析。以目的条带和β-actin条带灰度值比值作为最终结果。
1.4 免疫荧光实验腹腔注射20%的乌拉坦(800 mg·kg-1)麻醉大鼠,依次灌注肝素生理盐水与4%多聚甲醛-PBS溶液,灌注结束后断头取出脑组织,在4%多聚甲醛-PBS溶液中固定1 h。将脑组织放入30%蔗糖-PBS溶液中浸泡脱水24~48 h,加入包埋剂OCT包埋脑组织,根据脑图谱调整切片的角度,冠状面切取脑组织切片,切片厚度为25 μm。使用5%牛血清白蛋白室温封闭1 h,洗去封闭液,加入一抗CRF(1 ∶100),4 ℃孵育过夜。PBS漂洗后加CyTM3结合的羊抗兔IgG(1 ∶500),室温孵育2 h。使用共聚焦显微镜观察脑片的荧光染色情况,在PVN脑区位置摄取荧光图像(FV31S, Olympus, Japan),获取的荧光图像使用ImageJ软件统计荧光细胞数量进行分析。
1.5 化学遗传学病毒注射使用2%~3%的异氟烷麻醉WKY和SHR大鼠,并将大鼠头部固定于脑立体定位仪。用微精密钻头打磨前囟后方颅骨,参照图谱使用Nanoject II将化学遗传学病毒微量注入双侧PVN(前囟后1.8 mm,旁开0.5 mm,深度7.8 mm),每侧50 nL,注射完成后留针3~5 min。我们将两种不同的病毒pAAV-hsyn-DIO-hM3D(Gq)-eGFP和AAV1/2-Rat CRF promoter-Cre微量注射入WKY大鼠的PVN脑区。同样,将pAAV-hsyn-DIO-hM4D(Gi)-mCherry和AAV1/2-Rat CRF promoter-Cre微量注射入SHR的PVN脑区。术后2~3周,两种病毒同时表达扩增,通过Cre重组酶的作用在WKY大鼠室旁核CRF神经元上表达兴奋性hM3Dq-eGFP,SHR大鼠室旁核CRF神经元上表达抑制性hM4Di-mCherry。
1.6 PVN-IML投射神经元的逆行示踪标记使用2%~3%异氟烷麻醉表达兴奋性hM3Dq-eGFP的WKY大鼠和表达抑制性hM4Di-mCherry的SHR大鼠,并暴露其T1-T4脊髓节段。将荧光示踪剂(FluoSpheres fluorescent microsphere suspension, #F8795, Invitrogen, or DiI, #468495, Sigma, USA)微量注入脊髓IML,每侧3个注射位点,每次注射100 nL,注射完成后缝合伤口,待大鼠苏醒后放回原笼喂养,5~7 d后荧光示踪剂会被注射部位的神经轴突末梢逆行运输到向脊髓IML投射的PVN前交感神经元胞体。
1.7 脑片的制备使用2%~3%的异氟烷麻醉WKY和SHR大鼠,断头取脑组织,迅速将脑组织置于冰冷的人工脑脊液(artificial cerebral spinal fluid, aCSF)中。aCSF成分如下(单位:mmol·L-1):126.0 NaCl;3.0 KCl;1.2 NaH2PO4;11.0 Glucose;26.0 NaHCO3;1.5 MgCl2;2.4 CaCl2。使用振动切片机制备厚300 μm的包含PVN脑区的冠状面脑片,脑片于人工脑脊液中34 ℃恒温孵育1 h,然后移至记录槽中进行电生理记录。
1.8 脑片膜片钳电生理学记录全细胞膜片钳所用的玻璃微电极尖端阻抗为3~6 MΩ,记录电极内电极内液的组分(单位:mmol·L-1)140 K-gluconate,2 KCl,3 MgCl2,10 HEPES, 5 Phosphocreatine,2 K-ATP,0.2 Na-GTP,用KOH调整pH值为7.4,渗透压为290~300 mOsmol·L-1,制备好的脑片标本以恒温恒速(34 ℃,3 mL·min-1)持续灌流。在正置显微镜(OlympusBX51WI)下,准确定位第三脑室双侧具有荧光标记的PVN前交感神经元,经过全细胞电压钳记录,保持电位为-60 mV,用人工脑脊液持续灌流,记录自发兴奋性突触后电流(spontaneous excitatory postsynaptic currents,sEPSCs),稳定记录9 min后,灌流液中加入CNO (10 μmol·L-1) 灌流6 min,然后冲洗恢复至基础状态。全细胞电流钳记录PVN前交感神经元的膜电位和电流诱发的动作电位,通过记录电极给予系列跃阶电流(0 pA-200 pA,增幅20 pA,时程500 ms)刺激,记录在每个跃阶电流细胞膜电位和动作电位的变化,待波形稳定后,灌流液中加入CNO (10 μmol·L-1) 灌流6 min,然后冲洗恢复至基础状态。

2 结果
2.1 SHR室旁核CRF蛋白表达水平升高相比于WKY大鼠,SHR室旁核CRF蛋白表达水平明显升高(P<0.01, Fig 1A,B),说明高血压时PVN CRF神经元合成CRF增多。

Fig 1 The protein expression level of CRF was
2.2 SHR PVN CRF阳性神经元和脊髓投射的PVN前交感神经元数量增加通过免疫荧光实验,我们观察到相比于WKY大鼠,SHR室旁核的CRF神经元数量明显增加 (P<0.05, Fig 2A,B)。同时,SHR向脊髓投射的荧光标记的PVN前交感神经元数量增多,且分布于CRF阳性神经元周围 (P<0.05, Fig 2A,C)。
2.3 PVN CRF神经元化学遗传学DREADDs的表达及PVN前交感神经元逆行投射荧光示踪剂的标记预先将CRF启动子特异性Cre依赖的AAV与化学遗传学AAV混合微量注入大鼠PVN,14 d后,通过将荧光示踪剂注射到IML,逆行示踪PVN前交感神经元。最后在WKY大鼠PVN可见表达hM3Dq-eGFP的CRF神经元(绿色)以及含有DiI的前交感神经元(红色)(Fig 3A,B,D)。同样,在SHR大鼠PVN可见表达hM4Di-mCherry的CRF神经元(红色)以及含有FluoroSpheres的前交感神经元(绿色)(Fig 3A,C,E)。

Fig 2 Numbers of CRF-expressing neurons and presympathetic neurons increased in PVN of

Fig 3 PVN CRF neurons expressed with chemogenetic DREADDs and PVN presympathetic neurons retrogradely labeled with fluorescent tracer in WKY rats and SHR
2.4 CNO抑制SHR大鼠PVN CRF神经元可降低前交感神经元sEPSCs的频率应用全细胞电压钳记录大鼠脑片PVN前交感神经元的sEPSCs,观察灌流液中给予CNO作用于抑制性hM4Di对sEPSCs的影响。与WKY大鼠相比,SHR大鼠PVN前交感神经元sEPSCs的频率更高(P<0.01, Fig 4A-C),但幅度并无明显差异。在PVN CRF神经元提前表达hM4Di-mCherry的SHR大鼠脑片,用含CNO(10 μmol·L-1)的人工脑脊液灌流脑片可引起PVN前交感神经元sEPSCs频率明显降低(P<0.01, Fig 4B,C),但不影响其幅度(Fig 4B,D)。
然而,对于在PVN CRF神经元提前表达hM3Dq-eGFP的WKY大鼠脑片,用含CNO的人工脑脊液灌流脑片对PVN前交感神经元sEPSCs的频率和幅度均无明显影响(Fig 4A, C,D)。以上数据表明,SHR大鼠PVN前交感神经元过度激活,通过化学遗传学技术抑制CRF神经元兴奋性能够有效抑制SHR大鼠PVN前交感神经元的过度激活。
2.5 CNO调控PVN CRF神经元兴奋性对前交感神经元电流诱发的动作电位无影响应用全细胞电流钳记录WKY和SHR大鼠PVN前交感神经元电流诱发的动作电位 (Fig 5A)。与WKY大鼠相比,SHR大鼠PVN前交感神经元的膜电位更加去极化(P<0.01, Fig 5B-D)。同时,SHR大鼠PVN前交感神经元电流诱发动作电位的频率和放电数量也明显高于WKY大鼠(P<0.01, Fig 5B-F)。但是在PVN CRF神经元提前表达hM3Dq-eGFP的WKY大鼠或表达hM4Di-mCherry的SHR大鼠脑片,CNO(10 μmol·L-1)灌流给药对PVN前交感神经元电流诱发的动作电位均无明显影响(Fig 5B-F)。以上数据表明,通过化学遗传学技术调控CRF神经元兴奋性对WKY和SHR大鼠电流诱发的动作电位无明显影响。
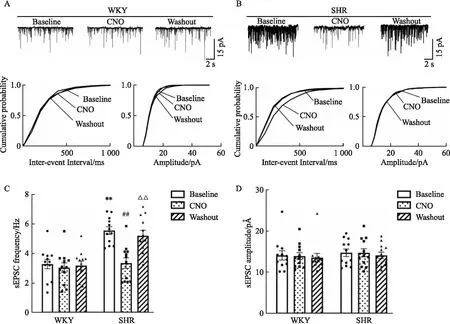
Fig 4 Effect of chemogenetic manipulation of CRF neurons on sEPSCs of presympathetic neurons in PVN in WKY rats and

Fig 5 Effect of chemogenetic manipulation of CRF neurons on current-evoked firing of PVN presympathetic neurons in WKY rats and
3 讨论
高血压发病率居高不下,患病人群更趋于年轻化,因此阐明高血压发生的潜在神经机制尤为迫切。既往研究表明,前交感神经元过度兴奋引起交感传出活动增强[9]是高血压发生的重要神经机制。我们的研究结果显示,SHR PVN前交感神经元sEPSCs频率以及电流诱发放电活动明显高于WKY,表明,PVN前交感神经元过度兴奋在高血压发生时起到重要作用。研究表明PVN作为调节神经内分泌功能和心血管交感紧张性的关键脑区[2],其CRF神经元数量和CRF mRNA水平在高血压患者[10]和SHR[5]中均明显升高。因此,我们推测SHR大鼠PVN前交感神经元兴奋性的变化与CRF神经元过度激活和内分泌活动增强密切相关。
存在于突触前囊泡中的兴奋性神经递质以量子级释放并作用于突触后膜相关受体,引发的突触后膜内向电流即为sEPSCs,反映的是由突触前兴奋性神经递质释放变化而引发的突触后神经元兴奋性变化。电流诱发动作电位是向神经元注入电流而诱发的动作电位,反映神经元的可兴奋性。我们通过化学遗传学技术抑制自发性高血压大鼠PVN CRF神经元,可有效降低前交感神经元sEPSCs的频率,但对电流诱发的动作电位无明显影响。因此,我们认为在高血压发生时CRF神经元兴奋性增强是前交感神经元过度兴奋的主要原因之一。但PVN CRF神经元激活对高血压大鼠PVN前交感神经元sEPSCs和电流诱发动作电位的反应性差异,有待于进一步研究。
此外,前交感神经元的过度激活与兴奋性谷氨酸能传入增强、抑制性GABA能传入减弱密切相关[11-12]。而这两类中间神经元上也有CRF受体(CRFR)分布,CRF作为脑内重要神经调质可调节其兴奋性[13]。PVN CRF神经元可通过释放CRF,作用于CRFR发挥神经内分泌功能[14-15]。两种类型的CRF受体,即CRFR1和CRFR2,均在PVN高表达,并与自主神经活动的调节密切相关[16]。高血压时室旁核内源性CRF增多,通过CRFR1增强谷氨酸能神经元的兴奋性,进而引起增强前交感神经元的兴奋性[5]。然而,抑制SHR大鼠CRF神经元改善前交感神经元过度兴奋后,是否可改善增强的交感传出活动与升高的血压,仍需进一步探究。
综上所述,自发性高血压大鼠PVN CRF神经元与前交感神经元之间存在神经微环路,PVN CRF神经元兴奋性增强是前交感神经元过度兴奋的重要原因之一,本研究为高血压的防治提供了实验依据。
