神经血管偶联与中枢神经系统疾病
2023-12-12杨鞠祥楚世峰贺文彬陈乃宏
杨鞠祥,张 钊,楚世峰,贺文彬,李 刚,陈乃宏,
(1. 内蒙古医科大学药学院,内蒙古 呼和浩特 010110;2. 中国医学科学院药物研究所,神经科学中心,天然药物活性物质与功能国家重点实验室,北京 100050;3. 山西中医药大学,中医脑病学山西省重点实验室,山西 太原 030024)
中枢神经系统疾病发病率高,仅次于心血管疾病,病程长且发病初期不易察觉,研究多集中于单一的减轻神经元损伤以及对症治疗,如营养脑细胞,消除炎症反应等,仅能延缓疾病进程。近年来研究表明中枢神经系统疾病的发生不仅是神经元单方面的病理改变,胶质细胞、脑血管等也扮演着极为重要的角色。神经血管偶联是为满足脑区活动时能量需求的急剧变化调节大脑局部血流量的机制,是脑血流调控的基础。神经血管偶联障碍引发多种中枢神经系统疾病,主要包括慢性脑血管病(chronic cerebrovascular disease,CCVD)、阿尔茨海默病(Alzheimer′s disease,AD)、帕金森病(Parkinson′s disease,PD)、路易体痴呆(dementia with Lewy bodies,DLB)等。以神经血管整体为治疗基础,改善神经血管偶联的治疗措施既能改善脑血流量,又起到预防疾病发生和神经保护的作用,且可以减少疾病并发症。因此,本文将就其最新研究进展进行综述,为基于神经血管偶联机制研发预防、缓解、治疗中枢神经系统疾病提供依据。
1 神经血管偶联机制
大脑仅占人体质量的2%左右,却消耗全身20%左右的能量。大脑与脑血管之间存在着密切的联系,几乎全部的能量底物、代谢废物和热量的转运都由脑血管完成。2002年美国卒中进展回顾小组会议上提出神经血管单元(neurovascular unit,NVU)的概念。NVU由神经元、小胶质细胞、星形胶质细胞、血管内皮细胞、血管周细胞、基底膜和细胞质基质组成,是大脑行使功能的结构基础。脑血流的功能调节对大脑健康至关重要,NVU沿血管树的结构具有多样性,脑血管从大脑底部的Willis环分支开来,在蛛网膜下腔的大脑表面运行,沿脑血管树的动脉血管结构可分为软脑膜小动脉、硬膜小动脉、穿透小动脉、实质内小动脉和毛细血管,几种类型的动脉血管在结构和功能上存在着较为明显的差异。NVU是神经血管偶联的结构基础,神经血管偶联机制至今尚无广为认可的结论,以下将对经典的神经血管偶联机制及最新研究成果进行介绍。
最早人们认为神经血管偶联的机制是突触释放谷氨酸,进而激活神经元N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体,Ca2+进入神经元并激活神经元一氧化氮合酶(nitric oxide synthase,nNOS),随后神经元释放NO,扩张血管,而不涉及星形胶质细胞和血管内皮细胞[1]。后继研究发现,NO虽是神经血管偶联必需的信使,其浓度的动态升高并不能直接介导神经元血管信号[2]。NVU的神经元-胶质细胞-血管结构提示星形胶质细胞可根据神经元的兴奋程度调节脑血流量(cerebral blood flow,CBF)。突触活动释放的谷氨酸激活星形胶质细胞上的谷氨酸受体,导致细胞内3-磷酸肌醇(inositol triphosphate,IP3)动员和Ca2+释放,细胞内磷脂酶-A2(phospholipase-A2,PLA2)激活,进而释放花生四烯酸,而前者的积聚导致其代谢产物前列腺素E2(prostaglandin E2,PGE2)和环氧二十碳三烯酸(epoxy eicosatrienoic acid,EET)的产生和积累,扩张附近的小动脉[3]。但Mishra等[4]研究发现星形胶质细胞内Ca2+浓度升高是通过三磷酸腺苷门控通道进入而非储存Ca2+的释放,且花生四烯酸的产生不是因为PLA2的激活而是磷脂酶-D2和二酰甘油激酶的激活。此外,星形胶质细胞接受刺激后,足部释放Ca2+信号,进而扩张小动脉。然而最新研究报道,脑皮质毛细血管扩张与星形胶质细胞钙信号无关[5],近年来还涌现出如下关于神经血管偶联的新见解(Fig 1)。

Fig 1 Various mechanisms for regulating neurovascular coupling
1.1 中枢神经系统小动脉内小窝介导神经血管偶联小动脉内皮细胞(arteriolar endothelial cells,aECs)、毛细血管内皮细胞(capillary muscle cells,cECs)及平滑肌细胞上都有小窝分布。小窝参与许多细胞过程,包括跨细胞物质转运,以及介导细胞内信号等。哈佛医学院Gu教授研究团队发现aECs上含有丰富的小窝,不同于毛细血管内皮细胞及平滑肌细胞。通过基因敲除小窝形成必需的小窝蛋白1(caveolin-1,CAV1)的基因Cav1可以清除小窝[6],导致神经血管偶联障碍。主要协同转运蛋白超家族结构域蛋白2a(major facilitator superfamily domain-containing protein 2a,Mfsd2a)是一种钠依赖性溶血磷脂酰胆碱同向转运体,负责将二十二碳六烯酸摄入大脑,对血脑屏障的形成起着至关重要的作用。研究发现cECs 和SMC中Mfsd2a大量表达,从而抑制小窝的形成,导致二者所含小窝数量稀少。通过aECs 条件敲除Cav1小鼠(BMX:CreER+;Cav1-/fl)确证了只有aECs上的小窝才能介导神经血管偶联。此外,研究表明,小窝介导的神经血管偶联不依赖于NO途径,可与NO途径共同调节脑血流量[7]。
1.2 脑毛细血管周细胞对神经血管偶联的影响SMC和周细胞(pericyte)统称血管壁细胞,为血管收缩的效应器。NVU沿脑血管树分布的结构中,较大的小动脉有2~3层壁细胞,末梢小动脉只有一层壁细胞。末梢小动脉穿透脑实质管腔逐渐变小的过程中,壁细胞逐渐变为周细胞样形态。周细胞是毛细血管、毛细血管前小动脉和毛细血管后静脉上的血管平滑肌细胞的代表。毛细血管壁细胞的形态和功能随穿透小动脉的分支顺序而改变:从包围穿透小动脉和毛细血管前括约肌的收缩周细胞,到毛细血管分支前细长的收缩鞘样周细胞,再到环绕毛细血管和小静脉的非收缩细丝状周细胞。周细胞内含有的收缩蛋白使周细胞能够对神经元刺激快速产生反应,是脑血流的主要调节工具。
脑毛细血管周细胞收缩血管和调节血流的功能是通过钙依赖途径和非钙依赖途径实现的[8]。钙依赖途径中,周细胞受到刺激,细胞内的Ca2+平均浓度从0.1 μmol·L-1升到1 μmol·L-1或更高。钙离子的来源主要由两部分组成:一部分为细胞膜去极化从胞外吸收进入细胞;另一部分为肌浆网释放的Ca2+。钙依赖途径中,胞内Ca2+浓度升高使钙-钙调蛋白结合,进而激活肌球蛋白轻链激酶,使肌球蛋白轻链磷酸化增加,其与肌动蛋白结合后导致血管收缩反应。非钙依赖途径中,肌球蛋白轻链磷酸酶使肌球蛋白轻链去磷酸化,从而阻止肌球蛋白与肌动蛋白的相互作用,抑制血管收缩,进而引起血管舒张反应。周细胞通过调节肌球蛋白轻链激酶和肌球蛋白轻链磷酸酶的活性来收缩和舒张脑微血管参与神经血管偶联功能。
1.3 周细胞隧道纳米管(tunnelingnanotubes,TNTs)调节神经血管偶联TNTs被描述为专门用于细胞间通信的“高速公路”。以往研究表明周细胞沿毛细血管能调节脑血流,但其是否在毛细血管网络中同步微血管动力学及神经血管偶联并未阐明。Alarcon-Martinez等[9]发现将两个独立毛细血管系统中的内皮细胞联系起来的纳米管样过程,形成了小鼠视网膜上的功能网络,并将其定义为周细胞隧道纳米管(interpericyte tunnelling nanotubes,IP-TNTs)。IP-TNTs被基底膜包裹,近端为与周细胞胞体相连的开放端,远端通过膜对膜的方式与远端周细胞相连,形成缝隙链接,两个周细胞通过基于缝隙链接蛋白43(recombinant connexin 43,Cx43)的缝隙链接进行通信。IP-TNTs可介导周细胞线粒体等细胞器的运输,作为胞内Ca2+波的传递通道,进而介导周细胞通讯。视网膜周细胞依赖IP-TNTs来控制局部神经血管耦合并协调相邻毛细血管之间的光诱发反应。敲除或缺血后的IP-TNT损伤破坏细胞间Ca2+波,损害血流调节和神经血管耦合。由IP-TNTs相连的毛细血管对刺激总是存在着同步反应,即一条收缩,一条扩张,导致一条毛细血管扩张的同时,由IP-TNTs相连的另外的一根毛细血管收缩。该观点本质是将脑血管中的血液进行重新分配,而不是像之前单纯的神经活动导致血管扩张,从而增加局部脑血流量。
1.4 毛细血管内皮细胞参与脑血管逆行性扩张Longden等[10]研究表明,毛细血管内皮细胞在感知神经活动并且将该信号以电信号传导到上游动脉血管的过程中起到重要的作用。这一信号是由细胞外神经活动的副产品K+启动的,它激活了毛细血管内皮细胞的内向整流K+(KIR2.1)通道,产生快速传播的逆行超极化,导致上游动脉血管扩张,增加进入毛细血管床的血流量。结合上文中提及的细胞纳米管介导的脑血管血流重新分配机制,我们推测神经血管偶联功能发生时毛细血管扩张所导致的血流量增加,可能是两种机制共存导致的。
1.5 神经元调节血管变化神经元释放的神经递质包含多种物质,目前已知的神经递质包括多巴胺、血管活性肠肽、5-羟色胺、γ-氨基丁酸和乙酰胆碱等都可以介导血管变化。以前研究只表明脑活性增加引起血管扩张,活性降低引起血管收缩,但无直接证据表明抑制细胞导致血管收缩。Uhlirova等[11]通过选择性激活兴奋性或抑制性神经元,观察激活神经元前后的血管细节变化,发现兴奋性神经元和抑制性神经元都可引起血管扩张,但只有能够释放神经肽Y(neuropeptide Y,NPY)的抑制性神经元能够诱导动脉血管收缩。
2 神经血管偶联研究方法
神经血管偶联的研究受限于技术手段。目前用于神经血管偶联的研究方法主要为以下几种(Tab 1)[7,12-15]。
2.1 经颅多普勒超声(transcranialDopplerultrasound,TCD)技术TCD技术在脑血管评估方面有着相当大的作用,该技术在研究脑血管方面易于操作、非入侵性、成本低廉,且具有很好的时间分辨率。TCD技术可检测静息、刺激和病理状态下的脑血流速度(cerebral blood flow velocity,CBFv)、脑自主调节、脑血管对CO的反应性和神经血管的耦合性等重要参数。在Yao等[12]的研究中提到,将TCD技术和视频脑电波(video-Electroencephalogram,vEEG)技术结合使用,二者收集的数据集成到一起,对评价人体的神经血管偶联功能有良好的时间相关性。
2.2 血氧水平依赖性(blood oxygen level dependent,BOLD)功能磁共振成像(functional magnetic resonance imaging,fMRI)BOLD fMRI是目前脑血管检测中应用最多的技术,通过中枢神经系统的血流、血量和血氧的变化反映脑血管功能,用于绘制脑功能图谱。结合电生理技术中的脑电图(electroencephalogram ,EEG)、脑磁图(magnetoencephalography,MEG),联合经颅磁刺激(transcranial magnetic stimulation,TMS),可用来评价神经血管偶联功能水平。但当CBF因为某些因素如衰老和疾病改变时,该技术对BOLD的信号解析就会存在着一定的误差,Kelly等[14]研究提出团注跟踪ASL(bolus-tracking ASL,btASL)fMRI法,与传统的BOLD法相比,btASL能产生伴随神经元激活的功能性充血的生理学相关指数。虽然传统上fMRI主要用于研究任务诱导的大脑功能变化,但不断发展的采集方法和对信号机制的了解提高了这种方法在研究药物刺激反应方面的实用性,衍生出药理学磁共振成像(pharmacological magnetic resonance imaging,phMRI)技术。
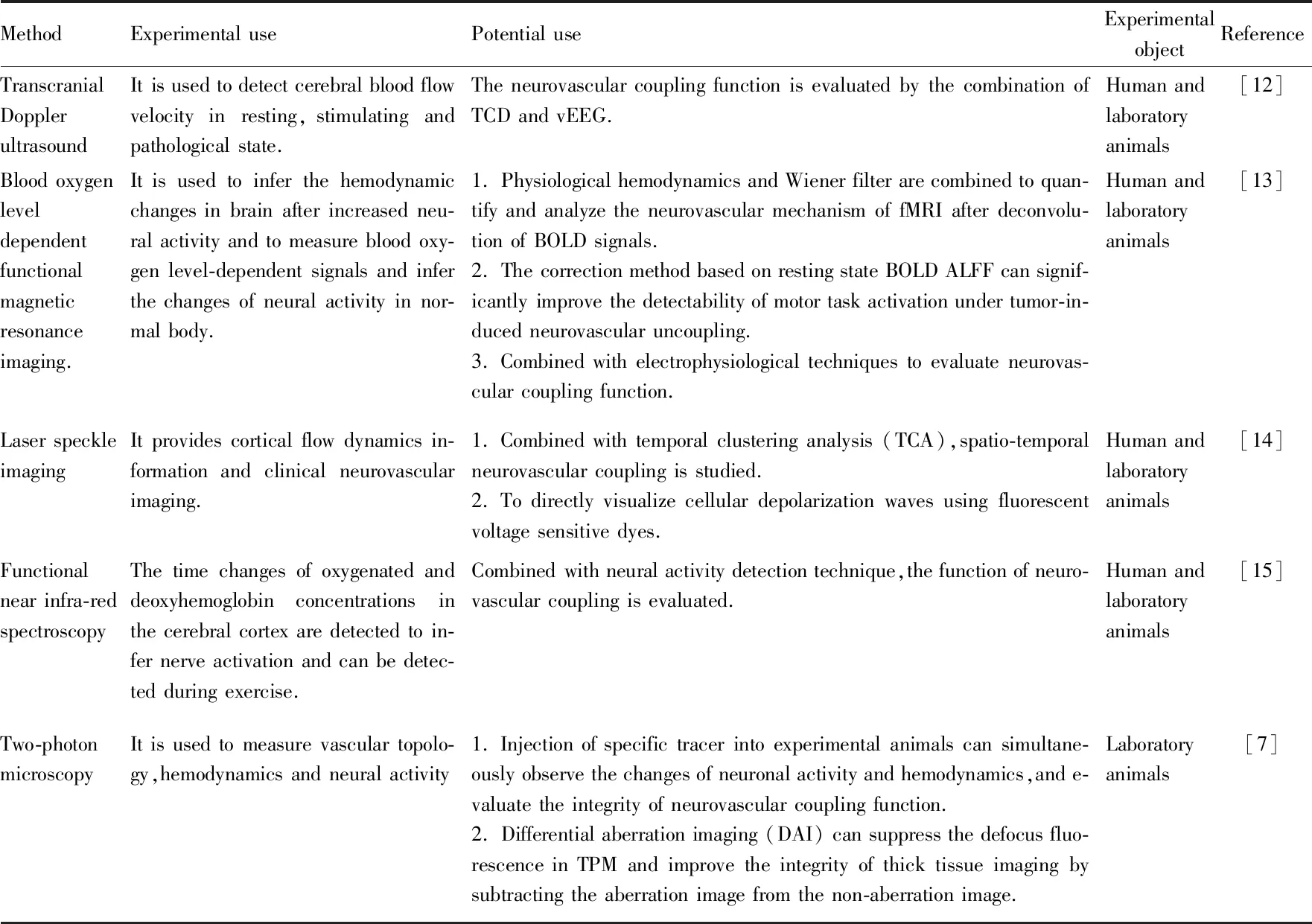
Tab 1 Neurovascular coupling assay technology
2.3 激光散斑成像结合时间聚类分析激光散斑成像(laser speckle imaging,LSI)结合时间聚类分析(temporal clustering analysis,TCA)LSI TCA是一种具有高分辨率的成像方法,能够用于研究正常状态和各种病理状态下的时空神经血管偶联。Li等[15]采用激光散斑成像结合时间聚类分析的方法探究了温度刺激引起神经元激活的CBF变化,得出了不同温度对神经血管偶联功能的影响。
2.4 功能性近红外光谱(functional near infra-red spectroscopy,fNIRS)fNIRS是一种新兴的光学成像方法,其主要是通过放置在受试者头部表面的一对发射器和探测器之间的近红外光衰减来测量血流动力学。脑组织中特异的几种血红蛋白相较于其他物质能够明显地吸收近红外光,使探测器接收到的近红外光强度出现差异,从而根据得到的信息分析血流的变化。该技术最显著的优点是能够对运动的动物或人体进行检测,缺点是易受颅脑以外因素,如血压和心率等的影响[16]。
2.5 膜片钳(patch clamp)技术膜片钳技术是研究电生理的实验方法。纳米化膜片钳技术不仅可以评估单个可兴奋性细胞的表型,还使该技术能够应用于神经血管细胞之间的通讯评估,对于研究神经元之间、神经元与血管之间的偶联有重要的意义。但该技术需要专业人员进行长期和复杂的操作,随着技术的改良有望简化实验操作,缩短实验进程[17]。
2.6 双光子显微镜(two-photon microscopy,2PM)技术2PM出现前由于没有合适的体内研究方法,研究者对NVC及血流的调控认知非常有限。2PM出现后可在活细胞水平上研究脑的微观现象。有研究者利用神经元中表达钙传感器GCaMP6s 的小鼠(Thy1-GCaMP6s),尾静脉注射血管标记物,刺激小鼠胡须后通过活体双光子显微镜观测小鼠大脑皮层桶状皮质区域产生的神经活动与血流改变情况,直观地展现了神经元与血管之间的偶联关系[7]。Gonzales等[18]研究者通过在体双光子技术提供了毛细血管连接处的收缩周细胞能够直接控制血流方向的直接证据。
3 中枢神经系统疾病与神经血管偶联障碍
神经血管偶联在大脑的血流量和能量供应调节方面起重要作用,偶联障碍引起大脑病理反应。AD、PD、慢性脑缺血等许多中枢神经系统疾病的发生发展均与神经血管偶联障碍有关。
3.1 ADAD为慢性进行性中枢神经系统变性病,是痴呆的最常见病因,呈现进行性和不可逆性的认知功能退化,早发现早干预具有重要的治疗意义。β-淀粉样蛋白(amyloid β-protein,Aβ)沉积和tau蛋白异常磷酸化是AD的主要病因,但是有研究表明,在Aβ沉积和tau蛋白异常磷酸化之前就存在血管功能障碍和脑血流量减少,AD患者初期,大脑静息状态下的脑血流量会明显减少并促进脑血管收缩,神经血管偶联反应减弱,从而导致大脑低灌注,会直接导致记忆相关神经元死亡,从而诱导产生和加重AD病情发展[19]。此外,神经血管单元与血脑屏障密切相关,控制物质进出大脑是二者的主要功能之一。在AD发病之前,神经毒性物质β-淀粉样蛋白在大脑中过度积累也与二者的功能障碍有着不可分割的联系,不仅影响β-淀粉样蛋白的清除速率,还会减少维持大脑功能的Na+、K+,导致大脑pH、电解质失衡,从而增加大脑中β-淀粉样蛋白的产生,进而导致β-淀粉样蛋白水平的升高。
3.2 PDPD也是一种常见于老年患者的神经退行性疾病,表现为震颤、步态僵硬和运动障碍,严重影响正常生活。其主要病理特征为选择性和渐进性多巴胺能神经元退变、丢失和路易体沉积。目前已证明PD早期症状与神经血管偶联障碍相关,PD病程中大脑多区域血流灌注减少,如辅助运动区、顶叶皮质、楔前叶和楔部以及额叶皮质等部位。Shang等[20]研究发现,PD患者的神经血管偶联功能障碍存在区域特异性,主要集中在影响认知功能的视觉-空间皮质,与PD的非运动症状相符。PD患者大脑中神经血管偶联的神经支配和毛细血管均受到损伤。PD病程中神经血管偶联功能障碍可能与衰老所致的神经血管单元损伤有关,加速PD的病理进程。
3.3 慢性脑缺血慢性脑缺血是由于大脑长期低灌注导致的大脑慢性损伤性疾病,主要表现为失眠、记忆力减退、逆行性遗忘、认知功能障碍等,随着病情发展,极易引发脑梗死和痴呆等严重损伤,在血管性痴呆、Bins wanger病、AD等诸多神经系统疾病的发生发展过程中起着重要作用。长期低灌注引起的慢性脑缺血导致神经血管偶联功能障碍。低效的神经血管偶联剥夺了神经元的必需营养供应,并导致神经元功能衰竭,进而加重记忆力减退、认知功能障碍、反应迟钝等慢性脑缺血导致的体征。Alfieri等[21]发现,烟酰胺腺嘌呤二核苷酸磷酸氧化酶2在大脑缺血或者低灌注时能够诱导活性氧(reactive oxygen species,ROS)产生,导致CBF失调和脑微血管炎症,最终可能导致记忆障碍。Kim等[22]研究表明,脊髓损伤后的长期CBF降低是导致脑血管损伤的最主要原因,甚至超过了脊髓损伤后急性增加的代谢需求对脑血管的损伤,是导致神经血管偶联障碍和后续认知功能障碍的最大危险因素。在慢性脑缺血过程中,中枢神经系统的细胞长期处于缺氧状态,大脑中的软脑膜小动脉和穿透小动脉静息状态的平均直径会较正常生理状态下明显增加[23]。长期的缺氧状态使NO、腺苷和前列腺素等诱导血管扩张的物质释放减少,导致软脑膜动脉和穿透小动脉受到刺激时的舒张能力显著衰减,诱发明显的神经血管偶联功能障碍。
4 目前改善神经血管偶联功能的活性物质及方法
针对神经血管偶联障碍的药物研发仍处于探索阶段。目前表现出改善神经血管偶联功能障碍的药物多是通过增加中枢神经系统内NO的产生实现的。有研究表明,烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)浓度下降会对细胞产生不利影响,恢复NAD浓度可能对衰老过程中的神经血管偶联功能障碍产生有利影响,烟酰胺单核苷酸是NAD的前体能够恢复内皮细胞NO浓度,从而改善神经血管偶联功能障碍。精氨酸及其前体瓜氨酸作为NOS作用的底物,也可以通过增加NO浓度的方式改善神经血管偶联功能。
氧化应激增加脑微血管内皮细胞功能障碍,进而损害神经血管偶联功能。线粒体靶向抗氧化肽SS-31通过减轻线粒体的氧化应激反应、增加内皮细胞NO浓度,进而改善神经血管偶联功能和乙酰胆碱诱导的老年小鼠大脑血管扩张,减轻神经血管偶联功能障碍[24]。非黄酮类多酚有机化合物白藜芦醇具有抗炎、抗氧化等作用[25]。研究表明,白藜芦醇通过下调大脑皮质NADPH氧化酶、降低内皮细胞ROS的产生,减轻氧化应激反应,增加中枢系统NO浓度,治疗老年小鼠的神经血管偶联功能障碍,对脑血管具有抗衰老作用[26]。
铁螯合疗法是神经血管保护的一种新的治疗策略,铁螯合剂去铁氨(deferoxamine,DFO)能够激活血管内皮生长因子,从而产生促进血管生成和神经保护作用,并且DFO有着明显的时间依赖性,对老年人的神经血管保护作用明显优于年轻人[27]。
此外,健康的生活方式对神经血管偶联功能大有裨益,如水果蔬菜中的多酚类化合物能够通过PI3K/Akt和p38MAPK信号通路介导eNOS的磷酸化,刺激内皮细胞产生NO,保护神经血管偶联功能[28]。适度运动也能够通过激活Akt依赖的信号来促进eNOS的表达和活性上调,进而增加内皮细胞NO的浓度增加脑血流量,改善神经血管偶联功能[29]。
5 总结和展望
调节血流在神经系统疾病尤其是退行性疾病的治疗中受到越来越多的关注。神经血管偶联功能障碍时,神经元营养和代谢受到严重影响,造成神经元内细胞毒性物质累积、衰老和凋亡加剧,影响AD、PD、CCVD等诸多中枢神经系统疾病的发生与发展。由于神经血管偶联研究技术方法要求较高,限制了对其机制的深入解读及临床治疗药物的开发。随着在体双光子等技术的发展,神经血管偶联的研究出现了质的飞越,但该领域仍然存在着很大的空白,诸多问题有待解决。比如神经血管偶联能够使活跃的神经元血液供给增加,但增加的血流从何而来目前还没有明确的研究对其说明。文献中提及小动脉内皮细胞能够逆行性引起上游动脉血管的扩张,从而引起CBF增加。也有研究提出抑制性神经元能够释放血管收缩信号引起局部血管收缩,周细胞隧道纳米管能够收缩部分血管实现血液的空间性转移。在这方面期待更为深入的研究,阐述其内在的机制。BOLD fMRI技术目前被广泛应用于脑血管功能方面的检测,但有研究表示脑血管反应性(cerebrovascular reactivity,CVR)作为BOLD fMRI检测技术的重要指标存在明显的区域变异性和性别差异。Urback等[30]研究表明大脑各区域的CVR达到峰值的时间存在差异。与女性相比,男性的全脑CVR明显更高,这是我们在使用BOLD fMRI技术进行检测时值得注意的地方,并提示我们在未来的研究中,尤其是从事那些检查特定大脑区域的疾病状态或以性别差异为特征的疾病时应考虑这些变量。而针对神经血管偶联障碍的药物研究方面更有广阔的发展空间,同时与临床的合作交流也有待加强。
