AICAR对不同肿瘤细胞系c-Myc表达及细胞增殖影响的差异研究
2023-12-12赵艳丽
赵艳丽,尚 曼,王 霆,傅 源
(天津医科大学基础医学院药理学系,天津 300070)
5-氨基咪唑-4-羧基酰胺核糖核苷(5-aminoimidazole-4-carboxamide 1-β-D-ribofuranoside ,AICAR)是一种细胞内源的代谢物,其结构类似腺苷,通常用作腺苷酸激活蛋白激酶(adenosine 5′ monophosphate-activated protein kinase,AMPK)的激动剂。AMPK在细胞能量代谢调控中发挥核心作用,AICAR则能够通过激活AMPK信号通路调节细胞代谢, 刺激肌肉纤维活动, 抑制癌细胞生长[1]。AICAR在很多肿瘤学研究中被广泛使用,许多研究者都通过使用AICAR来证明AMPK参与了的某些特定的生物学过程。作为AMPK的激动剂,AICAR可以抑制细胞内许多消耗ATP的生物过程,因而被认为是一种有前途的抗癌分子。然而,在应用AICAR治疗非小细胞肺癌和急性髓系白血病的临床试验中,AICAR显现出严重的副作用[2-3]。因此,有必要对AICAR在细胞内的功能展开充分研究,特别是要关注其不依赖于AMPK的生物学功能。
近期很多研究表明,AICAR在细胞内具有不依赖于AMPK的功能。例如,AICAR可以通过诱导Cdc25c降解阻滞细胞周期进程[4];AICAR能够通过阻止核因子κB(nuclear factor kappa-B, NF-κB)结合于其靶基因启动子区减弱NF-κB介导的炎症反应[5]。本研究也揭示了一项AICAR不依赖于AMPK的新功能,即AICAR可以促进原癌基因MYC蛋白(Myc proto-oncogene protein,c-Myc)的表达。因此,在将AICAR作为AMPK激动剂应用于各种临床场景时,不能简单地认为AICAR的生物学效应全部是由AMPK激活导致的,有必要对其效应进行全面深入的分析。
c-Myc是一个转录因子,在调节癌细胞增殖中发挥着重要作用。在超过70%的人类癌细胞中都可以检测到c-Myc的异常高表达。大量研究表明,c-Myc是肿瘤发生和发展的重要标志物[1]。既往研究显示,抑制c-Myc表达是一种有效阻止肿瘤进展的手段[6-7]。作为细胞增殖相关的主要调节因子,c-Myc也会促进一些核苷酸合成相关代谢酶的转录[8-9]。因此,有理由认为c-Myc可能会受到一些内源性核苷酸代谢物的反馈调节。然而,到目前为止,还没有发现任何与核苷酸相关的内源性代谢物可以调节c-Myc。另外,c-Myc也是一个与AMPK有密切联系的蛋白。两者虽然属于相对独立的信号通路,但都直接调控细胞内能量代谢。两者之间也存在密切的信号沟通[10-11]。考虑到c-Myc与AMPK的密切联系以及c-Myc能够调节核苷酸合成,我们猜想,c-Myc可能也会类似AMPK受某些核酸衍生物的调节。
本研究探讨了AICAR对c-Myc表达及细胞增殖的影响。我们发现,AICAR能以细胞特异地方式上调促癌因子c-Myc。这些研究结果完善了我们对AICAR功能的理解,并提示了基于肿瘤细胞异质性个性化地分析AICAR抗癌作用的必要性。
1 材料与方法
1.1 材料
1.1.1细胞 人胰腺癌细胞SW1990、人肝癌细胞HepG2、人乳腺癌细胞MCF-7、人骨肉瘤细胞U2OS来自于国家实验细胞资源共享平台。人非小细胞肺癌细胞A549由天津市肿瘤医院李悦国课题组馈赠。人肾透明细胞腺癌细胞786-O来源于ATCC。
1.1.2主要试剂 AICAR(货号:HY-13417)和放线菌素D(actinomycin D,货号:HY-17559)购自MCE公司。放线菌酮(CHX,货号:14126)来源于Cayman。DAPI(货号:A606584)购自上海生工生物工程有限公司。TRIzol试剂购自Thermo Fisher(货号:15596026)。DMEM(货号:11965092)、RPMI 1640(货号:11875119)和Opti-MEM(货号:31985070) 购自Gibco。青霉素-链霉素混合液(货号:P1400)和非必需氨基酸(货号:N1250)购自北京索莱宝科技有限公司。胎牛血清(货号:13011-8611)购自四季青。转染试剂LipofectamineTMRNAiMAX(货号:13778500)购自Thermo Fisher。兔抗c-Myc购自Proteintech(货号:10828-1-AP),兔抗AMPKɑ1购自Abcam(货号:ab32047)。兔抗p-AMPKα Thr172 购自Cell Signaling Technology(货号:2535S)。β-actin 购自Sigma Aldrich(货号:A3854)。靶向c-Myc、ADK、ATIC的siRNAs由Synbio technologies公司合成。靶向AMPKα1/2的siRNA购自Santa Cruz Biotechnology(货号:sc-45312)。
1.1.3主要仪器 生物安全柜购自力康生物医疗科技控股集团。细胞培养箱购自Thermo Fisher Scientific。电泳仪、转膜仪、普通PCR仪和荧光定量PCR仪购自Bio-Rad。化学发光成像分析仪购自上海天能生命科学有限公司。干式恒温仪购自江苏海门市其林贝尔仪器制造有限公司。酶标仪购自Bio-Tek。
1.2 方法
1.2.1药物的配制 AICAR使用DMSO配制成浓度为1 mol·L-1的母液备用。使用时用培养基稀释至所需浓度。
1.2.2细胞培养 细胞系SW1990、786-O使用RPMI 1640培养基(含10%胎牛血清、1%青霉素-链霉素混合液),HepG2、A549、MCF-7、U2OS使用DMEM培养基(含10%胎牛血清、1%青霉素-链霉素混合液和1%非必需氨基酸)。在37 ℃,5% CO2的环境中于细胞培养箱内培养。
1.2.3细胞转染 取对数生长期的SW1990细胞,接种1×105个细胞至12孔板每孔。待细胞密度达到50%~70%时进行转染。按照体积比100 ∶2.5 ∶1.5的比例混合Opti-MEM、LipofectamineTMRNAiMAX和siRNA(10 nmol·L-1),并依据说明书所述的操作方法加入至SW1990细胞培基中。转染时间为48 h。
1.2.4Western blot 向12孔板的细胞中加入100 μL裂解液(含蛋白Laemmli加样缓冲液)。收集细胞,于98 ℃高温煮10 min。SDS-PAGE凝胶电泳分离变性蛋白,然后将蛋白转移至PVDF膜。用含有10%脱脂奶粉的TBST(Tris-buffer saline with Tween-20 ∶20 mmol·L-1Tris, 150 mmol·L-1NaCl, 0.1%w/vTween-20)溶液中封闭2 h。加入一抗后4 ℃过夜孵育。第2天用TBST洗膜,然后室温孵育二抗2 h。之后再次用TBST溶液洗膜。使用化学发光成像系统对蛋白质进行显影。
1.2.5qRT-PCR SW1990细胞接种于12孔板中。用AICAR(0,1,2 mmol·L-1)处理细胞16 h。之后收集细胞,用TRIzol试剂提取细胞总RNA。使用Hifair®Ⅱ第一链cDNA合成试剂盒(YEASEN)逆转录合成cDNA。使用SYBR Master Mix (Yeasen)完成qRT-PCR。引物序列如下:β-actin正向引物序列:5-CGTACCACTGGCATCGTGAT-3,反向引物序列:5-AGGTAGTCAGTCAGGTCCCG-3;c-Myc正向引物序列:5-TCCCTCCACTCGGAAGGAC-3,反向引物序列:5-CTGGTGCATTTTCGGTTGTTG-3。
1.2.6mRNA降解速率检测 准备两组细胞,分为对照组和AICAR(2 mmol·L-1)处理组。待AICAR处理完成后,加入放线菌素D(5 mg·L-1)抑制mRNA合成。孵育0、40、60、80 min,100、120 min后收集细胞,提取RNA。使用qRT-PCR的方法检测mRNA水平。
1.2.7蛋白降解速率检测 准备细胞,分为对照组和AICAR(2 mmol·L-1)处理组。待AICAR处理完成后,加入放线菌酮(CHX,50 mg·L-1)抑制蛋白合成,孵育0、30、60、90、120、150 min后收集细胞,提取蛋白样本,使用Western blot方法检测蛋白水平。
1.2.8MTT检测细胞活力 SW1990、A549、HepG2细胞分别接种于96孔板内。对照组和实验组均设置10个复孔,每孔接种8 000个细胞。siRNA的转染时间为48 h。然后用AICAR(0、2 mmol·L-1)处理细胞16 h。细胞处理完成后,弃去细胞培养基,每孔加入100 μL无血清培养基和10 μL MTT溶液(0.5%)。在37 ℃继续孵育3~4 h。然后弃去含有MTT的培养基,每孔加入150 μL DMSO。用分光光度法测定了490 nm波长的吸收值变化。

2 结果
2.1 AICAR促进S19990细胞中c-Myc基因表达胰腺癌细胞系SW1990用不同浓度AICAR(0、1、2 mmol·L-1)处理后,c-Myc的蛋白水平升高(Fig 1A)。AICAR(2 mmol·L-1)处理组的c-Myc mRNA水平明显高于对照组(P<0.01);AICAR(1 mmol·L-1)处理组与对照组间差异无统计学意义(P=0.25;Fig 1B),因此,后续实验选择2 mmol·L-1作为AICAR的工作浓度。用AICAR(2 mmol·L-1)处理SW1990细胞0、4、6、8、12、24 h后,c-Myc蛋白水平逐渐升高,在处理约12 h后达到c-Myc蛋白最大表达水平(Fig 1C),因此,确定后续实验中AICAR处理时间均大于12 h。
2.2 AICAR促进c-Myc基因表达不依赖于AMPKAICAR是一种常用的AMPK激动剂,可以导致AMPK催化亚基于Thr172位点磷酸化(Fig 2A)。为了检验其他AMPK激动剂是否也能诱导c-Myc增加,我们用腺苷处理SW1990细胞。结果发现,腺苷抑制c-Myc的表达,与AICAR的作用完全相反 (Fig 2B)。这一结果提示,AICAR促进c-Myc上调可能与其激活AMPK信号通路的功能无关。为了验证这一假设,我们在SW1990细胞中通过siRNA敲低了AMPK的催化亚基。结果表明,敲低AMPK并不影响AICAR对c-Myc的上调作用(Fig 2C)。

Fig 1 AICAR promoted c-Myc gene expression in SW1990 n=3)
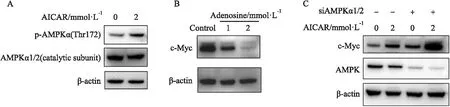
Fig 2 AICAR promoted c-Myc expression in an AMPK-independent manner
2.3 AICAR调节c-Myc表达不依赖于其下游代谢产物在细胞中,AICAR能够被腺苷激酶(ADK)磷酸化生成5-氨基咪唑-4-羧基酰胺核糖核苷单磷酸(5-aminoimidazole-4-carboxamide-1-β-D-ribofuranosyl 5′-monophosphate, ZMP),并被AICAR转化酶(ATIC)进一步转化为次黄嘌呤核苷单磷酸(IMP),腺苷单磷酸(AMP)及鸟苷单磷酸(GMP)(Fig 3A)。为了研究c-Myc表达上调是AICAR的直接效应还是其下游代谢产物的效应,我们在SW1990中敲低了ADK或ATIC (Fig 3B,C)。结果发现这两个基因的敲低都没有影响AICAR上调c-Myc的作用,这表明AICAR本身,而不是其下游代谢物上调c-Myc。

Fig 3 The regulatory effect of AICAR on c-Myc expression was not mediated by its downstream metabolites
2.4 AICAR通过促进c-Myc mRNA稳定性上调c-Myc表达为了研究AICAR上调c-Myc表达的机制,我们用RNA合成抑制剂放线菌素D检测了AICAR对c-Myc mRNA的稳定性的影响,结果发现,AICAR处理后,c-Myc mRNA的稳定性明显增强(Fig 4A)。然而,使用蛋白质合成抑制剂放线菌酮(CHX)对c-Myc蛋白的稳定性进行测试,结果显示,AICAR对c-Myc蛋白的稳定性没有影响(Fig 4B)。这表明,AICAR上调c-Myc基因表达主要是通过促进其mRNA稳定性实现的。
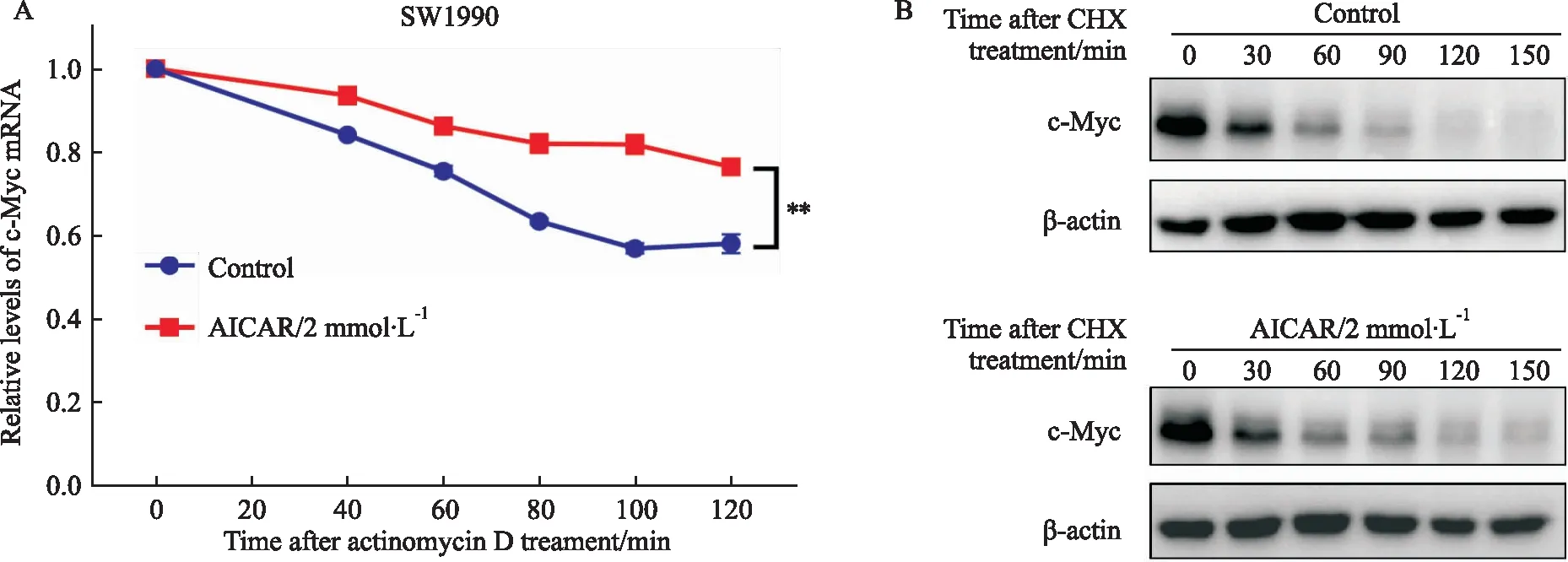
Fig 4 AICAR enhanced stability of c-Myc mRNA n=3)
2.5 AICAR对c-Myc的调节具有细胞选择性我们选择了几种常用的人类癌细胞系进行测试,分别用AICAR(0、1、2 mmol·L-1)处理16 h。结果发现,AICAR在肾透明癌细胞786-O和非小肺癌细胞A549中上调c-Myc蛋白表达(Fig 5A);相比之下,在肝细胞癌细胞HepG2、乳腺癌细胞MCF-7和骨肉瘤细胞U2OS中AICAR下调c-Myc蛋白表达(Fig 5B)。
鉴于AICAR对c-Myc的调控作用具有细胞选择性,我们选取HepG2作为AICAR不能上调的c-Myc的细胞系代表,测试了AICAR是否会影响这类细胞中c-Myc的mRNA的稳定性。(Fig 5C)结果表明,AICAR不会影响HepG2细胞内c-Myc的mRNA的稳定性。

Fig 6 Effect of AICAR on cell viability
2.6 AICAR对细胞活力的影响SW1990、A549和HepG2细胞分别用AICAR(0、2 mmol·L-1)处理16 h。MTT法测定细胞活力表明,在HepG2细胞中,AICAR(2 mmol·L-1)处理组细胞活力明显低于对照组(P<0.01;Fig 6C),这与AICAR下调HepG2细胞中c-Myc表达可能引起的预期效应一致。然而,在SW1990细胞和A549细胞中AICAR(2 mmol·L-1)处理组的细胞活力与对照组之间无统计学差异(Fig 6A,B)。在较高浓度(4 mmol·L-1)下,AICAR会略微抑制A549细胞的增殖;而在较低浓度(1 mmol·L-1)下,AICAR会略微促进SW1990细胞的增殖。c-Myc是经典的促细胞增殖基因,AICAR虽然能够上调c-Myc的表达,但在某些浓度剂量下,AICAR不能上调细胞的增殖速率甚至会下调细胞的增殖速率。这可能是由于AICAR除了影响c-Myc还会影响AMPK等其他信号通路。事实上,AICAR能够通过激活AMPK抑制细胞增殖,在不同的浓度条件下,不同的信号通路可能会占主导。因此,在多种信号通路的共同作用下,特别是由于c-Myc和AMPK相互拮抗,细胞的表观增殖速率可能不会发生明显变化。
鉴于c-Myc在SW1990和A549细胞中被AICAR上调,我们推测抑制c-Myc与AICAR处理联合治疗可能成为抑制这类细胞增殖的有效策略。为了验证这一猜想,我们用RNA干扰敲低了SW1990、A549和HepG2细胞中的c-Myc,再用AICAR(0、2 mmol·L-1)处理细胞16 h(Fig 6D-H)。结果显示,在SW1990和A549细胞中,AICAR(2 mmol·L-1)处理组的细胞活力与对照组细胞活力差异无统计学意义,表明单独AICAR处理不能抑制这两种细胞的增殖。然而,在敲低c-Myc后,SW1990细胞和A549细胞中AICAR(2 mmol·L-1)处理组的细胞活力明显低于对照组,差异有统计学意义(P值分别为<0.01和0.014;Fig 6D,E)。表明在AICAR上调c-Myc的细胞中,必须同时抑制c-Myc的表达,AICAR才能有效抑制细胞增殖。相比之下,在HepG2细胞中,当c-Myc正常表达时,AICAR(2 mmol·L-1)处理组的细胞活力低于对照组,差异具有统计学意义(P<0.01;Fig 6F)。在此基础上敲低c-Myc,AICAR(2 mmol·L-1)处理组的细胞活力依然低于对照组,差异仍具有统计学意义(P<0.01;Fig 6F)。综上,对于AICAR上调c-Myc表达的细胞,抑制或敲低c-Myc是AICAR发挥抗增殖作用的前提条件;而对AICAR不能上调c-Myc的细胞,无需抑制或敲低c-Myc,AICAR即可发挥抗增殖作用。
3 讨论
AICAR是一个经典的AMPK激动剂,AMPK是调控细胞内各种生物能量代谢的关键因子。既往研究表明,AICAR能够通过激活AMPK抑制肿瘤细胞增殖或诱导癌细胞凋亡[12-14]。因此,在大多数研究AICAR的文章中,AICAR的生物学效应往往与AMPK相互关联。然而,在本研究中,我们发现了AICAR在胰腺癌细胞SW1990中的新作用。AICAR能够以一种不依赖于AMPK的方式上调转录因子c-Myc的表达。AICAR对c-Myc的上调作用不局限于胰腺癌细胞SW1990。通过测试一系列肿瘤细胞系,我们发现AICAR同样能够上调肾透明癌细胞786-O和非小细胞肺癌细胞A549中的c-Myc表达。
有趣的是,在肝癌细胞HepG2、乳腺癌细胞MCF-7和骨肉瘤细胞U2OS中,AICAR会下调c-Myc表达,表明AICAR对c-Myc的调控效应具有细胞特异性。
c-Myc是一个在肿瘤发生发展中起重要作用的转录因子。在几乎所有的肿瘤组织中,c-Myc都呈现高表达[1, 6]。c-Myc能够促进肿瘤细胞的增殖,直接抑制c-Myc可以快速消退小鼠的肿瘤[6]。既往研究表明,AICAR能够以多种方式发挥抗癌作用。一方面,AICAR是AMPK激动剂,通过激活AMPK进而下调mTOR信号通路抑制细胞内蛋白质合成[15-16]。另一方面,AICAR可以通过抑制核苷酸合成和阻滞细胞周期起到抗肿瘤细胞增殖的作用[17]。但是,本研究显示,AICAR能够在某些肿瘤细胞内上调c-Myc的表达水平。由于c-Myc本身是一个促癌因子,因此可以预见,c-Myc表达水平的上调会削弱AICAR的抗癌作用。在某些类型的肿瘤细胞中,AICAR甚至有可能通过c-Myc依赖的方式起到促癌的作用。
MTT实验表明,AICAR会明显降低HepG2细胞的增殖速率,而对SW1990和A549的细胞增殖无明显影响。巧合的是,AICAR会下调HepG2细胞中c-Myc的表达,而上调SW1990和A549细胞中c-Myc的表达。这些现象提示,AICAR对细胞增殖的影响与其对c-Myc的调控作用有关。进一步研究表明,敲低SW1990和A549细胞的c-Myc能够促使AICAR发挥抑制细胞增殖的效应。因此,我们推测:在SW1990和A549中,AICAR介导了c-Myc的上调,c-Myc的上调抵消了AICAR通过激活AMPK信号通路所带来的抗增殖效应。而在HepG2细胞中,由于AICAR无法上调c-Myc,所以AMPK信号通路带来的抗增殖效应占据主导地位。
基于本研究所尝试的几种细胞系,AICAR调控c-Myc的作用方向与肿瘤细胞的组织来源无明确关联。事实上,由于肿瘤细胞具有高度异质性,即便是相同组织来源的肿瘤细胞,由于所携带的基因变异不同,其表达谱系也可能会有很大差别[18]。AICAR在哪些肿瘤细胞会上调c-Myc取决于AICAR的直接作用靶点的表达水平。然而,本研究的一个局限是我们并没有鉴定出AICAR上调c-Myc的直接作用靶点。AICAR结合靶点的鉴定及AICAR上调c-Myc具体的分子机制,还有待进一步探索。
综上所述,AICAR能够选择性地在某些类型的肿瘤细胞内以AMPK非依赖的方式上调c-Myc表达,进而影响细胞增殖。这些实验结果表明,虽然AICAR是一个很有应用前景的抗癌小分子,但在将其应用于抗癌治疗时,需考虑到其对c-Myc等促癌转录因子的调控作用。应用AICAR前,需要有针对性地具体分析AICAR对特定类型细胞带来的特定效应。
