山姜素减轻博来霉素诱导的小鼠肺纤维化
2023-12-11司常星丁艳艳尹凤先
司常星,丁艳艳,尹凤先
北京市大兴区人民医院 呼吸与危重症医学科,北京 102600
肺纤维化是一种慢性进行性疾病,其特征是肺泡上皮损伤和胶原异常沉积[1]。肺纤维化患者常表现为肺功能不可逆转地丧失[2]。尽管目前对肺纤维化的治疗方案不断改进,但肺纤维化的预后并没有得到明显改善[3],因此,急需寻找新的安全有效的抗肺纤维化的药物。
山姜素(alpinetin,ALPN)是一种从高良姜的种子中分离的类黄酮类化合物,其已被证明具有抗氧化、抗炎、抗肿瘤和免疫调节等多重药理活性[4-5]。另外,已有研究报道:ALPN具有减轻动物模型的肝纤维[6]和治疗肺部疾病[7]的作用,但其具体机制尚不清楚。本研究通过博来霉素(bleomycin,BLM)构建小鼠肺纤维化模型,给予ALPN干预,来探讨ALPN是否具有减轻肺纤维化的作用,并分析其中的机制。
1 材料与方法
1.1 材料
1.1.1 实验动物:6~8周龄SPF级雄性C57 BL/6小鼠,体质量19~21 g(北京希诺因生物技术有限公司),生产许可证号为SCXK(京)2022-0006。
1.1.2 实验试剂:BLM(纯度>98%)(北京迈瑞达科技有限公司);ALPN粉剂(Sigma-Aldrich公司);HE和Masson染色试剂盒(北京索莱宝科技有限公司);α-平滑肌肌动蛋白(alpha-smooth muscle actin,α-SMA)和葡萄糖调节蛋白78(glucose regulator protein 78,GRP78)抗体(Abcam公司);C/EBP同源蛋白(C/EBP homologous protein,CHOP)和钙黏附蛋白E(E-cadherin)抗体(Cell Signaling Technology公司);Ⅰ型胶原蛋白(collagen Ⅰ)、转化生长因子β1(transforming growth factor beta1,TGF-β1)、蛋白激酶R样内质网激酶[(protein kinase R (PKR)-like endoplasmic reticulum kinase,PERK]和磷酸化PERK(PERK抗体)(Santa Cruz公司);总RNA提取试剂盒和TaqMan一步法RT-qPCR 试剂盒(北京索莱宝科技有限公司);Alexa 488、Alexa 594以及HRP标记的二抗(北京博奥森生物技术有限公司);GAPDH抗体、RIPA裂解液和BCA蛋白定量试剂盒(成都正能生物技术有限责任公司)。
1.2 方法
1.2.1 小鼠的分组与处理:将小鼠随机分为:对照组、模型组[每日1次气管内滴注2 mg/kg(50 μL 0.9%氯化钠溶液稀释)BLM,连续21 d]、低剂量ALPN组(L-ALPN)和高剂量ALPN组(H-ALPN组)[在BLM滴注后2 h,分别每日灌胃1次10 mg/kg或30 mg/kg ALPN(均2 mL 0.9%氯化钠溶液稀释)],每组均纳入10只小鼠。持续21 d,收集肺组织。
1.2.2 HE和Masson染色法观察肺组织病理学改变:取石蜡包埋的肺组织,切片厚度5 μm。肺切片经脱蜡水化后,按照试剂盒步骤进行HE染色和Masson染色,显微镜下观察并对肺组织行Aschcroft评分和Masson染色评分。
1.2.3 免疫组化法检测肺组织中collagen Ⅰ和TGF-β1的表达:肺切片(5 μm)经脱蜡水化后,按常规SP法孵育collagen Ⅰ和TGF-β1抗体。DAB显色后在光学显微镜下观察。用Image J软件对阳性染色分析。
1.2.4 RT-qPCR检测肺组织中collagen Ⅰ、TGF-β1、E-cadherin、α-SMA、CHOP和GRP78的mRNA表达:用总RNA提取试剂盒提取组织中RNA。按TaqMan一步法RT-qPCR试剂盒进行PCR反应。引物由上海生工公司合成,引物系列为:GAPDH(正向:5′-GGTTGTCTCCTGCGACTTCA-3′;反向: 5′-TGGTCCA GGGTTTCTTACTCC-3′),collagen Ⅰ(正向:5′- GGTCT GGATGGATTGAAGGGACAGC-3′;反向: 5′-GGCTCC TGTTTGACCTGGAGTTCC-3′),TGF-β1(正向:5′-CCA GATCCTGTCCAAACTAAGG-3′;反向: 5′-CTCTTTAG CATAGTAGTCCGCT-3′),E-cadherin(正向:5′-GGAT GTGCTGGATGTGAATG-3′;反向: 5′-CACATCAGACA GGATCAGCAGAA-3′),α-SMA(正向:5′-GGACGTAC AACTGGTATTGTGC-3′;反向: 5′-TCGGCAGTAGTCA CGAAGGA-3′);CHOP(正向:5′-CCACCACACCTGA AAGCAGAA-3′;反向: 5′-GGTGCCCCCAATTTCATCT-3′);GRP78(正向:5′-ACATG GACCTGTTCCGCTCTA-3′;反向: 5′-TGGCTCCTTGCCATTGAAGA-3′);GAPDH为内参,用2-ΔΔCt法计算目的基因相对表达量。

A.representative immumohistochemical staining images of collagen Ⅰ and TGF-β1 in lung tissues, scale bar=100 μm; B, C.protein expression levels of collagen Ⅰ (B) and TGF-β1 (C); D, E: mRNA expression of collagen Ⅰ (D) and TGF-β1 (E); #P<0.01 compared with control group; *P<0.05, **P<0.01 compared with model group.
1.2.5 免疫荧光法检测肺组织中E-cadherin和α-SMA的表达和分布:肺切片(5 μm)经脱蜡水化和0.1% Triton-X 100渗透后,依次常规法孵育一抗E-cadherin(1∶400)和α-SMA(1∶300),以及Alexa 488或Alexa 594标记的荧光二抗,用DAPI复染细胞核,在荧光显微镜下观察。用Image J软件对阳性信号进行分析。
1.2.6 Western blot法检测肺组织中p-PERK、PERK、CHOP和GRP78的蛋白表达:用RIPA裂解液萃取肺组织的蛋白后,常规进行Western blot转印和孵育p-PERK、PERK、CHOP、GRP78和内参GAPDH抗体。ECL法显影。用Image J软件分析各条带的吸光度(A)值。蛋白相对表达=A目的蛋白/AGAPDH。
1.3 统计学分析
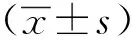
2 结果
2.1 ALPN对BLM诱导的肺纤维化的影响
对照组肺泡结构完整、肺泡壁均匀;模型组呈现明显的肺纤维化改变,表现为肺泡壁变厚,肺泡结构萎陷、破坏,肺泡腔部分消失,由胶原纤维、成纤维细胞替代;L-ALPN组肺部结构相较于模型组有所改善,而H-ALPN组的肺部纤维化情况更轻。相对于对照组,模型组Aschcroft评分和Masson染色评分均明显升高(P<0.01);相对于模型组,L-ALPN组和H-ALPN组Aschcroft评分和Masson染色评分均明显降低(P<0.05或P<0.01)(图1)。
2.2 ALPN对BLM诱导的肺组织collagen Ⅰ和TGF-β1表达的影响
相较于对照组,模型组collagen Ⅰ和TGF-β1的蛋白和mRNA表达水平均明显升高(P<0.01)。在ALPN处理组,由BLM诱导的肺组织collagen Ⅰ和TGF-β1的蛋白和mRNA表达水平均有所降低(P<0.05或P<0.01)(图2)。
2.3 ALPN对BLM诱导肺组织的E-cadherin和α-SMA表达的影响
相较于对照组,模型组小鼠肺组织的E-cadherin的蛋白和mRNA表达降低,α-SMA的蛋白和mRNA表达上升(P<0.01)。与模型组相比,ALPN组肺组织中E-cadherin的蛋白和mRNA表达水平升高和α-SMA的蛋白和mRNA表达水平降低(P<0.05 或P<0.01)(图3)。
2.4 ALPN对BLM诱导的内质网应激关键蛋白表达的影响
相较于对照组,模型组肺组织中CHOP和GRP78的mRNA水平均升高(P<0.01);与模型组相比,ALPN组肺组织中CHOP和GRP78的 mRNA水平均降低(P<0.05或P<0.01)。相较于对照组,模型组肺组织中p-PERK/PERK、CHOP和GRP78的蛋白表达水平均升高(P<0.01);与模型组相比,ALPN组肺组织中p-PERK/PERK、CHOP和GRP78的蛋白表达水平均降低(P<0.01)(图4)。

A,B.mRNA expression levels of CHOP (A) and GRP78 (B); C.representative bands of the protein expressions of p-PERK, PERK, CHOP and GRP78; D-F.statistical data of the expression levels of p-PERK/PERK (D), CHOP (E) and GRP78 (F); #P<0.01 compared with control group; *P<0.05, **P<0.01 compared with model group.
3 讨论
ALPN已被报道具有改善动物肝纤维化和减轻肺部疾病的作用[6-7]。本研究在此基础上进一步探讨ALPN对BLM诱导小鼠肺纤维化的作用和机制。α-SMA是肌成纤维细胞的重要标记分子,可一定程度上反映上皮-间质转化(epithelial-mesenchymal transition,EMT)的水平,E-cadherin是上皮细胞间的重要黏附分子,其改变是发生EMT的重要成因[8]。EMT参与了肌成纤维细胞的形成,并在肺纤维化的发病机制中发挥重要作用。抑制EMT可防止上皮细胞转化为肌成纤维细胞,减轻肺纤维化,且TGF-β1/Smad2/3途径与BLM诱导的肺纤维化进程、炎性反应和EMT密切相关[9]。本研究显示,ALPN处理的BLM小鼠的肺部病理形态学得到明显改善,胶原Ⅰ沉积减少、E-cadherin表达增加、TGF-β1和α-SMA的表达降低,总体而言肺组织纤维化程度降低,且高剂量的ALPN效果更佳,提示ALPN是肺纤维化的潜在防护剂。
本研究进一步探索了ALPN减轻小鼠肺纤维化的机制。内质网应激(endoplasmic reticulum stress,ERS)是机体应对损伤、氧化应激、炎性反应、感染和基因突变等所做出的关键应答反应,与包含肺在内的多种器官的纤维化发病和进展有关[10-11]。在早期特发性肺纤维化患者的肺泡上皮中就可检测到ERS激活[12]。一项研究表明,ERS增强了BLM诱发的肺纤维化[13]。另外,ERS还可通过激活CHOP/GADD153通路,进而活化caspase-12和casapse-4人类同源物,而内质网结合的caspase-12/4与ERS诱导的细胞凋亡有关,且这一过程的发生可引起组织纤维化样改变[14]。本研究结果显示,BLM能诱导ERS相关的通路蛋白p-PERK/PERK、CHOP和GRP78表达增加,提示BLM可能通过激活小鼠体内ERS进而导致肺纤维化的发生;ALPN可在一定程度上抑制BLM诱导的上述蛋白表达,提示ALPN对BLM诱导的肺纤维化具有防护作用,且这种防护作用可能是其通过抑制ERS来实现的。本研究结果还提示ALPN是潜在的肺纤维的防护剂。
