大豆苷元减轻高糖诱导的肾小管上皮细胞焦亡
2023-12-11陈才伟吴月平王转锁邢博真
陈才伟,吴月平,王转锁,罗 强,邢博真
海南医学院第一附属医院 1.医疗保健科;2.内分泌科,海南 海口 570102
糖尿病肾病(diabetic nephropathy,DN)是最常见的慢性肾脏疾病,也是进展至终末期肾病的常见原因[1]。根据早期数据统计,截止到2017年,全球有4.25亿例糖尿病病例,25%~40%的1型糖尿病(type 1 diabetes,T1D)患者和5%~40%的2型糖尿病(T2D)患者最终会发展为DN[2]。虽然有几种临床方法可以延缓发病,但仍然缺乏预防疾病进展的特异性方法。这主要是由于对DN的发病机制了解不足。因此,有必要阐明DN发生过程中的分子机制。大豆苷元(daidxein,DAI)是一种大豆异黄酮,已被发现对高血糖、胰岛素抵抗、血脂异常、肥胖、炎性反应和其他与 T2D 相关的并发症起到积极作用[3]。DAI减轻顺铂诱导的肾损伤大鼠氧化应激和炎性反应[4]。DAI可以减轻链脲佐菌素诱导的糖尿病大鼠心肌损伤[5]。由此,可以推测DAI可能对DN产生积极作用。NOD样受体蛋白3(NOD-like receptor protein 3, NLRP3)炎性小体介导的NLRP3-半胱天冬酶-1(caspase-1)典型焦亡途径是DN肾损伤的重要机制,近期发现调节NLRP3/caspase-1/GSDMD信号通路可以抑制焦亡,拮抗DN诱导的肾损伤[6]。本文探究DAI是否可以通过调节NLRP3/caspase-1信号轴对高糖诱导的肾小管上皮细胞焦亡产生影响。
1 材料与方法
1.1 细胞及主要材料
人肾小管上皮HK-2细胞系(上海烜雅生物科技有限公司);DAI(北京凯诗源生物科技有限公司);NLRP3/caspase-1信号通路激活剂LPS(常州贝源鑫生物科技有限公司);白介素-1β(IL-1β)试剂盒、白介素18(IL-18)试剂盒(上海酶研生物科技有限公司);RPMI-1640培养基(武汉益普生物科技有限公司);MTT细胞毒性和细胞增殖检测试剂盒(翌圣生物科技公司);NLRP3一抗、cleaved-caspase-1一抗、GSDMD-N一抗、凋亡相关斑点样蛋白(ASC)一抗以及HRP标记的羊抗兔IgG二抗、FITC标记羊抗兔IgG荧光二抗,CY3标记羊抗兔IgG荧光二抗(Abcam公司)。
1.2 方法
1.2.1 细胞培养及分组:将HK-2细胞以2×104个/孔接种在96孔培养板。当细胞增殖到80%汇合时,将它们分为:1)对照组(NC组):仅用5.5 mmol/L D-葡萄糖(正常葡萄糖)孵育细胞72 h;2)高葡萄糖组(HG组):30 mmol/L D-葡萄糖孵育细胞72 h[7];3)DAI-L、DAI-M、DAI-H组:30 mmol/L D-葡萄糖分别和25、50和100 μmol/L DAI孵育细胞72 h[8];4)DAI-H+LPS组:30 mmol/L D-葡萄糖、100 μmol/L DAI和1 μg/mL NLRP3/caspase-1通路激活剂LPS共同孵育细胞72 h[9]。每组重复样本数n=6。
1.2.2 MTT法检测HK-2细胞增殖:将用药物处理后的HK-2细胞以1×104个/孔接种在96孔板中。培养24 h后,分别用不同浓度的DAI(0、1、5、25、50和100 μmol/L)处理HK-2细胞24 h。然后在每孔加入5 g/L MTT溶液25 μL,培养4 h后加入100 μL二甲基亚砜。混匀震荡后,用酶标仪检测490 nm处吸光度值。
1.2.3 流式细胞术检测HK-2细胞凋亡:收集各组细胞,用预冷的PBS洗涤,并与5 μL annexin V-FITC和5 μL PI在黑暗中孵育15 min。通过流式细胞仪评估细胞凋亡。
1.2.4 ELISA试剂盒检测HK-2细胞炎性因子水平:将各处理组的HK-2细胞经4 ℃ 3 000 r/min、离心10 min后取其上清液,参照ELISA试剂盒说明书检测炎性因子(IL-1β、IL-18)含量。
1.2.5 采用扫描电镜观察观察细胞焦亡形态:取各组处理后的HK-2细胞接种在放有盖玻片的24孔板中,培养至细胞爬片,随后用PBS冲洗玻片,用10 g/L的锇酸固定1h后,用乙醇逐步脱水、干燥、真空喷镀金属处理后在扫描电镜下采集图像。
1.2.6 免疫荧光染色检测细胞焦亡相关蛋白NLRP3、ASC表达:用胰蛋白酶消化后,完全培养基重新悬浮,随后接种在24孔板上,在培养板中将细胞爬片用PBS冲洗3次,3 min/次,随后用山羊血清封闭30 min加入一抗NLRP3(1∶1 000)、4 ℃过夜,TBST浸洗爬片3次,用吸水纸吸取多余液体后加入FITC标记羊抗兔IgG荧光二抗,37 ℃下孵育1 h,重复以上步骤加入一抗ASC(1∶1 000),加入CY3标记羊抗兔IgG荧光二抗,加入DAPI染细胞核,用含抗荧光淬灭剂的封片液封固,用荧光显微镜观察。
1.2.7 Western blot检测NLRP3、cleaved-caspase-1、GSDMD-N蛋白表达:使用RIPA缓冲液从HK-2细胞中提取总蛋白。将蛋白质样品(50 μg)进行12% SDS-PAGE凝胶电泳,然后转移到PVDF膜中,5%脱脂奶粉封闭膜,并用一抗:NLRP3(1∶1 000)、cleaved-caspase-1(1∶1 000)、GSDMD-N(1∶1 000)和GAPDH抗体(1∶1 000)在4 ℃孵育过夜,洗涤,然后在室温下与HRP标记的二抗(1:1000)孵育1 h。使用化学发光检测系统进行可视化。ImageJ软件分析目标条带的吸光度值。
1.3 统计学分析
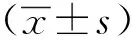
2 结果
2.1 DAI对HK-2细胞增殖能力的影响
与NC组相比,HG组细胞A值显著下降(P<0.05);与HG组相比,DAI-L组、DAI-M组、DAI-H组细胞A值依次显著升高(P<0.05),DAI-H+LPS组较DAI-H组细胞A值显著下降(P<0.05)(表1)。
2.2 DAI对HK-2细胞凋亡能力的影响
与NC组相比,HG组HK-2细胞凋亡率显著增加(P<0.05);与HG组相比,DAI-L组、DAI-M组、DAI-H组HK-2细胞凋亡率依次显著减少(P<0.05),DAI-H+LPS组较DAI-H组HK-2细胞凋亡率显著上升(P<0.05)(图1,表2)。

图1 流式细胞术检测HK-2细胞凋亡率Fig 1 Detection of apoptosis rate of HK-2 cells by flow cytometry

表2 DAI对HK-2细胞凋亡能力的影响Table 2 Effect of DAI on HK-2 cell apoptosis
2.3 DAI对HK-2细胞炎性相关指标的影响
与NC组相比,HG组HK-2细胞IL-1β、IL-18含量显著增加(P<0.05);与HG组相比,DAI-L组、DAI-M组、DAI-H组IL-1β、IL-18含量依次显著减少(P<0.05),DAI-H+LPS组较DAI-H组IL-1β、IL-18含量显著升高(P<0.05)(表3)。
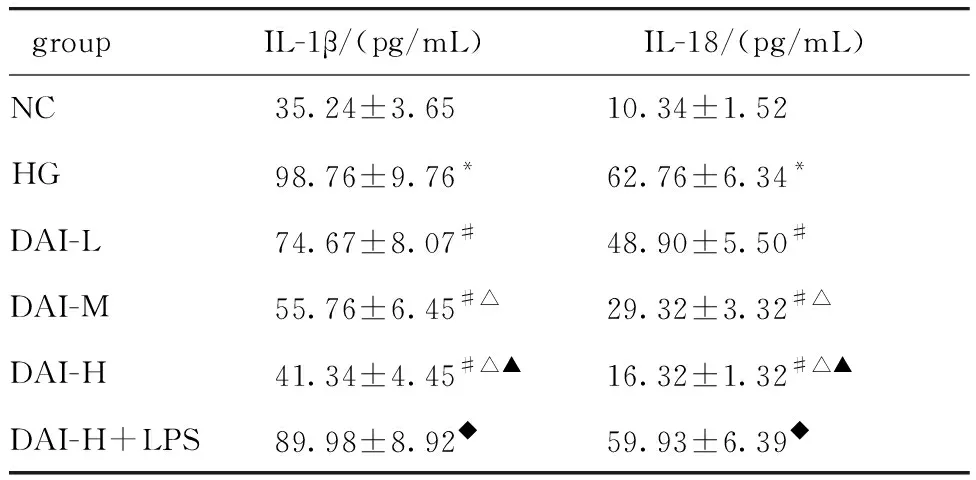
表3 DAI对HK-2细胞炎性因子水平的影响
2.4 DAI对HK-2细胞焦亡形态的影响
NC组细胞呈圆球形,边界比较规则,而HG组细胞肿胀变大,边界不规则;DAI处理后细胞肿胀现象改善,且DAI治疗效果呈现剂量依赖型;DAI-H+LPS group与HG组细胞形态相近(图2)。
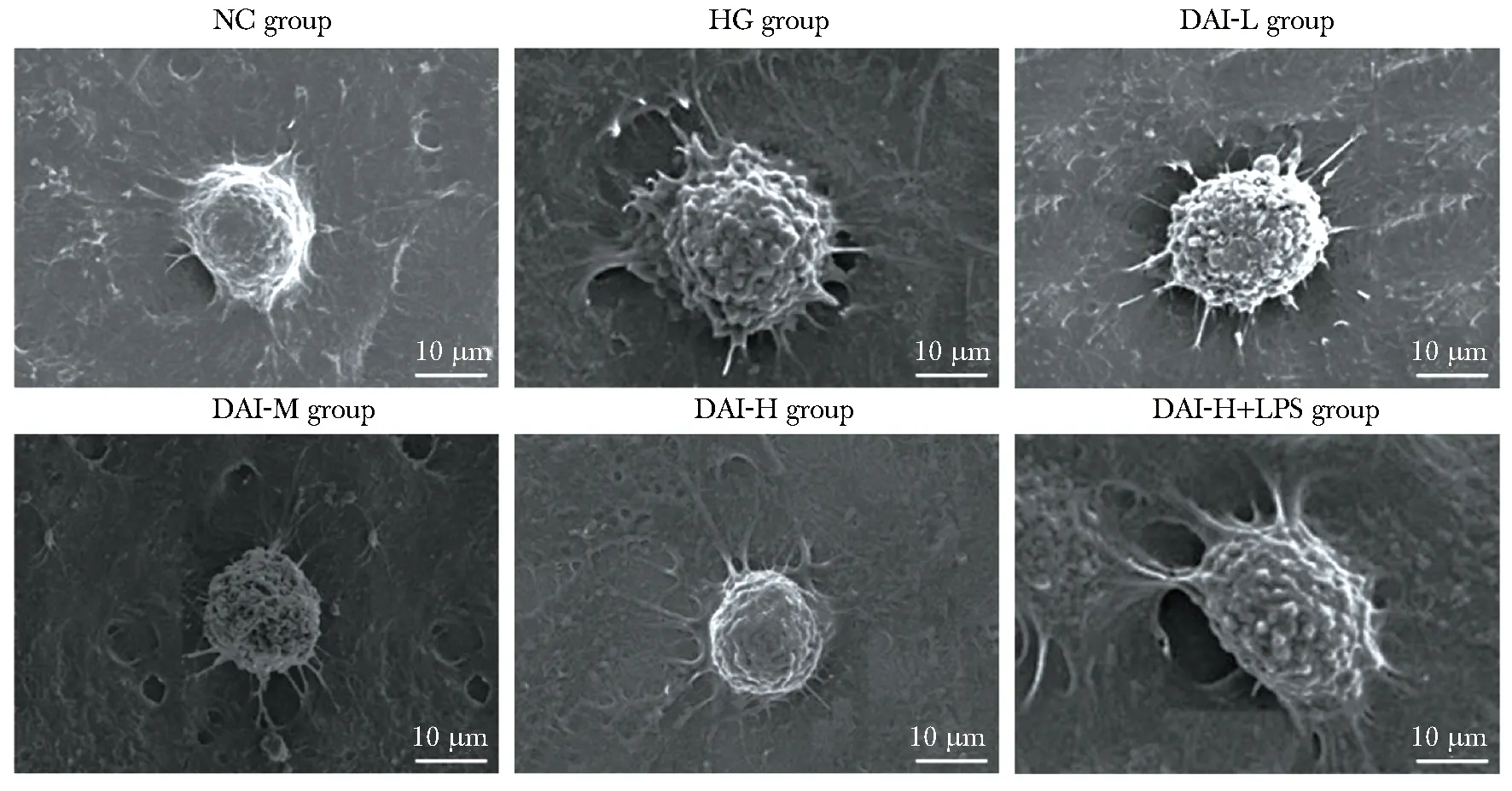
图2 扫描电镜观察细胞形态Fig 2 Scanning electron microscope observation of cell morphology
2.5 免疫荧光双染检测蛋白共定位
免疫荧光染色结果显示,NLRP3蛋白染为绿色,ASC蛋白染为红色,DAPI标记细胞核染为蓝色,HK-2细胞中ASC、NLRP3主要分布在肾小管细胞质中,且细胞质中NLRP3和ASC斑点高度共定位,NC组HK-2细胞仅检测到微量NLRP3、ASC表达,而HG组NLRP3、ASC高表达,DAI处理使NLRP3、ASC表达水平下降,DAI-H+LPS组与DAI-H组相比NLRP3、ASC表达水平升高(图3)。
Green indicates NLRP3 protein, red indicates ASC protein, blue indicates DAPI labeled nuclear.
2.6 DAI对HK-2细胞NLRP3、cleaved-caspase-1、GSDMD-N蛋白表达的影响
与NC组相比,HG组HK-2细胞NLRP3、cleaved-caspase-1、GSDMD-N蛋白水平显著上调(P<0.05);与HG组相比,DAI-L组、DAI-M组、DAI-H组NLRP3、cleaved-caspase-1、GSDMD-N蛋白水平依次显著下调(P<0.05),DAI-H+LPS组较DAI-H组NLRP3、cleaved-caspase-1、GSDMD-N蛋白水平显著升高(P<0.05)(图4,5)。

图4 Western blot检测NLRP3、cleaved- caspase-1、GSDMD-N蛋白表达Fig 4 Western blot detection of NLRP3, cleared- caspase-1, GSDMD-N protein expression
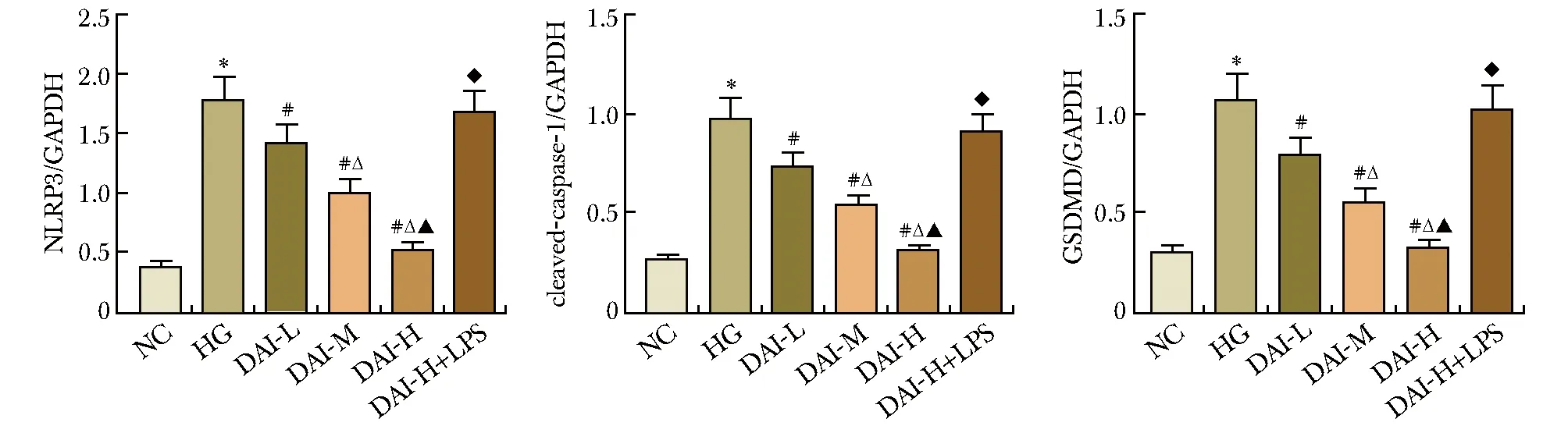
*P<0.05 compared with NC group; #P<0.05 compared with HG group; △P<0.05 compared with DAI-L; ▲P<0.05 compared with DAI-M; ◆P<0.05 compared with DAI-H.
3 讨论
DN是糖尿病的慢性并发症,其典型特征是患者的肾小管损伤[3]。在本研究中,肾小管上皮HK-2细胞经HG处理,引起肾小管上皮细胞损伤。研究发现HG降低了HK-2细胞的增殖能力,诱导HK-2细胞凋亡。这些结果与先前研究一致[10]。DAI是在大豆和其他豆类中发现的主要异黄酮,DAI广泛用于炎性疾病的研究,例如,DAI可以抑制RAW264.7巨噬细胞中脂多糖诱导的炎性[11]。近期,DAI在T2D的治疗中发挥重要作用[12]。DAI可以抑制顺铂诱导的大鼠肾脏炎性反应,缓解肾损伤[5]。本研究发现,DAI可以升高HG处理的HK-2细胞的增殖能力,降低其凋亡率,由此可见,DAI可以对HG诱导的HK-2细胞产生积极影响。
焦亡是由炎性小体引发的,在炎性相关疾病中起核心作用,NLRP3炎性小体通过诱发caspase-1裂解,引起GSDMD切割,从而导致细胞焦亡发生以及炎性因子IL-1β和IL-18释放[13-14]。本研究发现,HG组细胞肿胀变大,边界不规则,DAI处理后细胞肿胀现象改善,且HG组NLRP3、ASC高表达,提示HK-2细胞中NLRP3募集ASC蛋白形成炎性小体。而DAI治疗后HK-2细胞ASC、NLRP3表达水平下降。提示DAI可能通过抑制NLRP3等炎性小体的形成,进而抑制HG诱导的HK-2细胞焦亡。
NLRP3/caspase-1是细胞焦亡研究的核心通路,氢通过调控NLRP3/caspase-1/GSDMD介导的焦亡途径抑制子宫内膜癌细胞的增殖[15]。阻断ROS/NLRP3/caspase-1信号通路抑制LPS-ATP诱导的内皮细胞焦亡,进而治疗慢性肾脏病[16]。抑制NLRP3/caspase-1/GSDMD信号轴还可以阻断细胞焦亡的发生,抑制炎性反应,进而保护DN大鼠[8]。在本研究中,HG组HK-2细胞NLRP3、cleaved-caspase-1、GSDMD-N蛋白高表达,而DAI处理后HK-2细胞NLRP3、cleaved-caspase-1、GSDMD-N蛋白水平显著下调,提示DAI可能通过下调NLRP3/caspase-1信号轴抑制细胞焦亡的发生,对HK-2细胞起到保护作用。为了进一步证实,本研究用DAI和NLRP3/caspase-1信号通路激活剂LPS共同孵育HK-2细胞,结果发现,LPS消除了DAI-H对HK-2细胞焦亡的抑制效果。
综上所述,DAI可能通过抑制NLRP3/caspase-1信号通路,抑制高糖诱导的肾小管上皮细胞焦亡的发生,从而实现对肾小管上皮细胞的保护作用,且DAI的作用效果呈现剂量相关性,本研究为DN的治疗提供了潜在的药物。然而本研究缺少体内实验,DAI在DN大鼠体内是否起到相同作用需要进一步研究。
