miR-34a对高糖状态下小鼠巨噬细胞系RAW264.7极化及炎性因子分泌的影响
2023-12-11张凤云赵志浩张卓琦
张凤云,赵志浩,张卓琦
徐州医科大学附属医院 心内科,江苏 徐州 221000
糖尿病是多种心血管疾病的独立危险因素,糖尿病患者发生心血管并发症的风险是非糖尿病患者的2~5倍。据统计,2017年全球有4.51亿糖尿病患者(年龄在18~99岁之间),预计到2045年,该数字将增加至6.93亿[1],庞大的患者量加剧了健康和经济负担。尽管在过去的十几年中糖尿病得到了广泛的关注和研究,但目前仍存在许多未知的潜在机制。
慢性高糖状态可以上调炎性标志物的表达,促进氧化活性类物质的产生,最终导致血管内皮功能障碍[2]。在众多炎性细胞中,巨噬细胞是多种炎性疾病的的主要反应者[3]。有报道称高血糖可使巨噬细胞过度产生活性氧(reactive oxygen species, ROS),进一步诱导巨噬细胞向 M1型巨噬细胞极化并刺激炎性因子分泌[4]。
近年来在治疗炎性相关的疾病,包括肥胖、糖尿病和糖尿病并发症时,miRNA逐渐成为新靶点。研究表明 miR-34a 在巨噬细胞参与炎性反应过程中起关键作用,可以加剧肥胖引起的全身炎性反应和代谢失调[5]。
本研究旨在探讨高糖条件下miR-34a表达变化及其对巨噬细胞极化和炎性因子的影响,为糖尿病抗炎治疗的临床应用提供理论依据。
1 材料与方法
1.1 主要试剂和细胞
DMEM/高糖(high glucose,HG)和DMEM/正常糖(normal glucose,NG)培养基和胎牛血清(Gibco公司); miR-34a-5p模拟物/抑制剂、IL-6、IL-1β、TNF-α ELISA试剂盒和小鼠单核巨噬细胞RAW264.7(江苏凯基生物技术有限公司);Lipofectamine 3000(Invitrogen公司);Notch1抗体和抗GAPDH兔多克隆抗体(武汉三鹰生物技术有限公司)。
1.2 方法
1.2.1 Raw264.7细胞的分组及处理:将细胞分别置于正常浓度(5.5 mmol/L)或高浓度(25 mmol/L)的葡萄糖下3、7、14和28 d。分别向巨噬细胞转染miR-34a模拟物或miR-34a抑制剂或100 nmol/L siRNA-Notch1。采用空转染(NC)作为对照。所有的 miRNAs和siRNAs都根据转染试剂盒说明书转染到巨噬细胞中。
1.2.2 RT-qPCR检测mRNA表达:用Trizol试剂提取巨噬细胞总RNA,并反转录成cDNA。用 miRcute miRna第一链cDNA合成试剂盒和 miRcute miRNA qPCR检测试剂盒检测miR-34a水平。miR-34a, iNOS,MCP-1,Arg-1和GAPDH上下游引物(表1)。通过比较各PCR靶点的对照和实验条件下△Ct 值,计算相对基因表达水平,方程如下: 相对基因表达=2-ΔΔCt计算。

表1 RT-qPCR 的引物序列和寡核苷酸序列Table 1 Primer sequence for RT-qPCR

表2 寡核苷酸序列Table 2 Sequence for oligonucleotide
1.2.3 Western blot检测蛋白质表达:使用BCA试剂盒测定蛋白质浓度,实验中总蛋白质上样量为50 μg。用8%的脱脂牛奶加0.5% Tween-20的TBS阻断非特异性蛋白。用TBST(含0.5% Tween-20)稀释的一抗4 ℃孵育过夜,后将膜10 min/次,共洗3次,室温放置1 h。再用TBST清洗3次,孵育二抗后再次洗膜,增强化学发光法显色。用 Image J 图像分析软件进行半定量分析,GAPDH作为内参照。
1.2.4 ELISA检测炎性因子释放:取500 μL细胞培养上清。根据说明书,用ELISA法测定TNF-α、IL-1β和 IL-6的含量。TNF-α、IL-1β和 IL-6检测的灵敏性为2 pg/mL。
1.3 统计学分析
2 结果
2.1 在高糖培养条件下miR-34a 表达增加
与正常葡萄糖培养条件相比,在高糖条件下培养28 d时巨噬细胞中miR-34a 的表达水平增高7倍以上(P<0.05)(图1)。

The expression of miR-34a in macrophages was determined by RT-qPCR in normal glucose(NG) and high glucose(HG) cultures; *P<0.05, **P<0.01 compared with NG.
2.2 慢性高糖导致M1巨噬细胞表型标志物表达增加
高糖培养28 d后,M1型巨噬细胞标记物iNOS和 MCP-1的表达增加(P<0.01)(图2B和C)。而M2型巨噬细胞标记物ARG-1 有所下降(图2D)。

Macrophages were cultured under high glucose for 28 days; qRT-PCR was used to detect the expression of miR-34a(A), M1 marker genes(B,C) and M2 related marker genes(D); *P<0.05, **P<0.01 compared with NC.
2.3 miR-34a增加巨噬细胞炎性因子含量
与对照组相比,miR-34a 模拟物组炎性细胞因子TNF-α、IL-1β和IL-6的分泌增加。同时该组细胞M1型巨噬细胞标记物iNOS 和MCP-1 mRNA分泌也增加(P<0.01)。与对照组相比,miR-34a 抑制剂组TNF-α、IL-1β和IL-6的分泌下降,iNOS 和MCP-1 mRNA表达亦下降(P<0.01)(图3)。
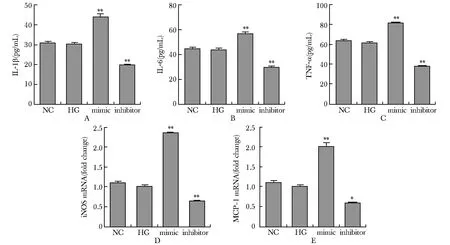
To further detect the role of miR-34a on macrophage polarization, NC,miR-34a mimic, and miR-34a inhibitor was transferred into macrophage under high glucose conditions; A-C.ELISA was used to detect the pro-inflammation factor release (including IL-1β, IL-6 and TNF-α); D,E.RT-PCR was used to detect the mRNA expression of iNOS and MCP-1; *P<0.01, **P<0.001 compared with NC.
2.4 miR-34a通过靶向Notch1调节巨噬细胞的极化
生物信息学提示 Notch1是 miR-34a 的潜在靶点(图4A)。与NC转染细胞相比,miR-34a模拟物转染细胞中Notch1蛋白表达增加(图4B)。此外,在 miR-34a 抑制剂组,Notch1的表达减少(图4B,C)。沉默Notch1表达后,miR-34a表达量下降(图4D),且巨噬细胞的M1型巨噬细胞标记物(iNOS和MCP-1)的表达下降(图4E)。与对照组相比,沉默Notch1表达后巨噬细胞的IL-6,TNF-α和IL-1β含量降低 (图4F)。
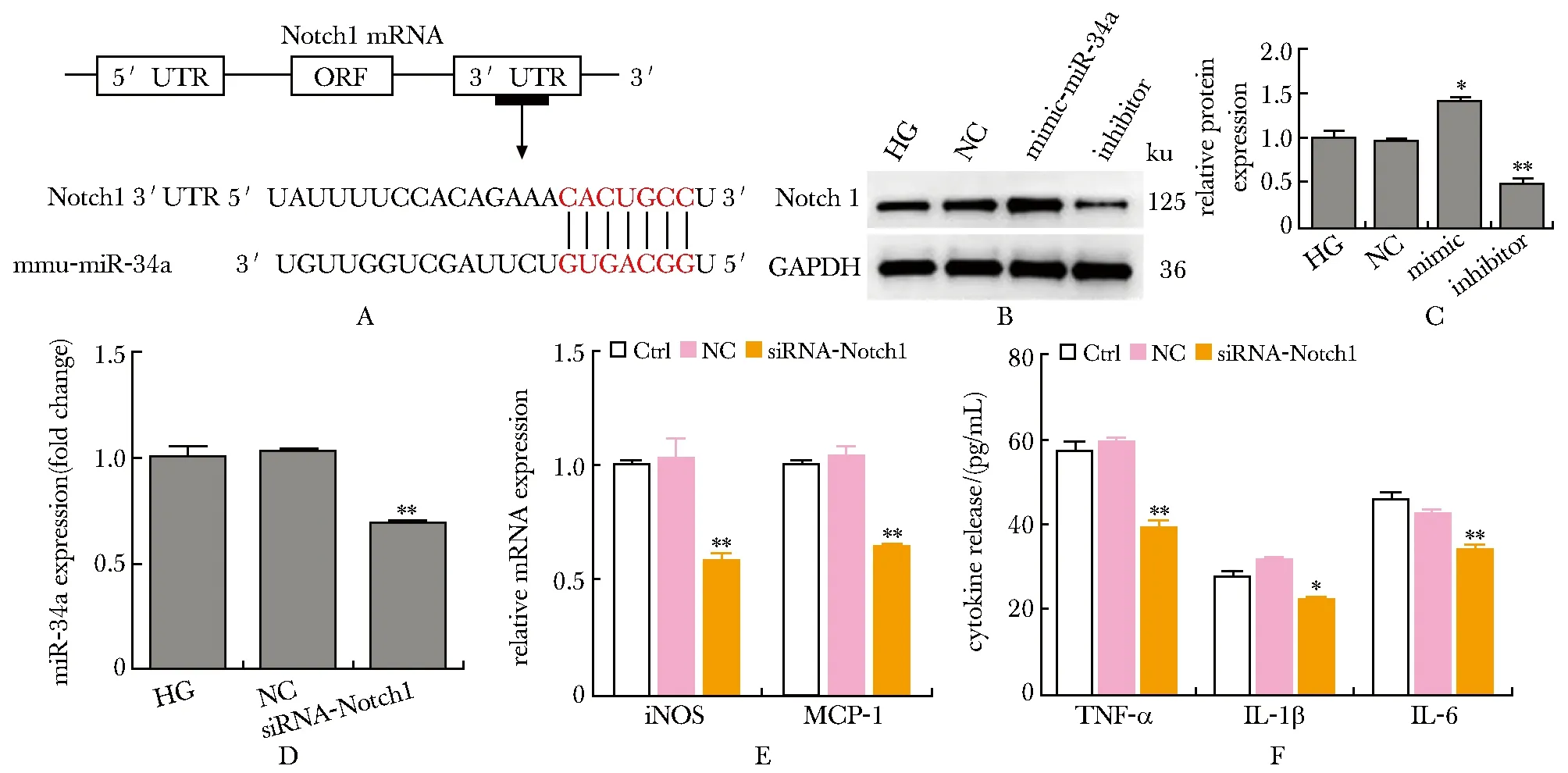
A.binding sites of Notch1 mRNA and mmu-miR-34a; B,C. the cells were transferred with indicated siRNAs, Western blot was used to detect the expression of Notch1; D. qRT-PCR was used to detect the expression of miR-34a; E. qRT-PCR was used to detect the expression of iNOS and MCP-1; F. ELISA was used to detect the secretion of pro-inflammation factors (including IL-1β, IL-6 and TNF-α); *P<0.01, **P<0.001 compared with NC.
3 讨论
糖尿病目前极大威胁公共健康,增加社会卫生保健和治疗成本,加重了患者死亡率和其他多种疾病的发生率。体外高糖培养常用于模拟糖尿病的体内高糖微环境。既往许多研究提出高糖损害机体可能的3种主要机制: 细胞内葡萄糖毒性、糖化终产物的产生和蛋白激酶C (protein kinases C, PKC)激活[6]。最近的数据表明,巨噬细胞炎性激活作为一种可能的额外机制,通过高糖损害血管内皮[7]。
本研究发现高糖培养下,炎性因子(IL-6、IL-1β和TNF-α)表达及M1型巨噬细胞标记物(iNOS和MCP-1)表达随着培养时间增加而增加。这提示慢性高糖培养对巨噬细胞是一种持续的炎性损害。
微小RNA (miRNA)是短的非编码RNA,可以调节靶基因表达,进而影响下游靶蛋白的表达,从而参与几乎所有的细胞反应。已经证明,miRNA可以调节巨噬细胞的极化,从而影响炎性反应[8-9]。
过表达miR-34a促进了M1型巨噬细胞标记物表达和炎性因子的分泌。进一步研究表明,Notch1可作为 miR-34a的下游靶蛋白,可能参与调节巨噬细胞极化和促炎因子分泌。
Notch1被广泛研究于炎性疾病的发病机制和进展[10]。有研究表明Notch1能促进巨噬细胞向M1表型极化[11]。另一项研究表明,在LPS刺激下,人脐静脉内皮细胞 Notch-1/NF-Kb信号通路被激活[12]。本研究证明 miR-34a 通过与 Notch1的3-UTR结合,减少蛋白表达。当沉默Raw264.7细胞中Notch1基因表达后,M1巨噬细胞标记物的表达减少,巨噬细胞炎性反应减轻。
本项研究尚存在如下不足之处:1)本研究采用Raw264.7细胞系在高糖及LPS刺激进行,无法完全模拟体内环境,尚需进一步体内实验支撑;2)本研究通过生物信息库寻找miR-34a下游靶点,无法全面了解miR-34a的可能的多靶点作用网络。
综上所述,长期高糖刺激miR-34a表达,后者促进巨噬细胞向M1型极化和促炎因子的分泌。本研究为改善高糖状态下炎性反应提供可能的靶点。
