GPS2对肝癌细胞系MHCC-97H增殖、迁移与侵袭的调控作用
2023-12-11刘爱霞杨丽华赵晓涛
刘爱霞,张 浩,孙 杰,杨丽华,赵晓涛
1.北京大学人民医院 检验科,北京 100044;2.解放军总医院第五医学中心 检验科,北京 100039;3.河北燕达医院 燕达医学研究部,河北 廊坊 065201
肝细胞癌(hepatocellular carcinoma,HCC)在目前全球常见恶性肿瘤中居第6位及肿瘤致死病因第3位[1],严重威胁人类的生命和健康。我国HCC近5年的年均发病数为42.3万例,占全球42.5%[2]。虽然早期手术切除疗效显著,但复发率和转移率高仍然是基础研究和临床领域的挑战[3]。因此探寻肿瘤抑制因子在肝癌发展和转移中的作用,寻找新的肝癌靶向治疗策略,对于肝癌的诊断和治疗具有重要意义。G蛋白通路抑制因子2(G protein pathway suppressor 2,GPS2)是Spain等于1996年利用G蛋白突变的酿酒酵母筛选G蛋白-MAPK信号通路抑制因子时发现的一种新的蛋白质[4]。在后续的研究中发现GPS2是一种重要的转录调控辅因子,兼具转录抑制和转录激活的调控作用。此前已在涉及基因表达、细胞增殖、细胞凋亡和肿瘤发生发展过程中报道过[5-8]。然而, GPS2在HCC中的作用和机制报道较少。本研究发现GPS2可以影响肝癌细胞的增殖、迁移和侵袭能力,其不仅是肝癌潜在的肿瘤抑制基因,也有可能作为肝癌治疗的新靶点。
1 材料与方法
1.1 材料
1.1.1 细胞系与质粒:肝癌细胞系MHCC-97H(购买自上海生命科学研究院);GPS2表达载体为本实验室所构建,从人胎肝cDNA文库中扩增获得GPS2编码区序列,克隆入慢病毒表达载体pCDH-CMV-puro中;GPS2 shRNA序列(上海生物工程有限公司合成);293T细胞、包装质粒PLP1、PLP2、VSVG(本实验室保存)。
1.1.2 试剂:DMEM高糖培养基、胰蛋白酶、双抗(氨苄青霉素和链霉素混合液)(Gibco公司);胎牛血清(PAN公司);MTT试剂(Amerresco公司);RIPA 裂解液、BCA蛋白定量试剂盒、电泳缓冲液、转膜液以及ECL发光液(北京华兴博创公司);Trizol试剂(Life Technologies公司);SYBR Premix Ex TaqTMⅡ定量PCR试剂盒、反转录试剂盒(TaKaRa公司);GPS2抗体(Abcam公司);EGFR抗体(Cell Signaling Technology公司)。
1.2方法
1.2.1 细胞分组及处理:采用磷酸钙法将克隆有GPS2编码序列的慢病毒表达载体pCDH-GPS2-puro及空载体pCDH-MCS-puro、pLKO.1-shGPS2-puro及pLKO.1-shRNA-puro与辅助包装质粒转染293T细胞,收集病毒上清,将MHCC-97H细胞接种于12孔板,培养24 h后,加入聚凝胺(polybrene)和病毒上清液,4~6 h后弃上清,加入DMEM完全培养液,继续培养24 h后, 加入嘌呤霉素(4 μg/mL),3 d后将细胞转移至6孔板继续加入嘌呤霉素培养,待空白孔细胞全部死亡,弃上清加入完全培养液继续培养48 h收获细胞。细胞分为4组,即GPS2组(GPS2过表达组)、vector组(空载体对照组)、shGPS2组(GPS2敲低组)、shControl 组(敲低对照组)。
1.2.2 qRT-PCR检测各组细胞mRNA表达水平:根据试剂盒说明书, 用Trizol试剂从细胞中提取总RNA,将RNA反转录成cDNA。然后按照cDNA 模板4 μL;SYBR Premix Ex TaqTMⅡ(2×)10 μL;上游引物和下游引物各0.8 μL;DEPC水4.4 μL的体系进行荧光定量PCR。引物序列见表1。反应条件:预变性95 ℃ 30 s(1个循环),PCR反应阶段95 ℃ 5 s,62 ℃34 s(40个循环)。2-ΔΔCt法计算目的基因的相对表达水平。
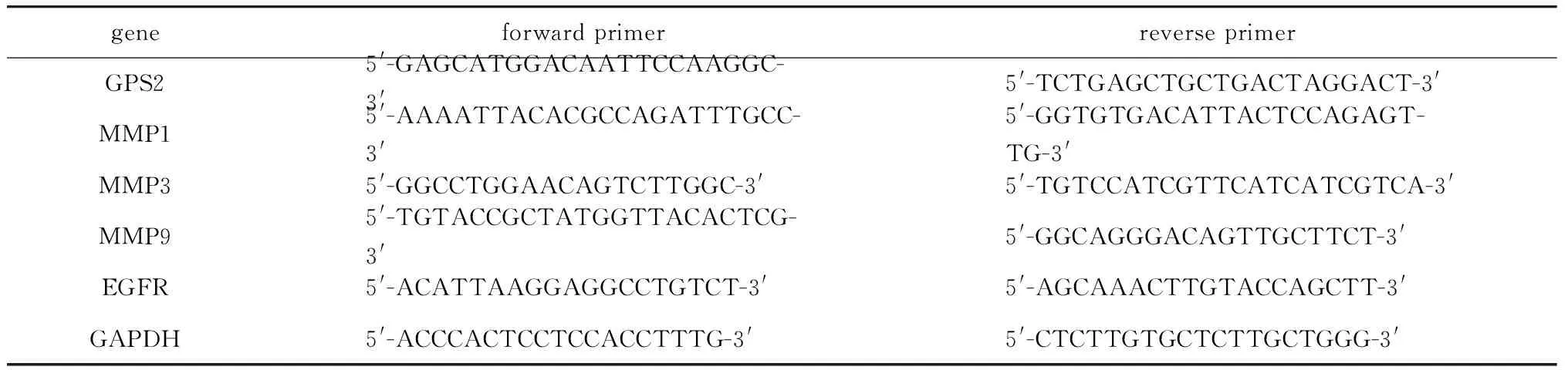
表1 Real time PCR引物序列Table 1 Primer sequence of for real-time PCR
1.2.3 Western blot实验检测蛋白表达水平:选取对数生长期细胞用预冷的PBS 清洗,加RIPA裂解液冰上裂解30 min,离心,收集上清。BCA法进行蛋白定量,100 ℃煮沸5 min变性。配胶,上样,蛋白电泳,转膜,封闭, 抗体孵育,ECL发光液显影,最后应用化学发光成像仪拍照并计算蛋白相对表达量。
1.2.4 MTT实验检测细胞增殖:将各组细胞以2×103个/孔接种到6孔板中,待细胞完全贴壁后换液并在37 ℃、5% CO2培养48 h后(每孔体积约100 μL),加入MTT试剂(50 mmol/L,每孔50 μL)孵育5~6 h后,弃去孔中液体,再使用DMSO进行裂解,最后吸出液体(每孔约100 μL),在波长490 nm处检测吸光度(A)值,以对照组为单位1计算各组相对细胞数量。
1.2.5 细胞集落形成实验:将各组细胞以2×103个/孔接种到6孔板中,待细胞充分贴壁后换液,以含10% FBS的DMEM对细胞进行长期培养。每日观察细胞,待细胞形成明确的集落后,弃培养基并以4% 多聚甲醛固定细胞约15 min。然后使用0.1%结晶紫染料染色并拍照。使用Image J图像分析软件对拍照所得的照片进行定量分析,以克隆的总像素数/6孔板的总像素数确定各组细胞形成克隆的能力。以対照组结果为单位1进行标准化计算。
1.2.6 细胞划痕实验:将各组细胞以1×106个/孔接种到6孔板培养24 h,细胞汇合率达到 80%~ 90%,弃上清,保证枪头垂直进行划痕,PBS 洗3次,向各孔内加入无血清的DMEM培养基继续培养,间隔12 h观察细胞分布状态并进行镜下拍照。细胞划痕愈合率=(0 h划痕宽度-12 h划痕宽度)/0 h划痕宽度×100%。
1.2.7 Transwell 小室实验检测各组肝癌细胞的侵袭能力:预先在Transwell小室上室底部铺设一层Matrigel 胶,将各组培养后用胰蛋白酶消化,上室每孔加入含2×105个细胞的无血清DMEM培养基500 μL,下室内加入含20% FBS的DMEM培养液 600 μL,培养24 h后,将上室取出,下室液体弃去,4%多聚甲醛固定细胞30 min,采用0.1%的结晶紫染液染色40 min,PBS冲洗干净,风干后置于倒置显微镜下计数并拍照,随机选取5个视野计算平均值。
1.3 统计学分析
2 结果
2.1 MHCC-97H细胞中过表达和敲低GPS2后表达效率检测
过表达GPS2组细胞中GPS2的表达水平显著高于vector组(P<0.01)(图1A、C和E);而shGPS2组细胞中GPS2的表达水平显著低于control组(P<0.05)(图1B、D和F)。qPCR的结果与蛋白印迹的结果趋势基本一致。
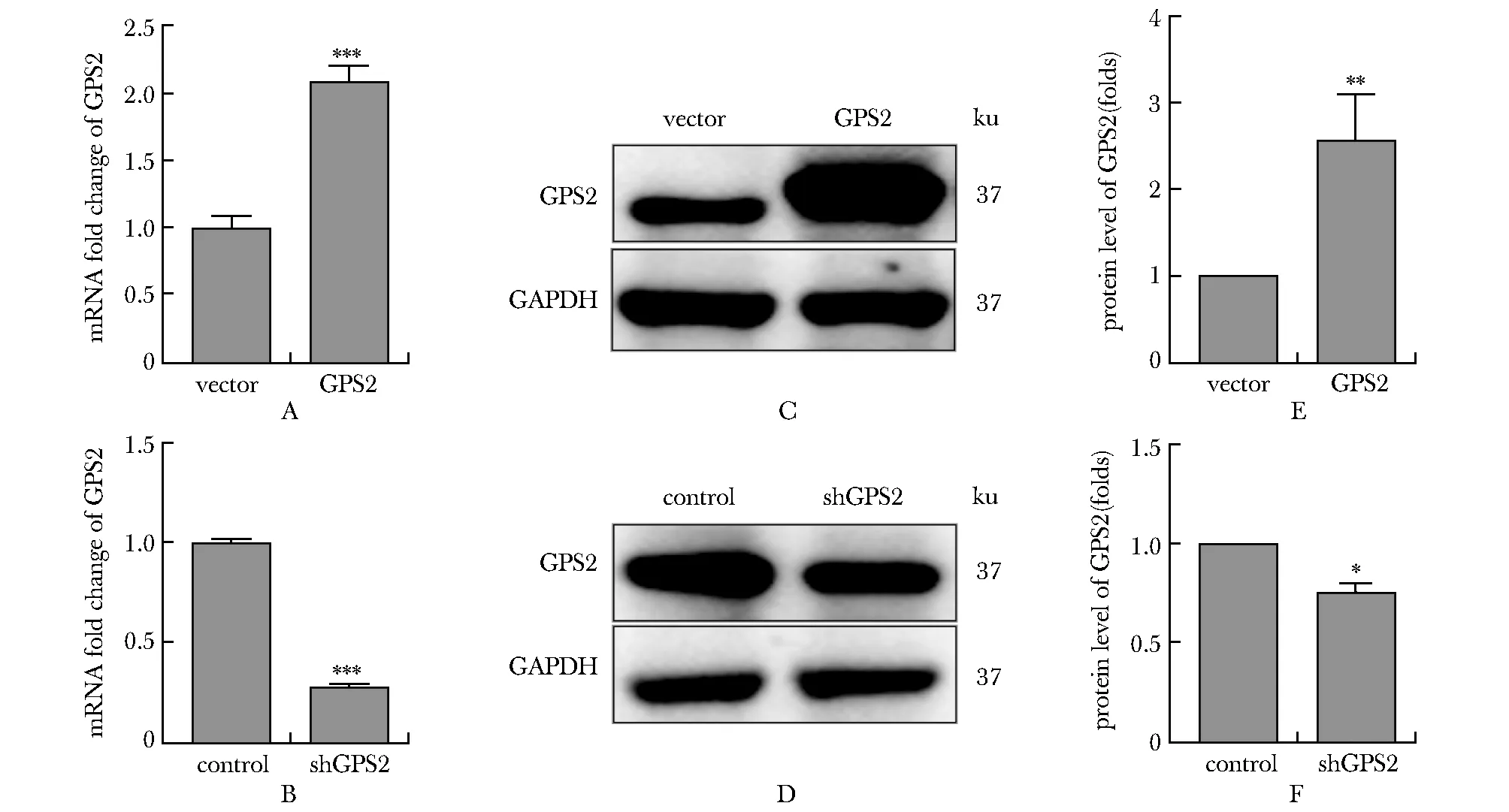
A.mRNA level of GPS2 in vector and GPS2 over-expression group; B.mRNA level of GPS2 in control and shGPS2 group; C.the expression of GPS2 protein was measured by Western blot in vector and GPS2 over-expression group; D.the expression of GPS2 protein was measured by Western blot in control and shGPS2 group; E protein level of GPS2 in vector and GPS2 over-expression group; F.protein level of GPS2 in control and shGPS2 group;*P<0.05,**P<0.01,***P<0.001 compared with vector or control group.
2.2 GPS2对MHCC-97H细胞增殖的影响
MTT实验结果表明,过表达GPS2能够抑制MHCC-97H细胞的增殖(P<0.05)(图2A),而下调GPS2的表达能够促进MHCC-97H细胞增殖(P<0.05)(图2B)。
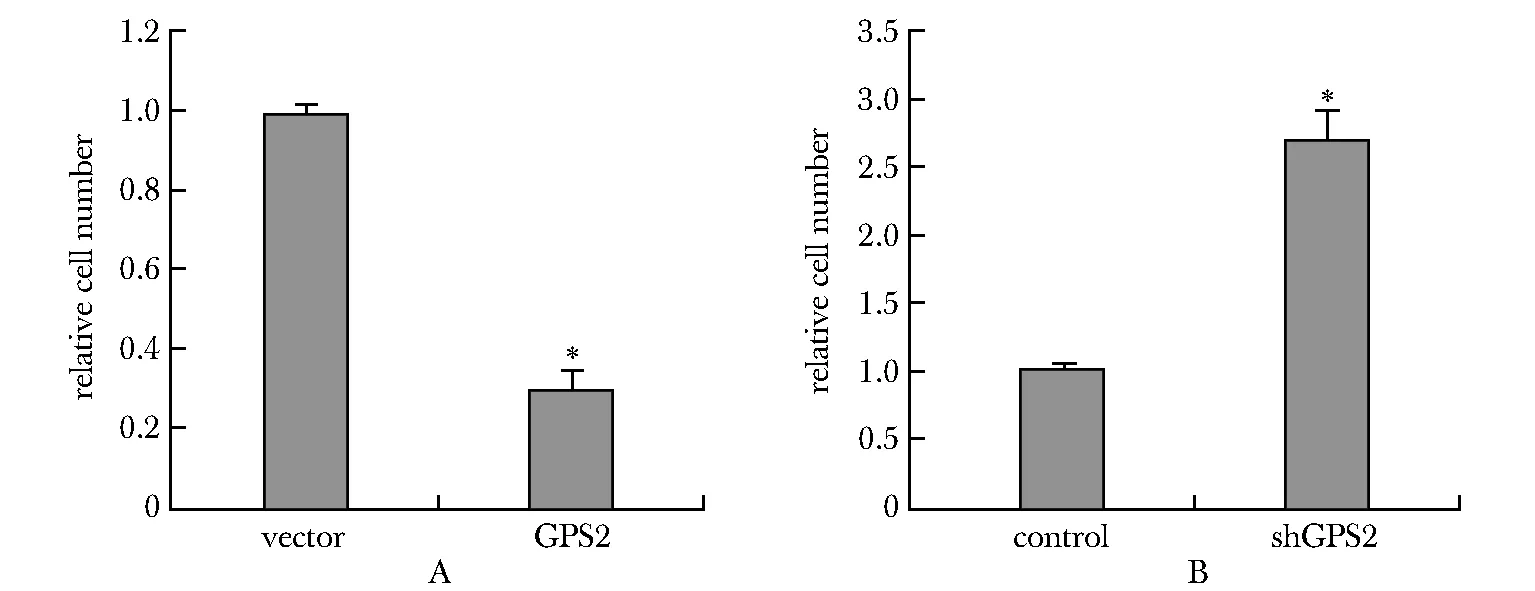
A.MTT assay was used to evaluate the proliferation of MHCC-97H cells in vector and GPS2 over-expression group; B.MTT assay was used to evaluate the proliferation of MHCC-97H cells in control and shGPS2 group;*P<0.05 compared with control group.
细胞集落形成实验结果显示:MHCC-97H细胞能够在6孔板中形成集落(图3),过表达GPS2能够抑制MHCC-97H细胞的集落形成(P<0.05)(图3A),而敲低GPS2则能够促进MHCC-97H细胞的集落形成(P<0.05)(图3B)。
2.3 GPS2对MHCC-97H细胞迁移与侵袭的影响
与vector组相比,过表达GPS2对能够抑制MHCC-97H细胞从划痕两侧向中心迁移(P<0.05)(图4A);而敲低GPS2能够促进MHCC-97H细胞迁移(P<0.05)(图4B)。
Transwell侵袭实验结果显示,MHCC-97H细胞能够降解Transwell小室中的Matrigel胶发生侵袭作用(图5)。过表达GPS2能够抑制MHCC-97H细胞的侵袭(P<0.01)(图5A);敲低GPS2能够促进 MHCC-97H细胞的侵袭作用(P<0.05)(图5B)。
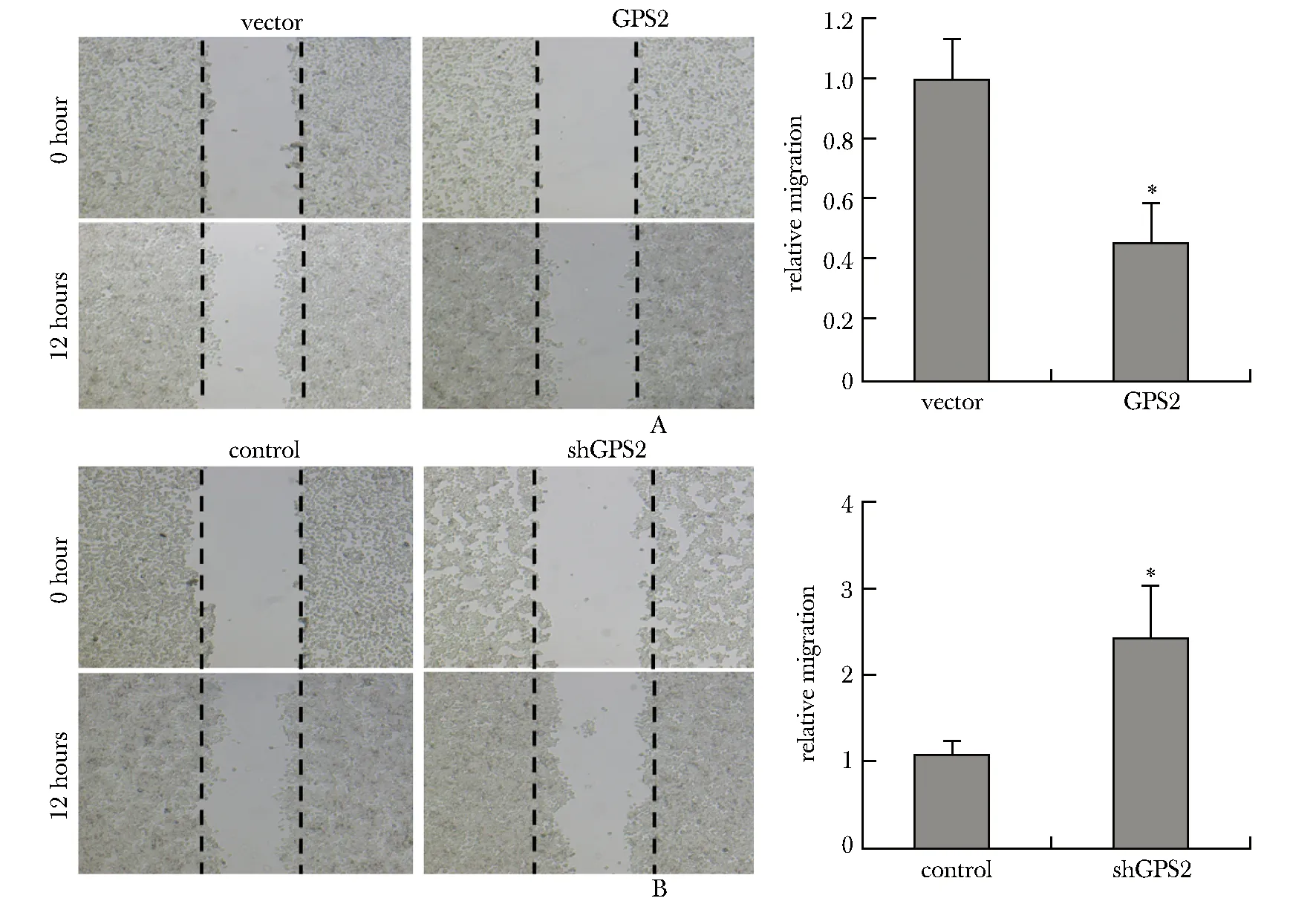
A.cell scratch assay was used to detect the migration of MHCC-97H cells in vector and GPS2 over-expression group; B.cell scratch assay was used to detect the migration of MHCC-97H cells in control and shGPS2 group;*P<0.05 compared with vector or control group.

A.Transwell assay was used to detect the invasion of MHCC-97H cells in vector and GPS2 over-expression group; B.Transwell assay was used to detect the invasion of MHCC-97H cells in control and shGPS2 group;*P<0.05,**P<0.01 compared with vector or control group.
2.4 GPS2对MHCC-97H细胞增殖、迁移与侵袭调控分子机制初步研究
qPCR检测HCC细胞增殖、迁移与侵袭相关因子的表达水平。结果显示:过表达GPS2能够显著降低EGFR、MMP1、MMP3、MMP9的表达水平(P<0.05)(图6A);而敲低GPS2的表达能够显著上调EGFR、MMP1、MMP3、MMP9的表达水平(P<0.05)(图6B)。
Western blot检测HCC细胞增殖、迁移与侵袭相关因子EGFR蛋白表达水平。结果显示:过表达GPS2能够显著降低EGFR蛋白表达水平(P<0.05)(图7A);而敲低GPS2的表达能够显著上调EGFR蛋白表达水平(P<0.05)(图7B)。
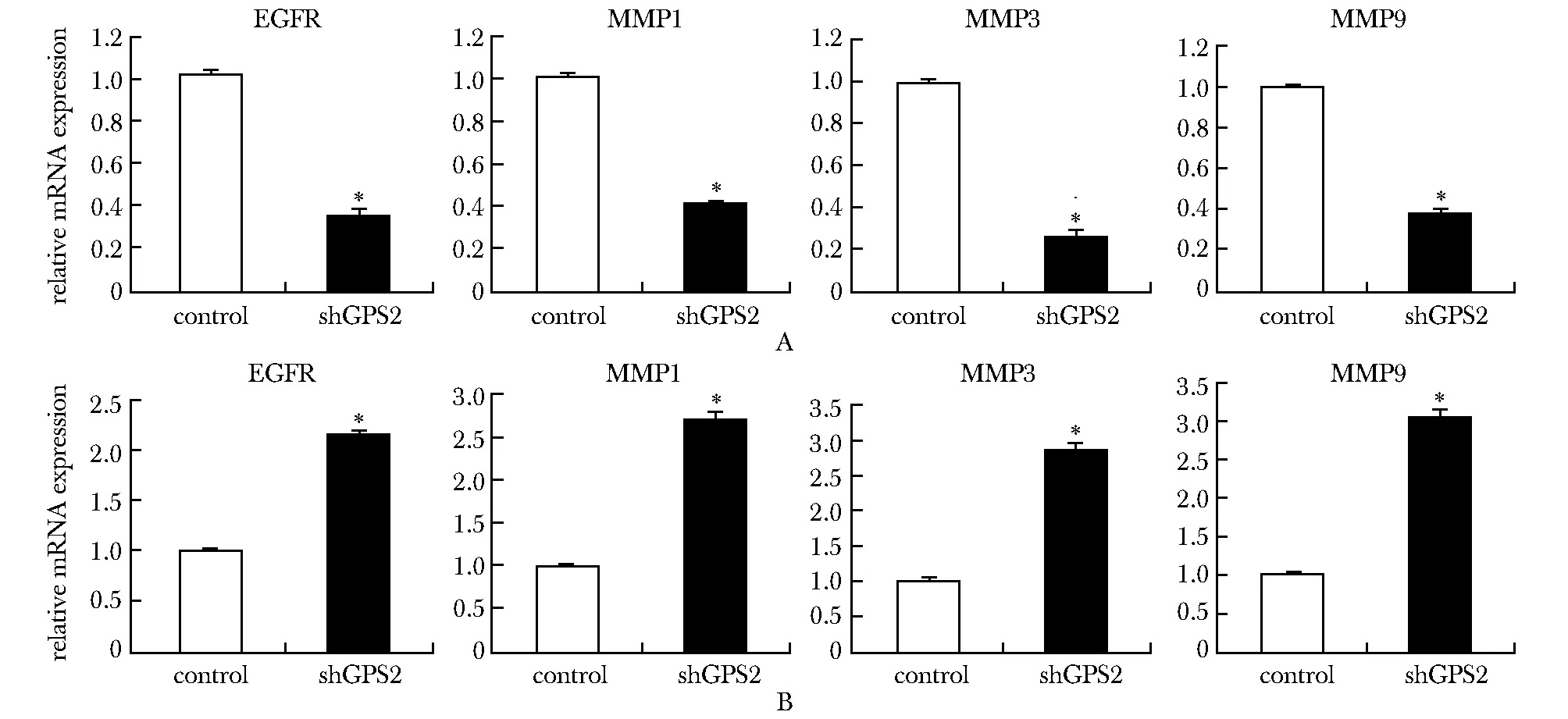
A.mRNA expression of EGFR,MMP1,MMP3 and MMP9 in vector and GPS2 over-expression group; B.mRNA expression of EGFR,MMP1,MMP3 and MMP9 in control and shGPS2 group.
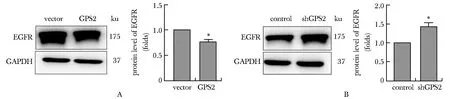
A.the expression of EGFR protein in vector and GPS2 over-expression group; B.the expression of EGFR protein in control and shGPS2 group.*P<0.05 compared with control group.
3 讨论
进展期HCC是胃肠消化系统恶性肿瘤的研究热点,以Sorafenib为代表的分子靶向药物(口服小分子)仍是进展期HCC治疗的主要策略之一,这些药物干预的靶点主要是VEGFR等受体酪氨酸蛋白激酶以及Raf等MAPK、PI3K/AKT 通路的蛋白激酶[10-11]。这些靶点已研究和应用多年潜力有限,因此研究新的更为有效的靶点不仅能够为患者提供新的选择,也对相关研究具有重要意义。GPS2作为一种新的肿瘤抑制因子,已成为肿瘤领域的研究热点。最近的研究发现,GPS2是胃癌[8-9]、乳腺癌[12]、转移性葡萄膜黑色素瘤[13]、脂肪肉瘤[14]的抑制因子,同时,有报道还发现GPS2的缺失与多形性胶质母细胞瘤和未分化梭形细胞肉瘤[15]的发生有关,但是GPS2在HCC发生发展中的作用及分子机制尚不明确。本研究采用“慢病毒感染——药物筛选法” 对肝癌MHCC-97H进行感染, 建立稳定表达GPS2或GPS2敲低细胞株用于研究GPS2在HCC中的功能以及可能作用机制,研究结果显示GPS2蛋白过表达可以抑制肝癌细胞增殖、降低迁移和侵袭能力。GPS2能够下调EGFR在MHCC-97H细胞中的表达水平同时抑制MMP1、MMP3和MMP9的表达水平。这些因子中, EGFR是细胞增殖、迁移与侵袭的重要调节因子;MMP1、MMP3以及MMP9则与HCC细胞侵袭密切相关。EGFR等能够通过MAPK、AKT等下游蛋白激酶直接促进HCC细胞增殖。现有HCC分子靶向药物主要关注于VEGFR等,而对EGFR的关注较少。HCC细胞能够通过表达MMP1、MMP3以及MMP9等直接破坏细胞在原发部位的基底膜和组织微结构,最终通过血管和淋巴管转移至其他部位。GPS2能够抑制这些因子的表达,有望为肝癌个体化治疗和抗肿瘤药物的开发提供新的方向。
