亚临界水提取南瓜皮多糖工艺优化及其抗氧化能力
2023-12-08刁山山张雨冯浩马菁雯韩蕈泽王祎茗姜园雪赵婧
刁山山,张雨,冯浩,马菁雯,韩蕈泽,王祎茗,姜园雪,3,赵婧,3*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.国家果蔬加工工程技术研究中心,农业农村部果蔬加工重点实验室,北京市食品非热加工重点实验室,北京 100083;3.四川成都中农大现代农业产业研究院,四川 成都 611400)
南瓜(CucurbitamoschataDuchesne)是葫芦科南瓜属一年生蔓生草本植物,在世界各地均有广泛种植。根据联合国粮农组织2021年公布的数据显示,全世界南瓜种植面积超过153 亿m2,产量已超过2 290 万t[1]。南瓜营养价值高,富含淀粉、脂肪、还原糖、维生素、氨基酸、胡萝卜素、黄酮和矿物质等营养成分[2]。南瓜皮是南瓜加工的废弃物,具有很高的营养价值,其中富含多糖、黄色素、胡萝卜素等功能性物质[3-5],但其利用率低,易造成资源大量浪费和环境污染[6]。
南瓜皮中含有丰富的碳水化合物,而南瓜皮多糖具有良好的抗氧化、抗疲劳等功效[7-8]。南瓜皮多糖的常用提取方法有热水浸提、超声波辅助提取、微波辅助提取、离子交换法和酶法提取等[6-8],但这些方法存在提取效率低和耗能高等问题。亚临界水指在一定压力条件下,将水加热至100~374 ℃范围内,水体仍然保持液态,随着温度升高,水分子热运动加剧,水的介电常数迅速降低,水极性逐渐由强极性变为非极性,从而通过改变压力和温度选择性提取极性不同的化合物[9-10],是一种高效低耗能的绿色提取技术。升高压力可以促使水渗透到基质中加快提取,同时,高温会破坏多糖和固体基质间的氢键,促进多糖溶出,加快提取[11]。此外,亚临界水对分子结构具有修饰和改性作用,可以提高多糖的生物活性[12]。该技术具有环境友好、高提取率、操作简单等优点,可应用于多糖工业化生产[13]。本研究拟优化亚临界水提取南瓜皮多糖的工艺,并对南瓜皮多糖的理化性质进行探究,旨在为废弃南瓜皮的开发利用提供新思路。
1 材料与方法
1.1 材料与试剂
南瓜皮(广蜜1 号):广东省农业科学院。
无水乙醇:北京蓝弋化工产品有限责任公司;D-葡萄糖、咔唑、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picryl-hydrazyl radical,DPPH)、硝基苯基-β-D-吡喃半乳糖苷、α-淀粉酶(10.48 U/mg)、α-葡萄糖苷酶(40.60 U/mg):北京索莱宝科技公司;D-半乳糖醛酸、岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、果糖、核糖、半乳糖醛酸、葡萄糖醛酸标准品(纯度均≥98%):上海源叶生物科技有限公司;浓硫酸、苯酚、三氯甲烷、正丁醇、H2O2:国药集团化学试剂有限公司。以上试剂均为分析纯。
1.2 仪器与设备
YZPR-500 型高压反应釜:上海岩征实验仪器有限公司;JR-200 型高速多功能粉碎机:永康市云达机械设备厂;LGJ-25C 型冷冻干燥机:北京四环福瑞科仪科技发展有限公司;CF16RXⅡ型离心机:日本日立有限公司;HJ-4A 型磁力搅拌器:常州迈科诺仪器有限公司;UVmini-1240 型分光光度计、LC-10A 型高效凝胶渗透色谱仪:日本岛津科学仪器公司;Nicolet iN10-iZ10 型傅里叶变换红外光谱仪、ICS5000 型高效液相色谱仪:美国赛默飞世尔科技公司。
1.3 亚临界水法提取南瓜皮多糖
1.3.1 南瓜皮制粉
新鲜南瓜取皮,冷冻干燥后用粉碎机打成粉末,过100 目筛,4 ℃储藏备用。
1.3.2 高压反应釜处理
选定料液比(g/mL),用高温玻璃杯盛装,用氮气瓶给高压反应釜加压,设定好反应温度以及转子速度后开始反应。
1.3.3 提取工艺流程
将高压反应釜处理所得溶液冷却后倒入离心瓶内,10 000×g离心15 min,收集上清液并使用Sevage试剂[氯仿∶正丁醇=1∶3(体积比)]去除蛋白,浓缩后加入无水乙醇进行醇沉(80%乙醇终浓度),4 ℃条件下静置12 h。之后在10 000 ×g下离心15 min,收集沉淀,加少量水用磁力搅拌器溶解,将溶液倒入透析袋(3 500 Da)中,4 ℃条件下持续透析3 d,每8 h 换1 次水。透析结束后用冻干机将多糖溶液冷冻干燥,得到固体南瓜皮多糖,收集南瓜皮多糖并称量计算得率。南瓜皮多糖得率(W,%)计算公式如下。
式中:m为固体南瓜皮多糖质量,mg;M为南瓜皮质量,mg。
1.4 优化试验设计
1.4.1 单因素试验
以冷冻干燥所得的南瓜皮粉为原料,分别考察亚临界水提取温度(100、120、140、160、180 ℃)、提取时间(4、6、8、10、12 min)、提取压力(1、3、5、7、9 MPa)和料液比[1∶20、1∶30、1∶40、1∶50、1∶60(g/mL)]对南瓜皮多糖得率的影响。
1.4.2 响应面试验
在单因素试验的基础上,由于料液比对南瓜皮提取率影响较小,因此选取提取温度、提取时间和提取压力为自变量,以南瓜皮多糖得率为响应值进行响应面优化试验,试验设计见表1。

表1 响应面试验因素水平Table 1 Factors and levels of response surface experiments
1.5 南瓜皮多糖成分测定分析
1.5.1 基本成分测定
对于分离得到的南瓜皮粗多糖进行化学组分分析。采用苯酚-硫酸法测定总糖含量[14];采用硫酸-咔唑法测定糖醛酸含量[15];采用Lowry 法测定蛋白质含量[16];采用福林酚比色法测定总酚含量[17]。
1.5.2 红外光谱检测
采用KBr 压片法对南瓜皮多糖进行红外光谱分析。将KBr 粉末在烘箱中烘至恒重。取2 mg 经冷冻干燥的南瓜皮多糖样品,与干燥的KBr 粉末混合,在玛瑙研钵中研磨均匀,所得粉末用压片机压成薄片。将空白的KBr 薄片通过傅里叶变换红外光谱仪进行背景扫描,再将含有多糖样品的KBr 薄片进行红外光谱扫描,扫描波长范围为4 000~400 cm-1,分辨率4 cm-1,扫描64 次。
1.6 分子量测定
使用配备BRT105-104-102 色谱柱(8.0 mm×30.0 cm)和折射率检测器的高效凝胶渗透色谱仪测定多糖的分子量[18]。制备葡萄糖标准品(5.0、11.6、23.8、48.6、80.9、148.0、273.0、409.8、667.8 kDa)和南瓜皮多糖样品(5 mg/mL)。上清液在10 000×g下离心10 min,离心后浓缩上清液,经0.22 μm 微孔膜过滤。在40 ℃下,以0.8 mL/min 的流速注入样品(20 μL),流动相为NaCl 溶液(0.05 mol/L)。
1.7 单糖组成测定
精密称量5 mg 样品置于安瓿瓶中,加入3 mol/L的三氟乙酸2 mL,120 ℃水解3 h。准确吸取酸水解溶液转移至管中氮吹吹干,加入5 mL 水并涡旋混匀,吸取50 μL 处理液,加入950 μL 去离子水,12 000×g下离心5 min,取上清液(5 μL)进行高效液相色谱分析,色谱柱为DionexCarbopacTMPA20(3.0 mm×150 mm),并与电化学检测器连接。流动相分别为H2O 和15 mmol/L NaOH,流速为0.3 mL/min,柱温为30 ℃。以岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、果糖、核糖、半乳糖醛酸和葡萄糖醛酸为标准品对照分析[19]。
1.8 理化性质的测定
1.8.1 DPPH 自由基清除能力测定
根据Zhang 等[20]的方法测定南瓜皮多糖样品的DPPH 自由基清除能力,并稍作修改。取8 mg DPPH 用少量无水乙醇溶解后,转移至100 mL 容量瓶中定容,即得到浓度为0.2 mmol/L 的DPPH-乙醇溶液。取2 mL不同浓度南瓜皮多糖溶液(1.0、2.0、3.0、4.0、5.0 mg/mL),加入2 mL DPPH-乙醇溶液,混匀,避光反应30 min 后在波长517 nm 处测吸光度A1;以蒸馏水替代多糖溶液作空白组,测定其吸光度A0;以无水乙醇溶液替代DPPH-乙醇溶液作对照,测定其吸光度A2。同样的方法以抗坏血酸(VC)作为阳性对照。DPPH 自由基清除率(M,%)的计算公式如下。
M=[1-(A1-A2)/A0]×100
1.8.2 羟基自由基清除能力测定
根据Sun 等[21]的方法测定南瓜皮多糖样品的羟基自由基清除能力,并稍作修改。取1 mL 蒸馏水,依次加入9 mmol/L 硫酸亚铁1 mL,9 mmol/L 水杨酸-乙醇溶液3 mL,最后加入1 mL 8.8 mmol/L 的H2O2启动反应。室温下反应30 min,在波长510 nm 处测定其吸光度A0;取不同浓度的南瓜皮多糖溶液(0.4、0.8、1.2、1.6、2.0 mg/mL)1 mL 替代蒸馏水,测定吸光度A1;用无水乙醇替代水杨酸-乙醇溶液,测定其吸光度A2。同样的方法以抗坏血酸(VC)作为阳性对照。羟基自由基清除率(N,%)的计算公式如下。
N=[1-(A1-A2)/A0]×100
1.8.3 α-葡萄糖苷酶抑制能力测定
参考Yue 等[22]的方法并稍作修改,取1.0 mL 不同浓度的多糖溶液(1.0、2.0、3.0、4.0、5.0 mg/mL),分别加入0.2 mL α-葡萄糖苷酶溶液(酶活为3.75 U/mL)和0.2 mL 对硝基苯基-β-D-吡喃半乳糖苷溶液(6 mmol/L),在37 ℃条件下水浴加热30 min,再加入6.0 mL 碳酸钠溶液(0.1 mol/L)终止反应并冷却至室温。在400 nm处测得吸光度A1;用磷酸盐缓冲液替换南瓜皮多糖溶液测得吸光度A2;将酶溶液替换为PBS 缓冲液,测得吸光度A3;样品溶液与酶溶液均替换为PBS 缓冲液,测得吸光度A4。同样的方法以阿卡波糖作阳性对照,所有溶剂使用PBS 缓冲液(0.1 mol/L,pH7.0)。α-葡萄糖苷酶抑制率(X,%)的计算公式如下。
X=[1-(A1-A3)/(A2-A4)]×100
1.8.4 α-淀粉酶抑制能力测定
采用李东文等[23]的方法并略作修改,取1.0 mL 不同浓度的多糖溶液(1.0、2.0、3.0、4.0、5.0 mg/mL),加入0.3 mL α-淀粉酶溶液(酶活为6 U/mL)和0.4 mL 1%可溶性淀粉溶液,在37 ℃条件下水浴加热5 min,加入1 mL 3,5-二硝基水杨酸溶液显色,立即在沸水浴中反应10 min。冷却至室温后,在540 nm 处测得吸光度A1;用磷酸盐缓冲液替换南瓜皮多糖溶液测得吸光度A2;将酶溶液替换为PBS 缓冲液,测得吸光度A3;样品溶液与酶溶液都替换为PBS 缓冲液,测得吸光度A4。同样的方法以阿卡波糖作阳性对照,所有溶剂使用PBS缓冲液(0.1 mol/L,pH7.0)。α-淀粉酶抑制率(Y,%)的计算公式如下。
Y=[1-(A1-A3)/(A2-A4)]×100
1.9 数据处理
使用IBM SPSS 20.0.0 软件对数据进行统计分析,采用origin 2019b 软件对数据进行处理,并采用Design-Expert.V 8.0.6.1 软件进行响应面优化分析。
2 结果与分析
2.1 单因素试验结果
2.1.1 提取温度对南瓜皮多糖得率的影响
提取温度对南瓜皮多糖得率的影响见图1。
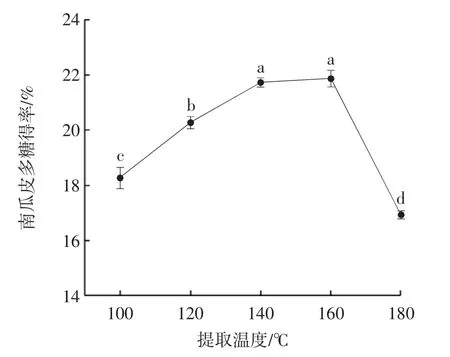
图1 亚临界水提取温度对南瓜皮多糖得率的影响Fig.1 Effect of subcritical water extraction temperature on the yield of pumpkin peel polysaccharide
由图1 可知,随着提取温度升高,南瓜皮多糖得率逐渐增加,当超过160 ℃后,得率显著下降。温度升高会加快溶剂分子和溶质分子的运动、促进扩散,有利于提高提取率,而温度过高则会导致多糖降解,同时生成一些有害物质[20],低温则不能有效地将多糖提出。而在140 ℃时,虽略低于160 ℃时的提取率,但没有显著性差异且耗能更低。因此,最佳提取温度为140 ℃,此时提取率为21.73%。
2.1.2 提取时间对南瓜皮多糖得率的影响
提取时间对南瓜皮多糖得率的影响见图2。
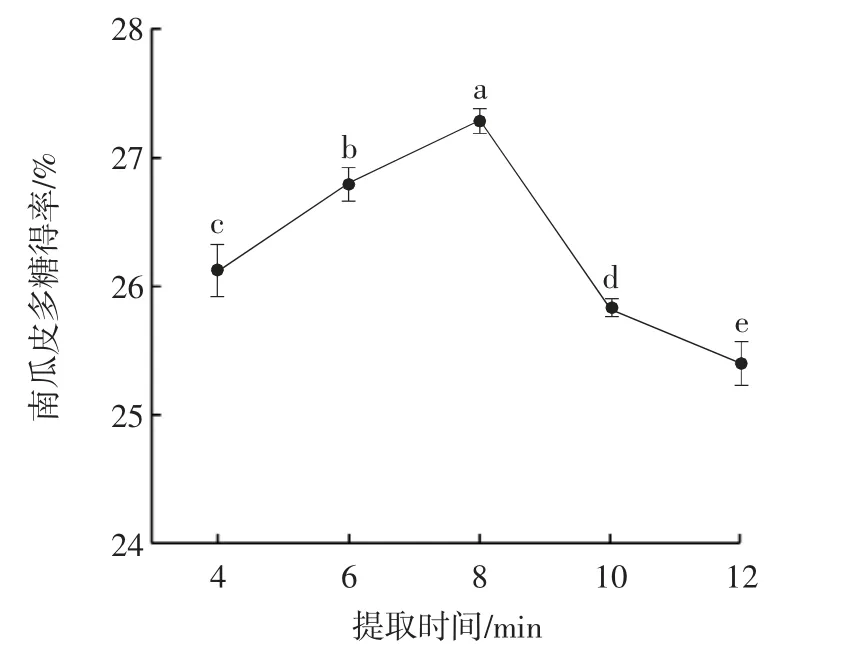
图2 亚临界水提取时间对南瓜皮多糖得率的影响Fig.2 Effect of subcritical water extraction time on the yield of pumpkin peel polysaccharide
由图2 可知,随着提取时间的延长,南瓜皮多糖得率呈现先上升后下降的趋势。提取时间为8 min 时,南瓜皮多糖得率最高,达到27.30%。从南瓜皮中提取多糖是固液提取,充足的提取时间能保证固液相充分接触,使溶剂渗入到细胞中,有利于传质过程,而时间过长,则会使得多糖由于热不稳定性而降解[20]。因此,最佳提取时间为8 min。
2.1.3 提取压力对南瓜皮多糖得率的影响
提取压力对南瓜皮多糖得率的影响见图3。
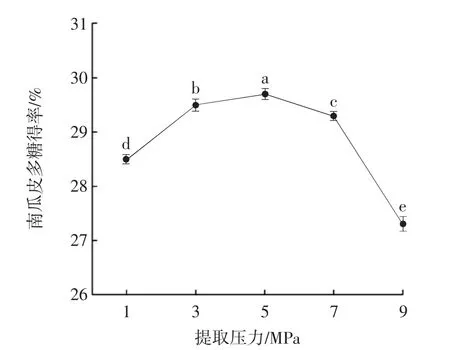
图3 亚临界水提取压力对南瓜皮多糖得率的影响Fig.3 Effect of subcritical water extraction pressure on the yield of pumpkin peel polysaccharide
由图3 可知,随着提取压力升高,南瓜皮多糖得率呈先上升后下降得趋势。结果表明,提取压力在5 MPa时,南瓜皮多糖得率最高。主要原因是压力能够促进溶剂渗入细胞,有利于传质过程,升高压力会加快溶剂渗入,相同时间下提取率更高。而压力过高则会导致多糖链断裂使多糖发生降解[24]。因此,选择提取压力为5 MPa,此时的提取率为29.70%。
2.1.4 料液比对南瓜皮多糖得率的影响
料液比对南瓜皮多糖得率的影响见图4。
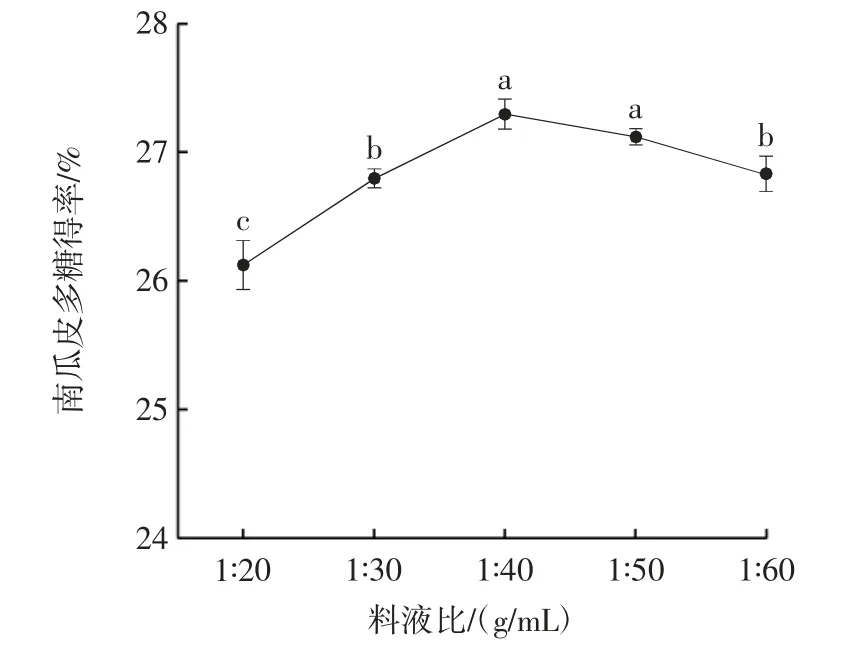
图4 料液比对南瓜皮多糖得率的影响Fig.4 Effect of solid-to-liquid ratio on the yield of pumpkin peel polysaccharide
由图4 可知,随着反应溶液体积的变化,南瓜皮多糖得率在料液比为1∶40(g/mL)时最高为27.31%。溶液体积的变化可以影响固液相是否充分结合,从而影响南瓜皮多糖的得率。当固相原料过多时,导致固液相混合不均匀,无法充分接触,导致南瓜皮多糖不能被充分提取出来。而当固相原料过少时,使得提取液中南瓜皮多糖浓度较低,后续试验过程中损失增加,最终使得南瓜皮多糖得率下降[24]。因此,最佳料液比为1∶40(g/mL)。
2.2 响应面试验分析
响应面试验结果见表2。
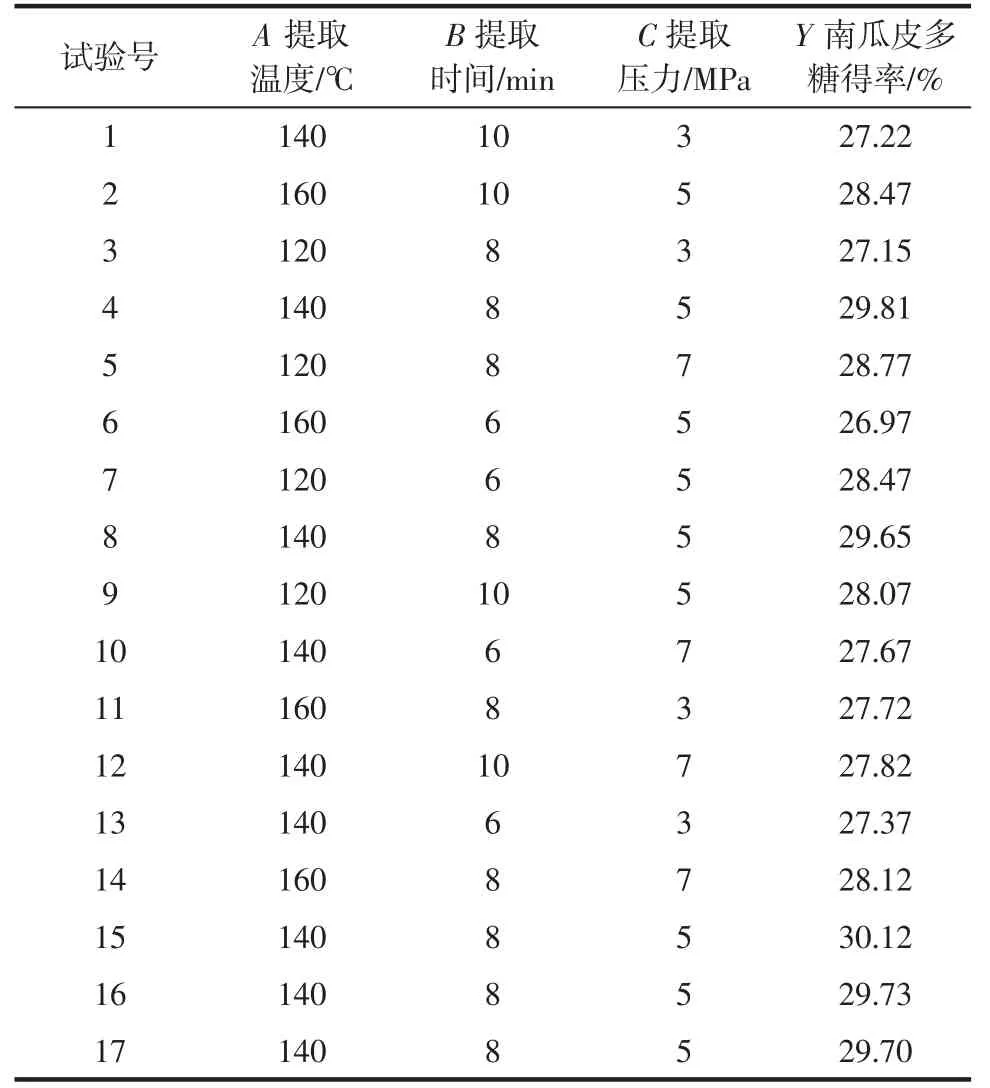
表2 响应面试验结果Table 2 Response surface optimization results
以南瓜皮多糖得率为因变量,以提取温度、时间和压力3 个因素进行响应面优化试验,对试验结果进行二次多元回归拟合,结果见表3,得到方程:Y=29.80-0.15A+0.14B+0.37C+0.47AB-0.31AC+0.075BC-0.69A2-1.11B2-1.17C2。
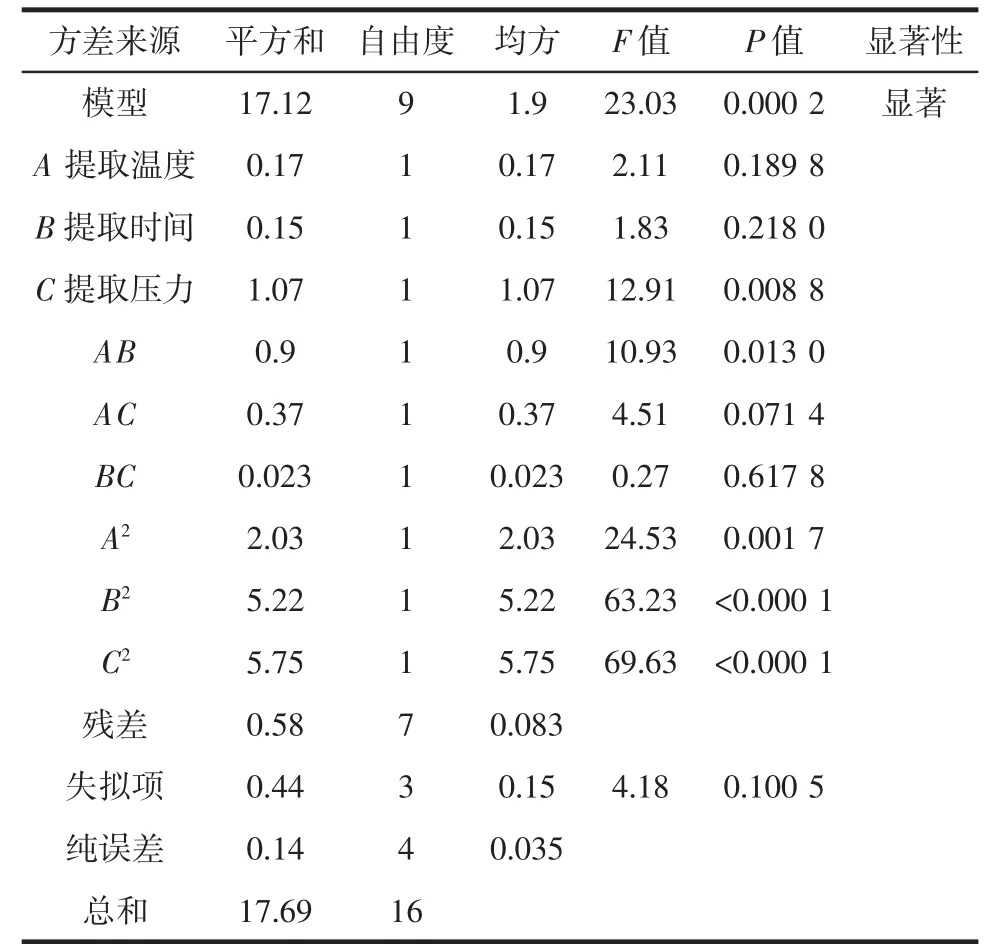
表3 响应面二次模型的变量回归分析Table 3 Quadratic regression model of response surface experiment results
由表3 可知,方程F值为23.03,P值为0.000 2,模型显著,相关系数R2=0.967 3,表明方程与实际试验拟合性好,可以有效地反映不同提取方法对南瓜皮多糖得率的影响。
由表3 可知,因素影响大小顺序为提取压力>提取温度>提取时间,因此预测最佳提取条件为提取温度为137.39 ℃、提取时间为8.08 min、提取压力为5.35 MPa,此时的南瓜皮多糖得率为29.846 3%。
根据单因素试验和响应面优化试验得到的最佳提取工艺条件提取南瓜皮多糖,并进行验证试验,其得率为(29.85±0.13)%,与预测值(29.846 3%)接近。因此,采用此条件提取得到的南瓜皮得率较高。此外,亚临界水提取南瓜皮多糖与传统水提(3.52%)、超声波辅助提取(4.43%)、微波辅助提取(4.52%)、离子交换法(18.57%)、酶法(16.30%)、超声波辅助半纤维素酶法(11.21%)和微波辐射提取法(16.90%)提取南瓜皮多糖相比,提取率显著提高,这可能是由于其高温高压条件,能够更好地将多糖从南瓜皮中提取出来[6,25-29]。
2.3 南瓜皮多糖主要化学组分分析
在上述优化条件下制得南瓜皮多糖,并测定其主要化学组分。亚临界水提取南瓜皮多糖冻干样品中总糖含量为58.00%,糖醛酸含量为17.41%,蛋白质含量为2.01%,总酚含量为0.63%。
2.4 红外光谱分析
南瓜皮多糖的红外光谱见图5。
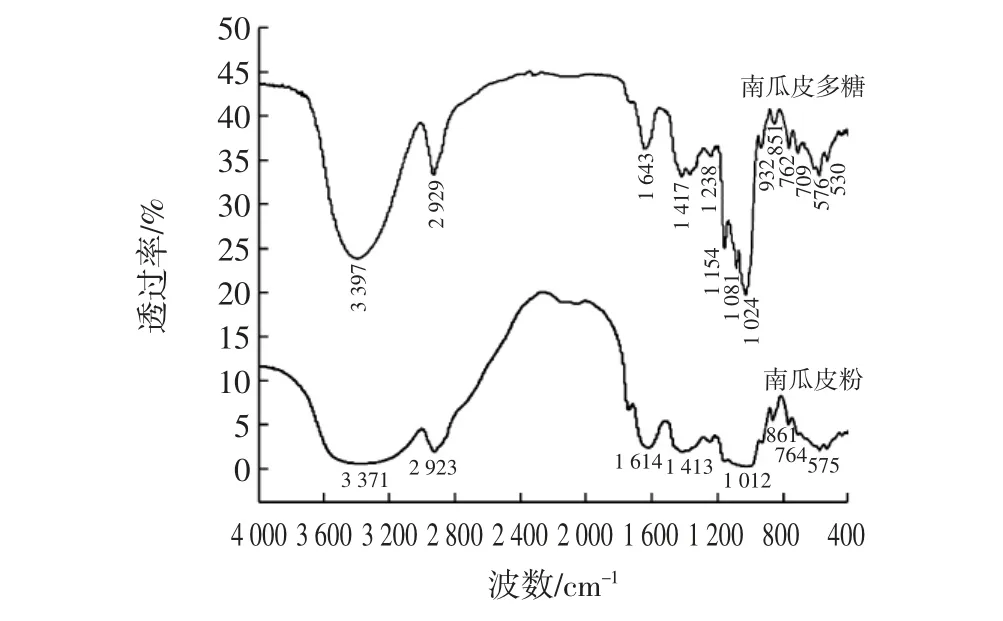
图5 南瓜皮与南瓜皮多糖的红外光谱图Fig.5 FTIR spectra of pumpkin peel and pumpkin peel polysaccharide
从图5 中可以看出,南瓜皮多糖在3 397 cm-1处出现宽吸收峰,是—OH 的伸缩振动,由于多糖分子中有许多羟基,分子内和分子间氢键的形成使该处的峰特别宽,这是多糖物质的典型特征之一;在2 929 cm-1处出现的吸收峰为C—H 键的不对称伸缩振动;在1 643 cm-1出现的吸收峰该分子中的羰基C=O 的伸缩振动,证实了南瓜皮多糖中糖醛酸的存在;在1 417 cm-1出现的吸收峰是C—H 变角振动;在1154、1081、1024cm-1出现的吸收峰是醚键C—O—C 伸缩振动产生的,表明南瓜皮多糖中的糖环为吡喃糖环[1-2]。
2.5 南瓜皮多糖的分子量分析
南瓜皮多糖的高效凝胶渗透色谱图见图6。
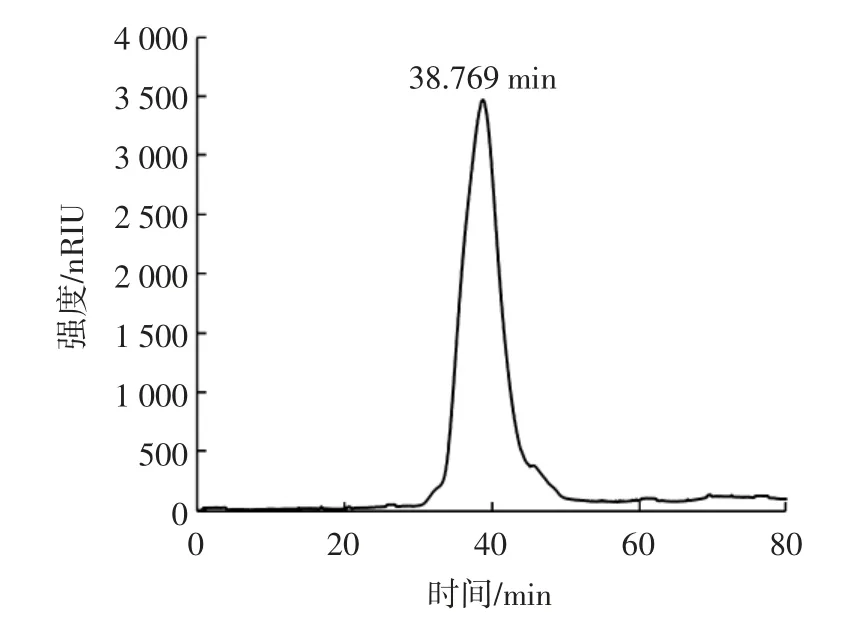
图6 南瓜皮多糖的高效凝胶渗透色谱图Fig.6 High performance gel permeation chromatogram of pumpkin peel polysaccharide
根据不同分子量葡萄糖标准品得到相关方程为Y=-0.176 9X+11.335,R2=0.998 2,其中Y表示多糖标准品的已知相对分子量对数,X表示色谱图上的保留时间。由图6 可知,南瓜皮多糖的出锋时间为38.769 min。将其带入回归方程,得到南瓜皮多糖对应的分子量为29.975 kDa。与其他提取方法相比,亚临界水提取得到的南瓜皮多糖分子量显著降低,这可能是由于高温高压的提取环境导致部分糖苷键断裂,使得多糖具有较低的分子量[8]。
2.6 南瓜皮多糖的单糖组成分析
单糖标准品高效液相色谱图见图7。
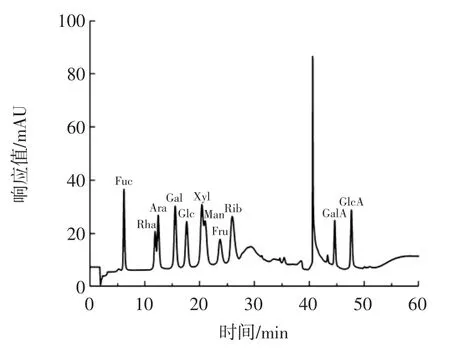
图7 单糖标准品高效液相色谱图Fig.7 HPLC chromatogram of monosaccharide standards
南瓜皮多糖的单糖组成高效液相色谱图见图8。
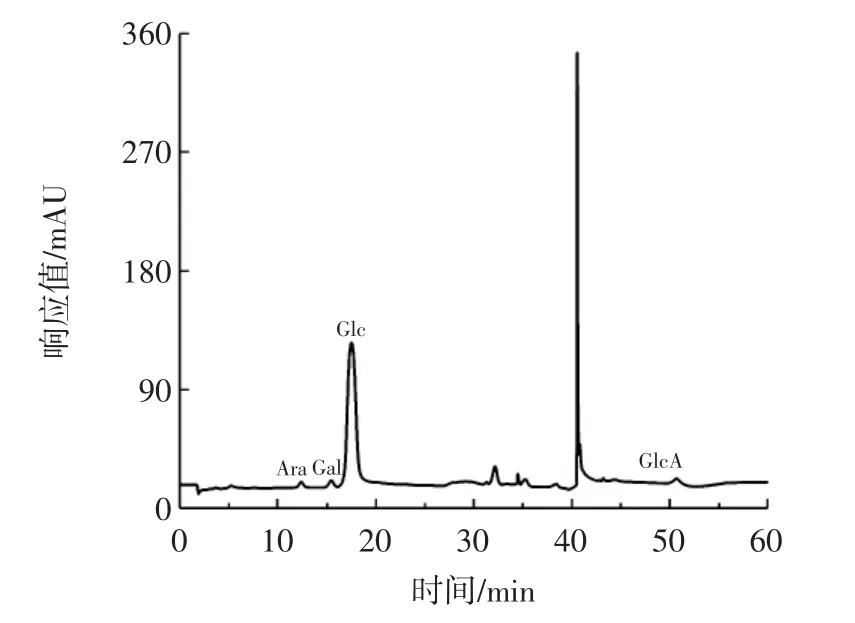
图8 南瓜皮多糖的单糖组成高效液相色谱图Fig.8 HPLC chromatogram of the monosaccharide composition of pumpkin peel polysaccharide
由图8 可知,通过比较保留时间鉴定南瓜皮多糖的单糖组成主要由阿拉伯糖、半乳糖、葡萄糖和葡萄糖醛酸组成,是一种酸性杂多糖,且葡萄糖占比最大。其中,阿拉伯糖、半乳糖、葡萄糖、葡萄糖醛酸之间摩尔质量比为1∶1.053∶50.579∶1.579。
2.7 南瓜皮多糖的抗氧化能力分析
2.7.1 南瓜皮多糖对DPPH 自由基的清除能力
南瓜皮多糖对DPPH 自由基的清除能力见图9。
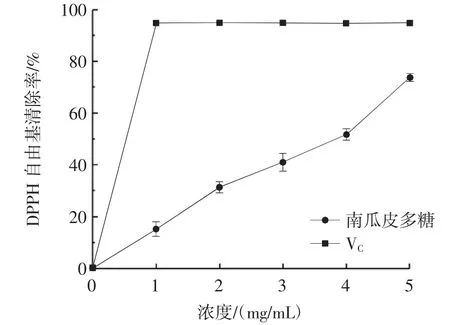
图9 南瓜皮多糖对DPPH 自由基清除率的影响Fig.9 Scavenging rate of pumpkin peel polysaccharide on DPPH free radicals
由图9 可以看出,南瓜皮多糖对DPPH 自由基有一定的清除作用。随着南瓜皮多糖溶液浓度的增大,多糖对DPPH 自由基的清除作用也在不断增强,呈现一定的剂量效应关系。当南瓜皮多糖浓度达到5 mg/mL时,DPPH 自由基的清除率达到73.89%。亚临界水处理降低了南瓜皮多糖的抗氧化能力,这可能与亚临界水提取过程的高温高压环境对多糖的高级结构的影响有关[8]。
2.7.2 南瓜皮多糖对羟基自由基的清除能力
南瓜皮多糖对羟基自由基的清除能力见图10。
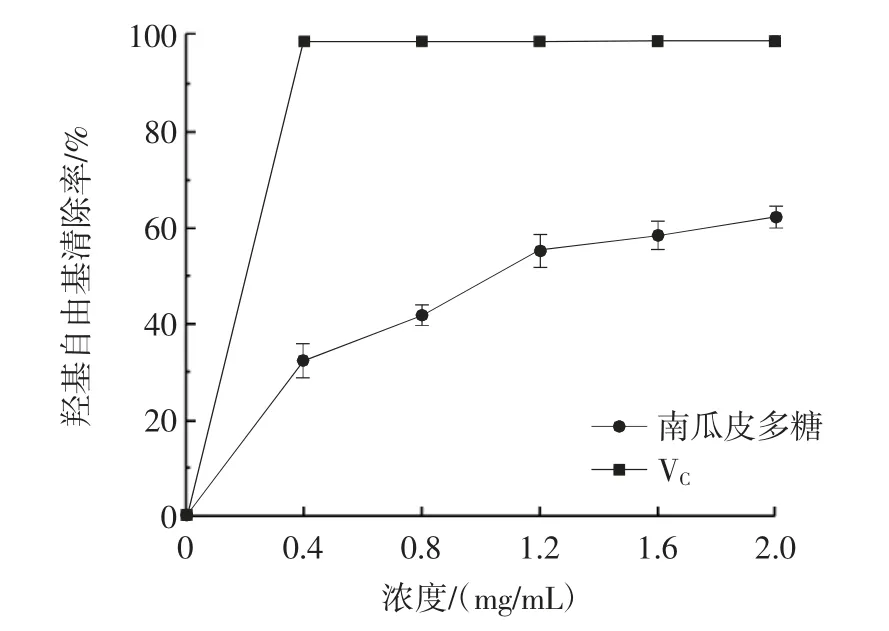
图10 南瓜皮多糖对羟基自由基清除率的影响Fig.10 Scavenging rate of pumpkin peel polysaccharide on hydroxyl free radicals
由图10 可知,南瓜皮多糖对羟基自由基有一定的清除作用。随着南瓜皮多糖溶液浓度的增加,其对羟基自由基的清除作用逐渐增强。当南瓜皮多糖浓度达到2.0 mg/mL 时,羟基自由基清除率达到62.40%。
2.8 南瓜皮多糖的酶抑制能力分析
2.8.1 南瓜皮多糖对α-葡萄糖苷酶的抑制能力
南瓜皮多糖对α-葡萄糖苷酶的抑制能力见图11。
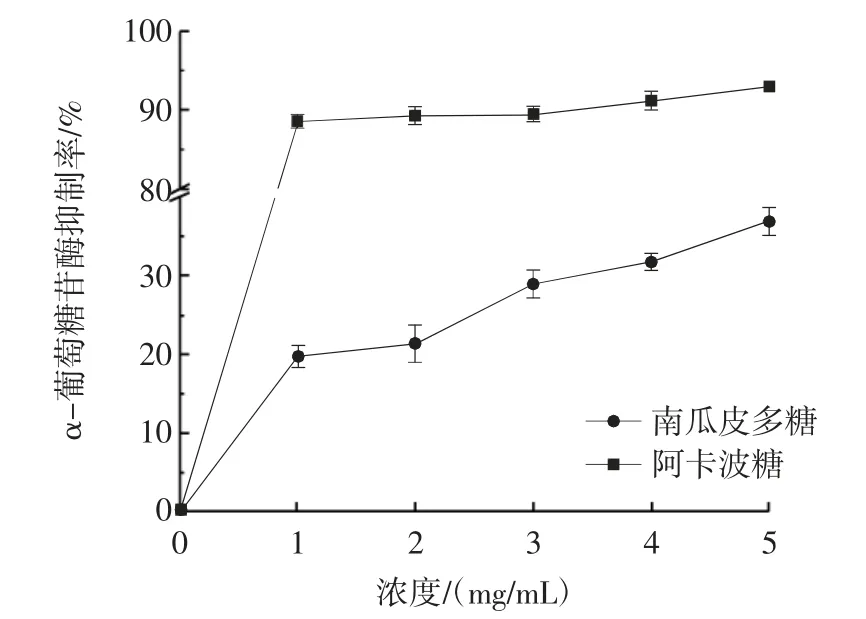
图11 南瓜皮多糖对α-葡萄糖苷酶抑制率的影响Fig.11 Inhibitory effect of pumpkin peel polysaccharide on αglucosidase
由图11 可知,南瓜皮多糖对α-葡萄糖苷酶有一定的抑制作用,并随着南瓜皮多糖浓度的增加而增加。当南瓜皮多糖浓度达到5 mg/mL 时,南瓜皮多糖对α-葡萄糖苷酶抑制率达到36.89%。
2.8.2 南瓜皮多糖对α-淀粉酶的抑制能力
南瓜皮多糖对α-淀粉酶的抑制能力见图12。
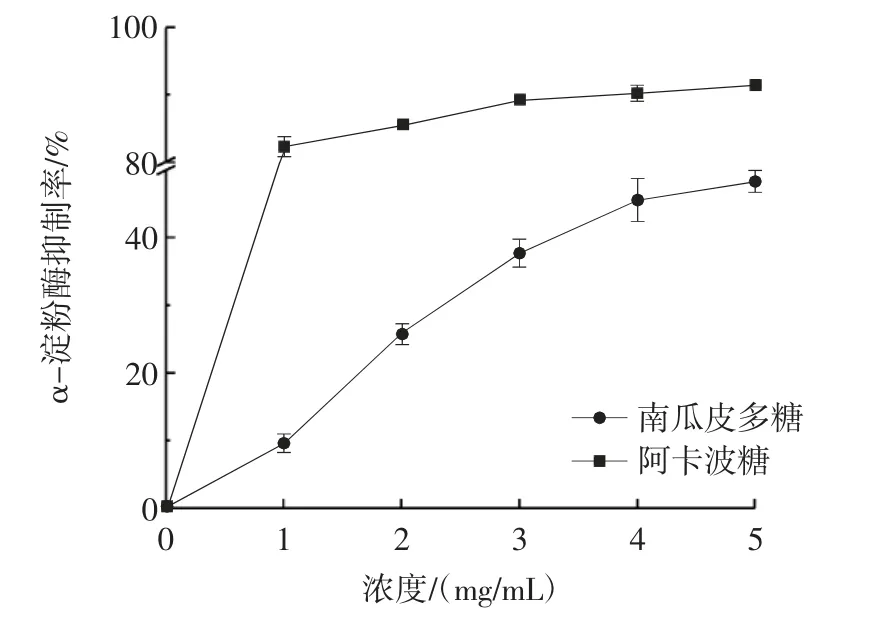
图12 南瓜皮多糖对α-淀粉酶抑制率的影响Fig.12 Inhibitory effect of pumpkin peel polysaccharide on αamylase
由图12 可知,南瓜皮多糖对α-淀粉酶有一定的抑制作用,并随着南瓜皮多糖浓度的增加而增加。当南瓜皮多糖浓度达到5 mg/mL 时,α-淀粉酶的抑制率达到48.46%。当南瓜皮多糖浓度大于4 mg/mL 时,α-淀粉酶的抑制率增长缓慢。
3 结论
本文通过单因素试验和响应面优化试验优化了亚临界水提取南瓜皮多糖的最佳工艺条件,分析了南瓜皮多糖的主要化学成分及单糖组成,评价了其抗氧化能力和对α-淀粉酶与α-葡萄糖苷酶的抑制能力。结果表明,亚临界水提取南瓜皮多糖的最佳工艺条件为提取温度137.39 ℃、提取时间8.08 min、提取压力5.35 MPa,此时的南瓜皮多糖得率为29.846 3%,远高于热水浸提、超声波辅助提取、微波辅助提取方法。亚临界水提取南瓜皮多糖具有耗时短、成本低、无污染等优点,是一种高效可行的提取新技术,易于实现南瓜皮多糖的工业化大规模生产。南瓜皮多糖中总糖含量为58.00%,糖醛酸含量为17.41%,是一种酸性杂多糖。其单糖成分主要由阿拉伯糖、半乳糖、葡萄糖和葡萄糖醛酸组成,分子量为29.975 kDa。此外,南瓜皮多糖具有良好的抗氧化能力和对α-淀粉酶与α-葡萄糖苷酶的抑制能力,表明南瓜皮多糖作为功能性成分在食品领域具有极大的开发潜力。
