儿茶酚胺敏感性多形性室性心动过速1 例
2023-12-07马妍
马妍
(天津市儿童医院(天津大学儿童医院)心脏内科,天津 300314)
儿茶酚胺敏感性多形性室性心动过速(CPVT)是由情绪或运动应激所致室性心律失常的致命性离子通道病,是导致许多心脏形态正常、QT 间期正常的儿童和青少年猝死的原因之一。近年来,随着对该疾病分子遗传学和发病机制、治疗等方面的逐步认识,对该病的理解也在不断深入,本文报道了天津市儿童医院诊断的1 例CPVT 患者,以期增加临床医师对CPVT 的认识,积累诊断及治疗经验。
1 临床资料
患者,男性,7 岁,主因间断“抽搐”、意识障碍、心肺复苏术后2.5 h 入院。患儿入院前2.5 h 玩耍跑步后突然诉头晕,伴呕吐1 次,随即出现“抽搐”,表现为意识丧失,面色苍白,双眼上吊,口唇青紫,四肢强直微抖,持续时间不详,抽后意识不清,送院途中患儿面色苍白加重,到达当地医院就诊时患儿呼吸心跳停止,双侧瞳孔散大固定,大动脉搏动消失,心电监护示“室颤、交替出现等电位线”,立即给予心外按压、气管插管、除颤,“1:10 000 肾上腺素”静脉推注等抢救措施,予电除颤3 次,瞳孔回缩,心电监护下示“窄QRS 心动过速,频率150 次/min”,由120 救护车转送至本院,来院途中间断“抽搐”6~7 次,形式同前,每次持续数秒,发作间期意识持续未恢复。既往史:近2 年反复出现“抽搐”,均为剧烈运动后出现,抽搐前伴头晕,发作时口唇发绀,四肢强直,持续30 s 至1 min 自行缓解,最短间隔1 个月,最长间隔6 个月反复发作,曾于外院就诊行头CT、脑电图及超声心动未见异常。母孕史:孕36+3周顺产,生后可疑窒息史,刺激呼吸后缓解,个人发育史未见异常。入院时查体:发育正常,Glasgow 评分6 分(睁眼2 分、言语1 分、运动3 分),气管插管使用呼吸机时口唇无发绀,可见不规则自主呼吸,面色苍白,双侧瞳孔等大等圆,d=2 mm,光反射存在,双肺可闻及少许痰鸣音,心音低钝,心律不齐,心率160次/min,腹软,四肢肌张力稍高,双侧巴氏征阴性,脉搏弱,末梢湿冷。辅助检查:血气分析(动脉):pH 7.33,PO2:55 mmHg(1 mmHg=0.133 kPa),PCO233 mmHg,碱剩余-7.7 mmol/L。血常规:血红蛋白125 g/L,白细胞15.59×109/L,中性粒细胞87%,淋巴细胞8%,单核细胞5%,血小板315×109/L,C 反应蛋白<8 mg/L。电解质:钠142 mmol/L,钾3.7 mmol/L,钙2.2 mmol/L,血糖17 mmol/L,尿素氮9.4 mmol/L,血肌酐101.4 μmol/L。床旁超声心动示:左室扩大,左心室收缩功能减低,二、三尖瓣反流(轻度),下腔静脉略扩张,短轴缩短率14%,射血分数29%。心电图示:异位心律,双向性室性心动过速(图1)。床旁胸片:心肺膈无显著变化。脑电图示:弥漫性慢波,未见痫样放电。头核磁平扫示:弥漫性异常信号。

图1 双向性室性心动过速
入院后予呼吸机辅助通气,亚低温治疗,入院当天反复心率及血氧饱和度下降,予胸外按压,间断1:10 000 肾上腺素静推维持心率,改善心功能,减轻脑细胞水肿,营养心肌细胞,营养神经,维持水电平衡等对症治疗,住院12 h 未再出现心率下降,心电监护下显示间断出现房性心动过速(图2)、心房扑动、短阵室性心动过速,住院第3 天复查超声心动显示左室收缩功能明显好转,Holter 结果显示异位心律,房性心动过速、心房扑动、心房纤颤、双向性室性早搏、室性心动过速,予美托洛尔口服,间断房性心动过速发作时静点胺碘酮,第4 天复查超声心动显示左心收缩功能正常,入院9 d,患儿体温正常,呼吸衰竭纠正,停用呼吸机治疗,复查Holter结果显示房性心动过速,偶见窦性心律,完全性右束支传导阻滞。患儿仍神志不清,可自发睁眼,无抽搐,双上肢肌张力阵发性增高,呈去大脑强直状态,双下肢无自主活动,共住院18 d,患儿体温正常,神志不清,心电监护及床旁心电图示房性心动过速与窦性心律间断交替出现,心室率维持在80~110 次/min,家属要求外院进一步诊治,自动出院,出院后继予美托洛尔口服。出院后行基因检测,结果显示:患儿系RYR2 基因杂合突变(染色体位置:chr1:237991728):核酸改变c14638G>C(外显子102),氨基酸改变为p.V4880L(图3),父母及患者弟弟基因检测均未见异常。
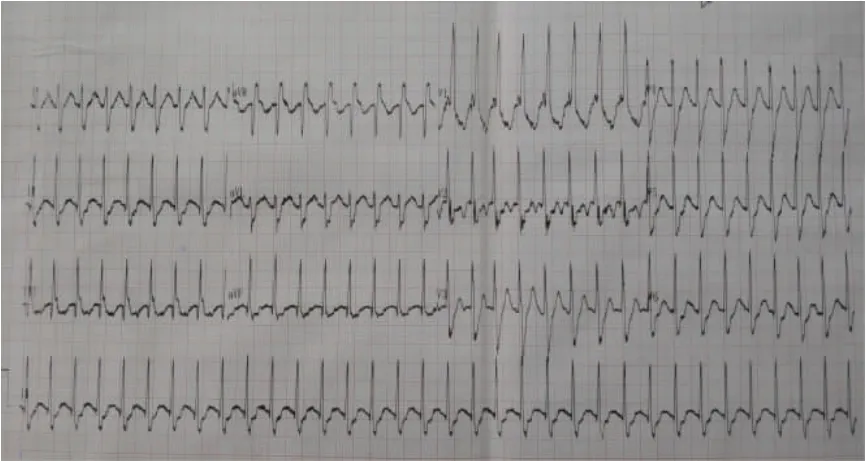
图2 房性心动过速

图3 病例基因检测结果
2 讨论
CPVT 是一种遗传性离子通道病,多发生于无器质性心脏病、QT 间期正常的青少年,平均发病年龄为7~9 岁,以运动或情绪激动诱发双向性室性心动过速(bilateral ventricular tachycardia,bVT)或多形性室性心动过速(polymorphic ventricular tachycardia,pVT),可自行恢复抑或恶化为室颤导致应激性晕厥和猝死为特征,虽报道人群中发病率为1:10 000[1],但心跳骤停可能为CPVT 的首发症状,真实发病率可能被低估。2015 年美国儿科及电生理协会Roston 等[2]对226 例CPVT 患者的研究中发现,患儿首次出现症状事件至明确诊断平均时间达两年,首诊误诊率高达56%,多数情况被误诊为血管迷走性晕厥和癫痫。
CPVT 的主要发病机制与心肌细胞兰尼碱受体(RyR2)功能障碍有关。RyR2 是在肌浆网(SR)膜上表达的大型四聚体蛋白。RyR2 基因是负责肌浆网内钙释放的关键蛋白,该基因突变使心肌细胞上的RyR2 通道对肾上腺素的敏感性增加,肌浆网内的Ca2+漏到细胞内,使细胞浆内的Ca2+浓度增加,激活了细胞内外Na+-Ca2+交换,由此产生的内向电流影响了细胞膜电位的稳定性,继而出现延迟后除极和触发活动增强,诱发恶性室性心律失常。RyR2 通过钙调蛋白(CaLM)、FKBP12.6(calstabin2)、蛋白激酶A(PKA)、磷酸酶1(PP1)、磷酸酶2A(PP2A)等卫星蛋白,与心肌细胞储钙蛋白(CASQ2 基因)结合[3]。CASQ2 突变造成肌质网储存钙离子能力下降,引起Ca2+异常释放,同样会引起延迟后除极的发生。
本文患者基因结果显示为1 号染色体上RYR2基因突变,属于CPVT1 型。CPVT 是常染色体显性遗传,男女发病比1∶1,猝死发生率10%,先证者中约有55%存在RyR2 基因突变,染色体位于1q43。RyR2 基因突变主要集中在RyR2 蛋白3 个区域:N末端、FKBP12.6(FK506 结合蛋白)结合区和C 端跨膜区域,统计结果显示超过90%的突变发生在上述3 个区域内的45 个外显子上。在一项家族性分析中,RyR2 的基因突变一半是新生突变,其余大多数是遗传于先证者母亲。与N 末端区域基因突变者相比,C 端跨膜区域中携带RyR2 突变的病例非持续性室性心动过速的发生概率增加(提示突变位置可能与临床表型的严重程度有关),同时携带RyR2突变的亲属可表现出明显的表型多样性[4]。
RYR2 突变导致CPVT 的分子学发病机制包括以下几种假说:第一种理论认为CPVT 突变使RyR2通道针对肌浆网内钙离子敏感性增加,导致它们在较低的肌浆网内钙浓度下打开,称为存储超载钙诱导的钙释放(SOICR)。根据SOICR 假说,RYR2 的突变降低了激活RYR2 所需的肌浆网钙浓度阈值,从而增加了钙泄漏和舒张期肌浆网钙释放的可能性[5]。一种理论认为RYR2 突变会影响FKBP12.6 与RYR2 相互作用的能力,导致FKBP12.6 的解离和RYR2 通道在舒张期的打开[6]。FKBPs(FKBP12 和FKBP12.6)被认为可以稳定RYR2 的封闭构象,并阻止肌浆网中钙离子的释放,然而,有学者对这一假设提出了质疑,他们认为目前似乎不太可能是FKBP12.6 的缺失导致了CPVT,相反,FKBPs 仍然能够与突变体RyR2 结合,但未能抑制它们[7]。第三个假设关注的是RyR2 结构内的相互作用。通常,分子内相互作用发生在RyR2 单体的N 末端和中心区域之间,称为“拉链”,它对稳定蛋白质至关重要。当RyR2 在兴奋-收缩耦合周期被激活时,分子内的相互作用被削弱,“拉链”拉开结构域,打开通道,从而导致钙泄漏[8]。虽然目前哪一种假说是正确的仍存在争议,但它们都有一个共同点,即CPVT-RYR2相关突变增加了舒张期自发性RYR2 通路和病理性钙释放的可能性。
CPVT 患者轻微的症状包括运动后引起的心悸、头晕,严重者可表现为情绪激动或剧烈运动后应激性晕厥或心脏骤停,这两种症状在儿童或青少年早期最常见。对于这种结果有两种可能的解释,首先是运动的强度,在婴儿期由于运动量不够剧烈,运动时的儿茶酚胺释放量不足以引起CPVT,当孩子们进入学校后,有更多的机会参与到跑步、游泳等大运动量锻炼中,因此发生晕厥的可能性增加。另一种可能就是兰尼碱受体在婴儿期发育不全。如果不进行治疗,CPVT 的临床病程会很严重。大约30%的患者在10 岁之前会出现症状,而大多数(60%~80%)患者在40 岁之前会出现1 次或多次有症状的心律失常发作。监测或诱发(运动或肾上腺素激发试验)记录到的典型bVT 或pVT 是CPVT 非常重要的临床表现。
本病例的临床特点:(1)发病年龄轻。(2)有反复发作性晕厥史,头部影像学及动态脑电图检查均未见异常。(3)静息心电图正常,无长QT 综合征和Brugada 综合征等特征性心电图表现。(4)无心脏结构异常。(5)无电解质紊乱及服用药物史。(6)交感激活状态诱发,均为剧烈运动后及本次入院前心肺复苏过程中给予了外源性儿茶酚胺后出现心律失常,在院外急诊心电监护下可见室性心动过速及室颤,入院后心电监护可见反复发作的双向性室性心动过速。回顾患者的发病全过程后,初步判断CPVT,完善基因检测结果显示RYR2 基因杂合突变(染色体位置:chr1:237991728):c14638G>C(外显子102),最终确诊CPVT。
目前,平板运动试验是诊断CPVT 的重要工具,该试验可重现运动期间急性肾上腺素能激活后心电图的动态变化,可安全有效诱发室性心律失常,具有高度可重复性。杨靖等[9]回顾性分析2006 年9月—2014 年3 月在北京大学人民医院心脏中心临床诊断为CPVT 的15 例患者,结果显示15 例患者行平板运动试验均诱发出室性心律失常。阈值心率为(122.3±26.1)次/min,其中9 例(60.0%)记录到特征性双向室性心动过速,6 例(40.0%)记录到双向室性心动过速和多形室性心动过速。Fujita 等[10]报道了11 岁和15 岁的姊妹分别在其10 岁和12 岁时因运动和情绪紧张出现频繁晕厥的情况,休息时12 导联心电图未见异常,她们最初被诊断为直立调节障碍和癫痫。由于反复运动引起的晕厥,接受进一步心脏检查。在平板运动试验中,11 岁女童诱发出双向室性心动过速,并进展为室颤,而15 岁女童诱发出多形性室性心动过速,最终均被诊断为CPVT。
已有报道显示,CPVT 并不总是局限于儿茶酚胺诱发的心室异常活动,窦性心动过缓、房性心律失常(包括多灶性房性心动过速、心房扑动、心房纤颤)可能也是该病的一部分临床表现[11-12]。本病例在典型双向室性心动过速、室颤后出现了长时间非持续性房性心动过速。事实上,针对CPVT 患者的电生理学和组织学研究已经证实,至少在CPVT 患者的亚群中存在窦房结功能障碍、室上性心律失常(如房性心动过速、心房纤颤和心房扑动)。在临床上也可以观察到,在携带RYR2 突变的幼儿中,房性快速心律失常甚至可能早于典型的室性快速心律失常出现[13]。Sumitomo 等[12]对8 例CPVT 患者进行电生理检查,发现4 例患者窦房结恢复时间[(1 389±394)ms]略有延长。有3 例患者在电生理检查中出现房性心律失常,其中2 例应用程序性心房刺激出现心房扑动,1 例应用异丙肾上腺素输注诱发心房扑动。故认为CPVT 患者常伴有窦房结功能障碍和可诱发的房性心动过速,提示CPVT 的发病机制可能不仅局限于心室肌细胞,还包括了窦房结、心房肌细胞在内的广大心脏组织区域。
CPVT 治疗原则包括肾上腺素能阻断药物和活动限制,根据2013 年欧洲心律协会(EHRA)/美国心律学会(HRS)/亚太心律学会(APHRS)专家共识[1],CPVT 治疗包括:所有患者应避免在紧张环境下生活,限制竞技性或剧烈活动(Ⅰ类推荐);有症状患者需β 受体阻滞剂治疗(Ⅰ类推荐);对于无症状的致病基因突变携带者,β 受体阻滞剂治疗可能有效(Ⅱa 类推荐);β 受体阻滞剂禁忌或不能耐受或治疗无效患者可考虑左侧交感神经切除术(LCSD)(Ⅱb 类推荐);药物和LCSD 治疗均无效时,建议植入心律转复除颤器(Ⅰ类推荐);不建议植入型心律转复除颤器用于无症状CPVT 患者(Ⅲ类推荐)。
值得注意的是,对于CPVT 患者出现的室颤、心跳骤停,心肺复苏指南中应用肾上腺素这一环节并不适宜。van der Werf 等[14]回顾性分析了3 例最终确诊为CPVT 的心跳骤停患儿,在心肺复苏过程中,由于对前2 例患者存在诊断延迟的情况,使用了肾上腺素使病情恶化,引起了VT/VF 电风暴,而第3 例患者使用了阿片类镇痛药并避免使用了肾上腺素的全身麻醉从而改善了病情。对于儿童心肺复苏患者,如果出现持续性室性早搏、多形性或双向性室性心动过速,应警惕CPVT 的可能,常用于心肺复苏的静脉用肾上腺素在此类患者中应禁用。静脉应用β 受体阻滞剂是首选治疗,这不同于其他原因导致的室性心律失常风暴的治疗。当β 受体阻滞剂应用效果不佳时方可考虑全身麻醉、静脉注射阿片类药物,并可考虑使用Na 通道阻滞剂-氟卡尼。
总之,CPVT 是一种由心肌钙离子失调引起的遗传性离子通道病,首发症状即可表现为猝死。CPVT 易被误诊,早诊断、早治疗有重要意义。虽然关于其发病机制的研究越来越多,治疗手段逐渐丰富并优化,但CPVT 依然是具有高致死率的心律失常。如何快速且精准地早期诊断,如何通过药物及其他手段给予抢救时最合理处置,延长患者生命、提高生活质量,仍值得继续探索。
