结直肠癌中PAQR3 的表达水平及临床病理意义
2023-12-07孙冉习贵富赵楠杨士民
孙冉,习贵富,赵楠,3,杨士民
(1.天津市中西医结合医院胃肠外科,天津 300100;2.天津医科大学病理学教研室,天津 300070;3.天津医科大学总医院病理科,天津 300052)
近年来,我国结直肠癌发病率逐年上升,2016年结直肠癌已经成为国内新发病例数位列第2(40.8 万例)、病死率第4(19.6 万例)的癌种,且呈现年轻化的趋势,阐明结直肠癌发生、发展的分子机制,寻找有效的诊断标志物和治疗靶点对提高结直肠癌生存率具有重要意义[1]。结直肠癌的发生是多个基因共同作用的结果,抑癌基因功能失活在其中发挥重要作用[2]。孕激素和脂肪Q3 受体(progestin and adipoQ receptor 3,PAQR3)是近期发现的抑癌基因,在乳腺癌、胃癌、肝癌、骨肉瘤、急性白血病等多种恶性肿瘤中低表达,有研究表明结肠癌中PAQR3基因失活,但其调控结直肠癌发生、发展的机制尚不完全清楚[3]。本研究通过比较65 例结直肠癌和41例肠道黏膜中PAQR3 表达,研究其在结直肠癌和肠道黏膜中的表达水平及临床病理意义,并采用TIMER(Tumor IMmune Estimation Resource)等网上数据库分析PAQR3 表达与免疫细胞浸润的关系及相关分子通路。
1 材料与方法
1.1 生物信息学分析 采用TIMER 数据库(https://cistrome.shinyapps.io/timer/)分析泛癌种PAQR3 在肿瘤组织和正常对照组织中的表达差异[4]。为研究PAQR3 表达对结直肠癌中免疫细胞浸润的影响,采用TIMER 数据库(https://cistrome.shinyapps.io/timer/)分析结直肠癌组织内中性粒细胞、巨噬细胞、树突状细胞、B 细胞和CD4+/CD8+T 细胞浸润与PAQR3表达水平的关系[5]。
在cBioPortal 数据库中(http://cbioportal.org)[6],选择癌症基因组图谱结肠腺癌(The Cancer Genome Atlas-colon adenocarcinoma,TCGA-COAD)数据集,通过斯皮尔曼相关性分析检测癌组织中PAQR3 表达与其他基因表达的相关性及P 值。采用R 语言“ggplot2”及“ggrepel”包绘制相关性分析结果的火山图,进而使用“lusterProfiler”、“org.Hs.eg.db”、“enrichplot”包对PAQR3 和与其相关性最高的前100 个基因进行了KEGG(Kyoto Gncyclopedia of Genes and Genomes)和GO(Gene Ontology)基因通路富集分析。
1.2组织标本 本研究收集天津医科大学总医院2002 年1 月至2005 年12 月65 例临床病例资料完整且未经过放化疗的结直肠癌患者手术切除标本,选取该部分患者的41 例肠道黏膜标本作为对照,并经2 位有经验的病理医师确诊均为腺癌,其他病理类型的样本不选入本研究。65 例结直肠癌患者年龄为28~83 岁,男性28 例,女性37 例。本研究结直肠癌临床分期采用TNM 分期标准,65 例结直肠癌患者中,TNMⅠ/Ⅱ期25 例,TNM Ⅲ/Ⅳ期40 例;高分化18 例,中分化27 例,低分化20 例;确诊时有远处转移者37 例,无远处转移者28 例;有淋巴结转移患者31 例,无淋巴结转移者34 例。随访时间为手术日期开始至2016 年6 月30 日结束。
1.3 免疫组化染色 免疫组化采用SP 法染色。将石蜡包埋组织切片4 μm,经二甲苯脱蜡,无水乙醇Ⅰ5 min,无水乙醇Ⅱ5 min,3%H2O2封闭内源性过氧化酶30 min,95%乙醇水化5 min,80%乙醇水化5 min,自来水冲洗5 min,微波修复10 min,自然冷却后,自来水洗,PBS 平衡后,用山羊血清封闭30 min,一抗PAQR3(1∶150 稀释)孵育4℃过夜。次日室温恢复1 h 后PBS 洗3 次,加二抗(即用型)孵育1 h,PBS 洗3 次,DAB 显色,自来水洗,苏木精复染核,脱水,中性树胶封片。PAQR3 为鼠单克隆抗体购自Santa 公司,山羊抗小鼠二抗购自中杉金桥公司。
1.4 免疫组化染色结果判读 免疫组化染色结果用Mattern 积分法计算。阳性细胞百分比评分标准:每例标本目标组织着色范围小于10%为0 分,10%~25%为1 分,25%~50%为2 分,50%~100%为3 分。染色强度评分标准:阴性为0 分,淡黄色为1分,深黄色为2 分,棕黄色为3 分。阳性细胞百分率得分和染色强度得分相加,结果>3 分为高表达,≤3 分为低表达。
1.5 统计学处理 SPSS21.0 软件进行统计学分析。计数资料组间率的差异采用χ2检验分析,Kaplan-Meier 生存分析检测PAQR3 表达对65 例结直肠癌患者生存的影响,以P<0.05 为有显著性差异。
2 结果
2.1 TIMER 数据库中结直肠癌肿瘤组织与对照组织PAQR3mRNA 表达的差异 本研究选用TIMER数据库比较了多种恶性肿瘤组织与周围对照组中PAQR3mRNA 表达的差异,结果显示PAQR3 在胆管癌(cholangiocarcinoma,CHOL)、食管癌(esophageal carcinoma,ESCA)、头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSC)、结肠腺癌(colon adenocarcinoma,COAD)、直肠腺癌(rectal adenocarcinoma,READ)、直肠癌与对照组织PAQR3 表达差异具有显著性(均P<0.005,图1)。
2.2 PAQR3 表达对结直肠癌免疫细胞浸润的影响 本研究选用TIMER 数据库分析PAQR3 mRNA表达对结直肠癌免疫细胞浸润的影响,显示结肠癌PAQR3 表达与B 细胞、CD8+T 细胞、CD4+T 细胞、巨噬细胞、中性粒细胞及树突细胞等浸润水平呈正相关(图2,均P<0.05)。直肠癌PAQR3 表达与B 细胞、CD8+T 细胞、巨噬细胞、中性粒细胞及树突细胞等浸润水平呈正相关(图2,均P<0.05)。

图2 PAQR3 表达与结直肠癌免疫细胞浸润水平相关Fig 2 PAQR3 expression was correlated with the level of immune infiltration in colorectal cancer
2.3 结肠癌PAQR3 共表达基因及信号转导通路富集分析 通过Spearman 相关性分析了TCGA-COAD数据集中PAQR3 与其他基因的相关系数,其中相关性最高的前5 个基因为脱氧胞苷激酶(deoxycytidine kinase,DCK)、叉头蛋白N2(forkhead box N2,FOXN2)、MOB 激酶激活因子1A(MOB kinase activator 1A,MOB1A)、高尔基运输1B(golgi transport 1B,GOLT1B)和核孔蛋白54 kD(nucleoporin 54 kD,NUP54)(图3A)。对PAQR3 及相关性最高的前100个基因进行了富集分析,GO 富集分析结果显示PAQR3 及相关分子参与了“蛋白酶体蛋白分解代谢过程”、“蛋白酶体蛋白介导的泛素化依赖蛋白”等生物学过程,这些分子与“蛋白丝氨酸/苏氨酸磷酸酶活性”以及“泛素耦联酶”活性相关(图3B)。KEGG 富集分析结果显示PAQR3 及相关分子参与活跃的信号通路有“细胞衰老”、“泛素化介导的蛋白质水解”(图3C)。富集分析结果表明PAQR3 可能通过影响机体蛋白质合成及修饰过程影响了结直肠癌代谢过程。
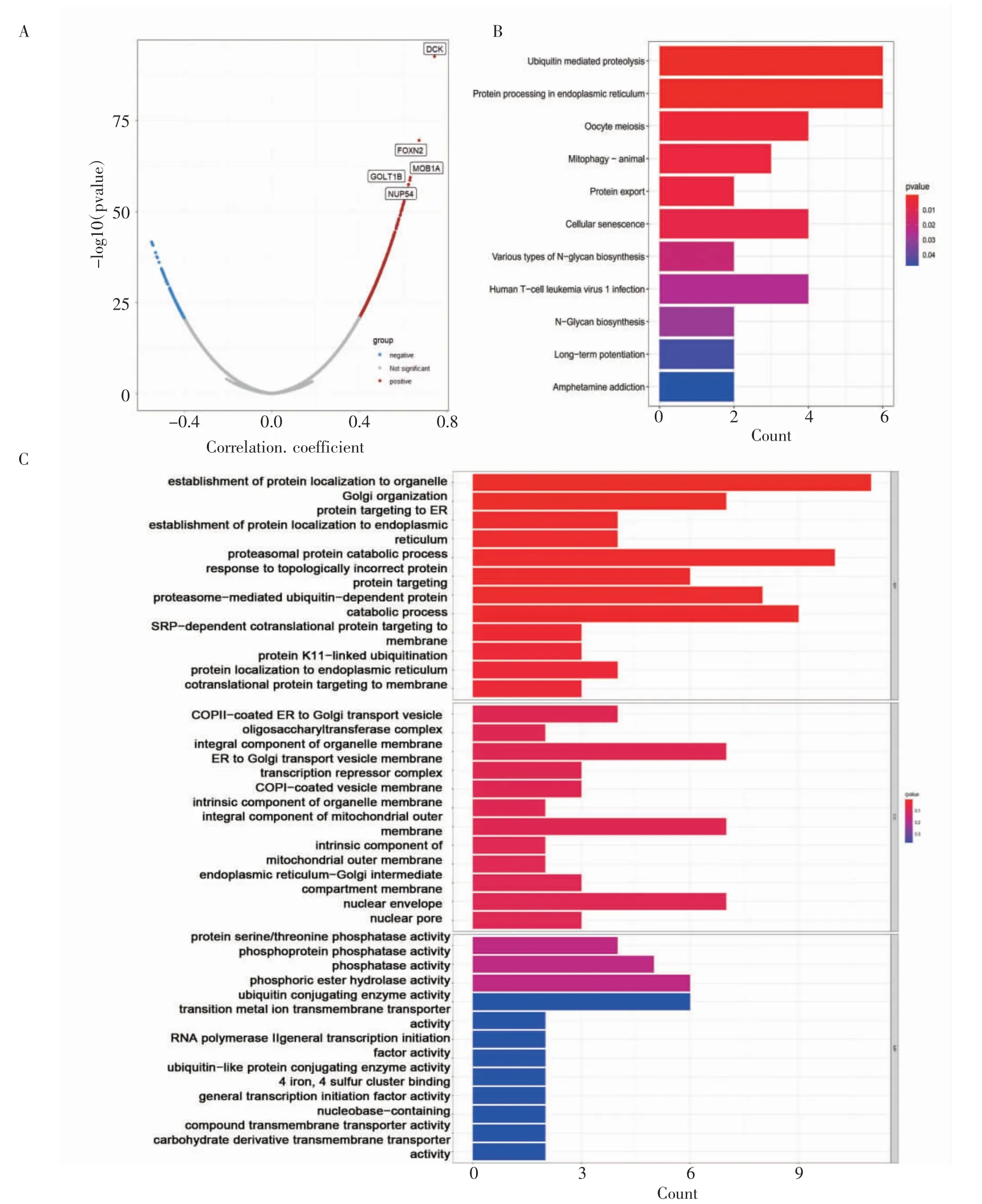
图3 结肠癌PAQR3 共表达基因及信号转导通路富集分析Fig 3 Enrichment analysis of PAQR3 co-expressed genes and signal transduction pathways in colon cancer
2.4 65 例结直肠癌与41 例肠道黏膜中PAQR3 表达的差异 PAQR3 表达于结直肠癌和肠道黏膜上皮细胞浆,41 例肠道黏膜中38 例高表达PAQR3,3 例低表达PAQR3,阳性率为92.7%;65 例结直肠癌中32 例高表达PAQR3,33 例低表达PAQR3,阳性率为49.2%;卡方检验结果表明二者差异具有统计学意义(图4,χ2=21.165,P<0.001)。
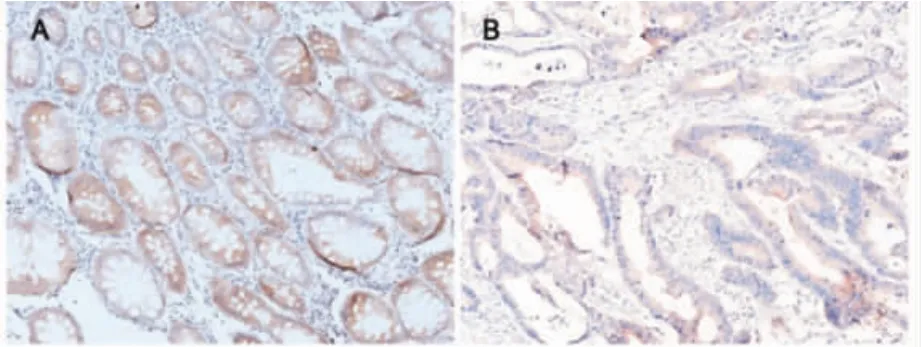
图4 结直肠癌与肠道黏膜中PAQR3 表达的差异Fig 4 Differences in the expression of PAQR3 between colorectal cancer and intestinal mucosa
2.5 65 例结直肠癌PAQR3 表达与肿瘤临床病理特征之间的关系 与PAQR3 低表达组相比,PAQR3 高表达组淋巴结转移率显著升高(P=0.034)。结直肠癌PAQR3 低表达组患者临床分期多为Ⅲ~Ⅳ期,PAQR3 高表达组患者多为Ⅰ~Ⅱ期,二者差异具有显著性(χ2=8.855,P=0.031,表1)。结直肠癌PAQR3 低表达组比PAQR3 高表达组更易发生远处转移(χ2=3.972,P=0.046,表1)。结直肠癌PAQR3 低表达组肿瘤分化程度较低,而PAQR3 高表达组肿瘤多为高分化,但二者差异无统计学意义(P>0.05,表1)。结直肠癌中PAQR3 表达与患者年龄、性别、肿瘤大小等无显著差异。

表1 65 例结直肠癌PAQR3 高表达组与低表达组临床病理特征比较[n(%)]Tab 1 Comparison of clinical pathological characteristics between the PAQR3 high expression group and low expression group in 65 cases with colorectal cancer[n(%)]
PAQR3 低表达组和高表达组总生存时间分别为(60.524±8.863)个月和(99.636±8.762)个月,结直肠癌PAQR3 低表达组和高表达组无病生存时间为(54.091±7.692)个月和(78.031±8.944)个月。Kaplan-Meier 生存分析结果显示PAQR3 高表达组较PAQR3 低表达组的总生存时间和无病生存时间长、预后好(χ2=10.305,P=0.001,χ2=4.135,P=0.042,图5)。
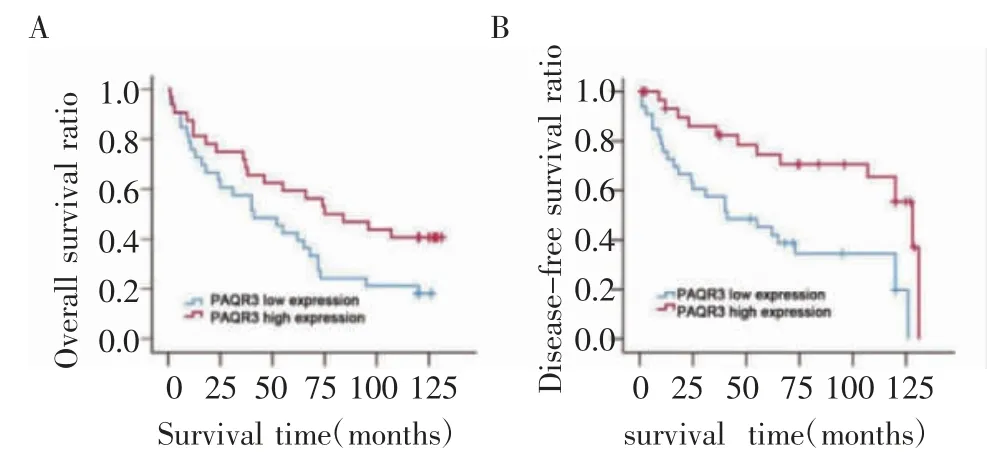
图5 PAQR3 表达对65 例结直肠癌患者生存的影响Fig 5 The impact of PAQR3 expression on the survival of 65 colorectal cancer patients
3 讨论
PAQR3 属于PAQR 家族成员,人PAQR3 基因定位于4 号染色体(4q21.21),编码约37 kD 的蛋白,PAQR3 参与调控能量代谢、细胞凋亡等生物学过程,与恶性肿瘤、糖尿病、创伤愈合等相关[7-8]。2007 年首次发现PAQR3 为分布于高尔基体的跨膜蛋白,具有Ⅲ型拓扑结构[7-8]。PAQR3 的主要生物学功能是将细胞胞质内的B-Raf 和C-Raf 激酶锚定到高尔基体上,引起Raf 激酶空间分布变化,干扰Raf 激酶与其上游活化G 蛋白Ras-GTP 以及下游底物丝裂原活化的细胞外信号调节激酶(mitogen-activated extracellular signal-regulated kinase,MEK)激酶的结合,从而阻抑其活化信号的传递,阻断丝裂原信号Ras/Raf/MEK/细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)通路的活化,抑制细胞增殖[9]。
目前研究发现PAQR3 基因在乳腺癌、胃癌、肝癌、骨肉瘤、急性白血病等组织中低表达[10],提示PAQR3 可能作为抑癌基因参与恶性肿瘤的发生和演进过程。本研究中通过检测人结直肠癌样本和网上数据库验证,发现与肠道黏膜相比结直肠癌中PAQR3表达降低,说明PAQR3 功能失活促进了结直肠癌的发生。同时,结直肠癌低表达提示肿瘤易于淋巴结和远处转移,患者预后不良,说明PAQR3 可作为预测结直肠癌患者生存的标志物。Wang 等[11]在转基因小鼠模型中发现PAQR3 基因敲除促进APC(min/+)小鼠自发肠癌的形成。体外实验表明PAQR3 能负向调控表皮生长因子介导的EPK 磷酸化及细胞核内β-catenin 而抑制人结肠癌细胞SW-480 的增殖[12]。上述结果说明PAQR3 在结肠癌中可能作为一种新的抑癌基因,通过调控肿瘤细胞的生长和增殖,促进肿瘤发生及浸润转移。
恶性肿瘤的发生、发展与肿瘤免疫微环境(tumorimmune microenvironment,TIME)密切相关,TIME由免疫细胞、成纤维细胞、肿瘤血管及细胞外基质等多种成分组成[13]。TIME 中包括T 细胞、B 细胞、NK细胞、树突细胞、巨噬细胞、中性粒细胞等多种免疫细胞,CD4+、CD8+T 细胞、B 细胞、NK 细胞等通过监测局部组织稳态,识别、清除肿瘤细胞,发挥抗肿瘤免疫效应,抑制肿瘤发生、发展[14]。M2 型巨噬细胞和调节性T 细胞(regulatory T cells,Tregs)等可抑制肿瘤免疫应答,如M2 型巨噬细胞通过分泌抑制性细胞因子,抑制免疫反应,促进肿瘤生长、侵袭和转移[15-16]。肿瘤细胞可通过多种方式影响肿瘤免疫微环境组成和免疫细胞功能,肿瘤细胞可通过分泌诱导性一氧化氮合酶和酸性纤维蛋白等物质抵御免疫效应,肿瘤细胞还可通过分泌、释放白细胞介素10、转化生长因子-β(transforming growth factor-beta,TGF-β)等细胞因子和细胞活性氧等物质抑制免疫细胞活化或促进免疫细胞耗竭,从而抑制肿瘤免疫,促进肿瘤细胞免疫逃逸[14]。本研究发现PAQR3 高表达与CD8+T细胞、B 细胞等免疫细胞浸润相关,提示PAQR3低表达可抑制结直肠癌CD8+T 细胞、B 细胞浸润,导致肿瘤组织内缺乏免疫效应细胞,肿瘤细胞逃避免疫微环境的监视和抑制,利于肿瘤侵袭和转移。
TGF-β 信号通路是调控免疫细胞功能的重要信号转导通路,可通过调节T 淋巴细胞来影响恶性肿瘤演进。TGF-β 通过活化下游转录因子T-box express in T cells(TBET)和信号转导与转录激活因子4(signal transducer and activator of transcription,STAT4),抑制幼稚T 淋巴细胞或通过激活母亲DPP同源物1(果蝇)[mothers against DPP homolog 1(Drosophila),SMAD]调控Treg 形成,促进肿瘤进展[17]。其次,TGF-β 能促进Smad3 和4 与辅助因子ERBB2转导因子(1 transducer of ERBB2,TOB1)作用,抑制CD4+T 细胞增殖;也可促进T 细胞线粒体内的Smad3 和4 磷酸化,干扰能量代谢抑制T 细胞活性[18]。而且TGF-β 还能够通过Smad3 选择性地增强CD279(PD-1)基因转录,使CD8+T 细胞PD-1 表达增加,促进CD8+T 细胞耗竭,促进肝细胞肝癌进展[23]。PAQR3 是TGF-β 信号转导通路的抑制分子,贲门癌中PAQR3 可通过抑制TGF-β、Smad2 和3 磷酸化,抑制TGF-β/Smad 通路活性[18]。本研究通过生物信息学分析还发现结直肠癌中PAQR3 表达与DCK、FOXN2、MOB1A、GOLT1B、NUP54 等基因关系密切。敲除小鼠肠道上皮细胞MOB1A 后,可活化TGF-β 通路,导致肠黏膜稳态失衡[19]。MOB1A 被泛素-蛋白酶体途径降解后可抑制Hippo 通路,从而促进了结直肠癌细胞的生长[20]。上述结果提示结直肠癌中PAQR3 基因失活导致TGF-β 信号通路活化,抑制免疫细胞浸润和发挥免疫应答,促进了结直肠癌发生、侵袭和转移。因此,PAQR3 基因功能失活重塑了结直肠癌免疫微环境,PAQR3 可作为结直肠癌患者预后和免疫治疗预测的标志物。
综上,结直肠癌组织中PAQR3 蛋白表达显著降低,其低表达与结直肠癌转移和免疫浸润降低密切相关,提示抑癌基因PAQR3 功能失活激活了TGF-β 信号通路,导致局部免疫微环境重塑和肿瘤免疫抑制,促进了结直肠癌发生和转移。
