低剂量双酚A 对雌性大鼠心室肌细胞钙火花的影响及其机制
2021-12-26颜素娟程晓曙李菊香陈亚梅王宏声
颜素娟 程晓曙 李菊香 陈亚梅 东 敏 王宏声
1.首都医科大学附属电力教学医院心内科,北京 100073;2.南昌大学第二附属医院心内科,江西南昌 330006;3.辛辛那提大学医学院,美国俄亥俄州,辛辛那提 45267
1993 年Cheng 等[1]在心肌细胞中发现,雷诺丁受体(ryanodine receptor,RyR)在舒张期处于关闭状态,但此时依旧能检测到少量Ca2+从肌浆网通过RyR 漏至胞浆内,这一过程可被共聚焦显微镜捕捉到并呈现为火花状,名为钙火花。当钙火花频率和/或峰值增加,舒张期胞浆内游离Ca2+的浓度就能明显提高,导致延迟后除极的发生[2]。在日常生活中,从医疗器械到食品包装的内里,特别是聚碳酸酯及环氧树脂等材料的生产过程中,通常都会添加双酚A(bisphenol A,BPA)[3]。且多项研究已经证明BPA 对人体有着各方面的危害[4-8],本研究以体外分离的雌性大鼠心室肌细胞为研究对象,观察BPA 是否会影响心室肌细胞钙火花,并针对其机制进行探讨。
1 对象与方法
1.1 实验动物
选用20 只10~16 周,体重200~250 g 的二级清洁健康雌性SD 大鼠(Harlan,Indianapolis,IN)作为实验对象,采用玻璃瓶喂养(Innovive,San Diego,CA)。使用经Millipore Rios 16 及ELIX UV/Progard 过滤后的无BPA 水,并喂食不含有影响大鼠体内雌激素成分的Teklad 饲料2020(Harlen)。动物实验过程严格遵照辛辛那提大学动物实验管理小组的相关手册进行,处死方式采用美国兽医协会专家小组推荐的安乐死。
1.2 主要仪器与试剂
BPA 购自TCI 公司(批号:Cl03105ES),M199 培养液购自Gibco 公司(批号:31100-035),Ⅱ型胶原酶及透明质酸酶购自Worthington 公司。层粘连蛋白(批号:114956-81-9)及Fluo-4 AM 购自Invitrogen 公司。
1.3 实验分组及处理
1.3.1 心室肌细胞的分离与培养 大鼠麻醉后处死,离体心脏经Langendorff 灌注系统加入Ⅱ型胶原酶及透明质酸酶进行灌注、酶解,然后收集心室肌细胞。将小盖玻片先用层粘连蛋白覆盖,再接种细胞悬液,然后将细胞置于37℃,5%CO2的孵箱内生长24 h 后用于实验。
1.3.2 实验分组 心室肌细胞按实验要求分成对照组和BPA 组(添加浓度为10-9mmol/L 的BPA),每组细胞至少来源于3 只大鼠,每只大鼠取8~10 个细胞。
1.4 观察指标及检测方法
1.4.1 心室肌细胞钙火花测量 经Fluo-4 AM 处理后的心室肌细胞见图1,置于共聚焦显微镜(ZEISS,LSM510)的记录槽内,利用线扫描(100 μm/s),分别记录对照组及BPA 组的钙火花,并用软件IDL6.3 分析数据。

图1 共聚焦显微镜下Fluo-4 AM 处理后的雌性成年大鼠心室肌细胞(40×)
1.4.2 心室肌细胞钙瞬变测量 心室肌细胞用Fluo-4 AM 处理6 min 后置于槽内。以0.5 Hz 的频率刺激细胞,利用钙离子成像系统记录并保存心肌细胞的钙瞬变数据,使用软件clampfit9.2 分析数据。
1.4.3 心肌细胞肌浆网钙负荷测量 将经Fluo-4 AM处理后的心室肌细胞滴于记录槽内,对细胞进行电刺激,待细胞钙瞬变达稳态后,关闭刺激器,迅速加入咖啡因,记录心室肌细胞的Ca2+浓度变化至其回归基线,用软件clampfit 9.2 分析数据。
1.5 统计学方法
采用SPSS 13.0 对所得数据进行统计学分析,计量资料采用均数±标准差()表示,组间比较采用t检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 两组钙火花频率及峰值比较
共聚焦显微镜下可见两组均有明亮钙火花出现,见图2。BPA 组钙火花频率高于对照组,差异有高度统计学意义(P <0.01)。两组的钙火花峰值比较,差异无统计学意义(P >0.05)。见表1。

图2 两组雌性大鼠心肌细胞钙火花示意图
表1 两组钙火花频率及峰值比较()
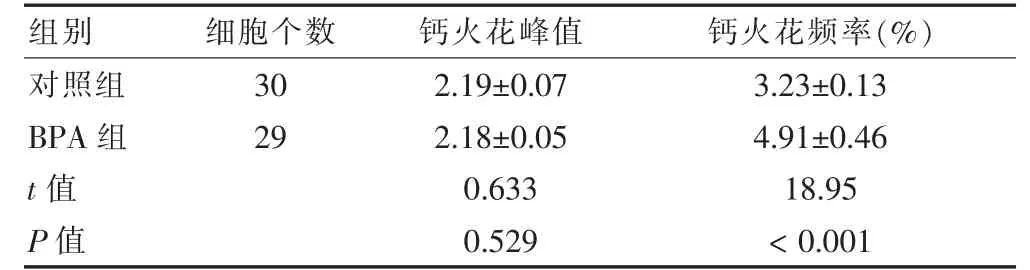
表1 两组钙火花频率及峰值比较()
注:BPA:双酚A
2.2 两组钙瞬变峰值及tau 值比较
BPA 组钙瞬变峰值高于对照组,钙瞬变tau 值短于对照组,差异有高度统计学意义(P <0.01)。见表2。
表2 两组钙瞬变峰值及tau 值比较()

表2 两组钙瞬变峰值及tau 值比较()
注:BPA:双酚A
2.3 两组稳态下肌浆网钙负荷及其tau 值和静态下肌浆网钙负荷比较
稳态下BPA 组肌浆网钙负荷高于对照组,差异有统计学意义(P <0.05);两组的肌浆网钙负荷tau值比较,差异无统计学意义(P >0.05)。静态下,两组肌浆网钙负荷比较,差异无统计学意义(P >0.05)。见表3。
表3 两组稳态下肌浆网钙负荷及其tau 值和静态下肌浆网钙负荷比较()

表3 两组稳态下肌浆网钙负荷及其tau 值和静态下肌浆网钙负荷比较()
注:BPA:双酚A
3 讨论
美国人群的流行病学调查研究发现,95%以上的被调查者尿液中都能检测到平均浓度为1.33 μg/L 的BPA[9]。Gaynor 等[10]也发现BPA 存在于手术器械中,先天性充血性心力衰竭的新生儿在完成胸外科手术后体内的BPA 浓度明显升高。目前已证实BPA 是雌激素的内分泌干扰化合物,能通过受体机制模拟/拮抗雌激素的作用。多项研究发现BPA 能促进儿童肥胖,诱发前列腺癌细胞增殖,影响人类生殖系统,导致免疫系统功能异常,造成神经内分泌系统紊乱,改变人类行为等,这一系列不良作用主要是通过基因和受体非基因机制产生[7,11-12]。早在2008 年9 月就有研究报道BPA 与心血管疾病之间有着密切的关系,此后多项研究发现BPA 浓度与心律失常、心源性猝死、冠状动脉粥样硬化性心脏病、心绞痛等疾病之间密切相关[13-16]。
胞浆内Ca2+循环在心室肌细胞兴奋-收缩偶联中发挥着重要的介导作用,本课题组既往实验发现BPA 能增加雌性大鼠心肌细胞的收缩率,浓度为10-9mmol/L时作用最强,而雄性大鼠心肌细胞对BPA 无反应[17],推测其或许能影响心室肌细胞内Ca2+循环。钙火花是舒张期自肌浆网内经RyR 流至胞浆的Ca2+漏[1],是心律失常产生的最根本原因之一[2,18-19]。本研究发现BPA能明显增加成年雌性大鼠心室肌细胞内的钙火花频率,而对钙火花的峰值无影响。根据钙火花的形成机制,推测本研究中钙火花的一系列变化可能是通过增加肌浆网上的RyR 的开放率和/或增加肌浆网内钙负荷来实现的。
有研究利用二维脂质双层模拟肌浆网观察钙火花的形成,结果显示局部有多个RyR 通道参与钙火花的形成[20]。也研究认为钙火花是局部6~20 个RyR通道同时漏出Ca2+所形成的[21]。RyR 具有3 种异构体,心脏中主要存在RyR2,心肌细胞肌浆网上的RyR2通道异常与心律失常密切相关[22-23]。有研究发现,儿茶酚胺相关性多形性室速患者可以检测出突变的RyR2基因,利用这一突变基因建立的小鼠模型可诱发出运动相关的心律失常和猝死。实际上目前已有50 余种RyR2 基因突变与遗传性心源性猝死之间有关联[24]。而通过稳定RyR2 通道能减少心律失常的发生。最近一种新型药物JTV519 能稳定狗快速起搏导心衰模型心肌细胞中Calstabin 2 与RyR 的结合,从而减少肌浆网Ca2+漏[25-26]。本研究结果显示,在BPA 的刺激下,心室肌细胞钙火花频率增加,肌浆网内的钙负荷不变。因此静息状态下BPA 可增加心室肌细胞肌浆网上RyR的开放率,使舒张期肌浆网上的RyR 开放增多,影响钙火花的频率。
为了更好地模拟大鼠体内的环境,本研究以0.5 Hz的频率刺激心室肌细胞,待细胞收缩达到稳态后,再测定肌浆网内钙负荷。此时结果显示,在BPA 的作用下肌浆网内的钙负荷量明显增加。本研究还检测了心肌细胞的钙瞬变,结果显示BPA 能明显升高钙瞬变的峰值,并且明显缩短钙瞬变tau 值。心肌细胞收缩后,胞浆内Ca2+的移除有两种途径,一种是通过肌浆网上的Ca2+-ATP 酶将Ca2+泵回肌浆网内,另一种是通过细胞膜上的钠钙交换体将Ca2+泵出细胞外。咖啡因诱导的钙瞬变时,其能使肌浆网上的RyR 全部开放,所以此时胞浆内的Ca2+主要是通过钠钙交换体来移除的。而BPA 并不影响咖啡因诱导钙瞬变的tau值,推测BPA 不影响钠钙交换体的功能。因此BPA可能通过影响Ca2+-ATP 酶,增加每次心肌细胞收缩后进入肌浆网的Ca2+量,导致肌浆网内Ca2+浓度增加。
因此本研究推测BPA 可能通过增加钙火花的频率,诱发出延迟后除极,促使雌性大鼠室性心律失常的发生。但本研究仅仅从细胞水平进行实验,至于在离体心脏甚至在整体动物水平能否造成心律失常,则需进一步的实验来证实。
综上,BPA 能通过每次心肌收缩逐渐增加心室肌细胞肌浆网内的钙负荷,并提高RyR 的开放率,促进心肌细胞舒张期肌浆网的Ca2+漏,增加钙火花的发生频率。
