乳腺癌术后辅助放疗过程中中性粒细胞减少症发生的危险因素分析
2023-12-06金龙曹菲张沥马少君
金龙 曹菲 张沥 马少君
(陕西省人民医院,陕西 西安 710068 1 放疗科; 2 肿瘤内科; 3 MRI室; 4 放射科)
世界卫生组织国际癌症研究机构2020年12月发布全球最新癌症相关数据显示,乳腺癌已成为全球人群中第一大肿瘤类疾病,严重影响着人类尤其是妇女的身心健康及生命安全[1]。放疗是乳腺癌综合治疗的重要手段之一,是降低保乳手术和高危乳房切除手术患者复发率,并延长其生存时间的一项重要措施[2]。但同时,乳腺癌术后辅助放疗不可避免照射患者患侧胸骨及肋骨,杀伤造血细胞,且前期化疗常导致骨髓增殖活性明显低下,放疗期间骨髓抑制的发生率较高。超过2级骨髓抑制发生可导致放射治疗的调整或治疗中断,影响总体的治疗效果[3]。因此,探究乳腺癌术后辅助放疗过程中发生2级及以上中性粒细胞减少症的影响因素,并且提前加以控制,具有重要临床意义[4]。本研究回顾性分析了2018年1月—2020年12月间93例于我院行乳腺癌术后放疗患者的临床资料,旨在明确2级及以上中性粒细胞减少症发生的危险因素,以求为乳腺癌患者术后辅助放疗是否发生骨髓抑制的预估提供临床参考。
1 资料与方法
选取2018年1月—2020年12月于我院初治并行辅助放疗的乳腺癌术后患者93例。患者纳入标准:①经病理学检查确诊为乳腺癌;②行新辅助化疗+手术者或手术+辅助化疗后辅助放疗者;③完成全程化疗及全剂量放疗者;④乳腺癌为单侧病变者;⑤临床资料完整者。患者排除标准:①早期乳腺癌术后未行放射治疗者;②乳腺癌存在远处转移者;③男性乳腺癌;④放射治疗前1周内中性粒细胞绝对值<1.8×109/L者;⑤放射治疗前1周内使用短效重组人粒细胞集落刺激因子或2周内使用长效聚乙二醇化重组人粒细胞集落刺激因子者;⑥合并免疫性疾病及其他恶性肿瘤者;⑦治疗前合并急性感染者;⑧合并血液系统疾病者;⑨合并严重肝、肾疾病者。
所有患者均按照中国临床肿瘤学会乳腺癌诊疗指南[5]的要求行辅助放疗。根据常见不良反应术语评定标准5.0版[6]的标准,将辅助放疗后出现中性粒细胞减少症患者分为四级,其中将无或仅达1级中性粒细胞减少症患者设为对照组,2级及以上中性粒细胞减少症患者设为观察组。收集两组患者年龄、病变部位、体质量指数(BMI)、乳腺癌临床分期、乳腺癌分子分型、初诊血液学指标、是否行抗Her-2靶向治疗、化疗周期、化疗期间是否发生4级骨髓抑制、放疗前血液学指标、放疗靶区范围、计划靶区体积(PTV),以及胸骨及肋骨的下述指标:平均照射剂量(Dmean)、接受大于20 Gy照射体积与总体积之比(V20)、接受大于30 Gy照射体积与总体积之比(V30)。
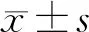
2 结 果
2.1 两组患者的临床资料比较
共有93例乳腺癌患者纳入本研究,其中33例(35.5%)未发生中性粒细胞减少症,发生1、2、3级中性粒细胞减少症者分别为29、23、8例,观察组31例,对照组62例。所有患者年龄26~75岁,中位年龄50(43,56)岁。两组患者的乳腺癌分子分型、初诊白细胞计数、初诊中性粒细胞绝对值、化疗期间发生4级骨髓抑制患者构成比、放疗前白细胞计数、放疗前中性粒绝对值、放疗前血红蛋白水平、放疗的PTV、放疗胸骨Dmean、V20、V30等指标比较差异具有显著性(χ2=4.511、9.900,t=2.286~9.900,P<0.05)。见表1。

表1 两组患者临床资料比较
2.2 影响2级及以上中性粒细胞减少症发生的多因素logistic回归分析
将单因素分析中P<0.05的变量纳入logistic回归方程。纳入的自变量:分子分型(Luminal A=1,Luminal B=2,三阴型=3,Her-2过表达型=4),初诊白细胞计数(≥4×109/L=0,<4×109/L=1),初诊中性粒细胞绝对值(≥2×109/L=0,<2×109/L=1),化疗期间发生4级骨髓抑制(未发生=0,发生=1),放疗之前白细胞计数(≥4×109/L=0,<4×109/L=1),放疗之前中性粒绝对值(≥2×109/L=0,<2×109/L=1),放疗前血红蛋白(≥120 g/L=0,<120 g/L=1),以及放疗PTV、胸骨Dmean、V20和V30。多因素logistic回归分析结果显示,放疗PTV增大及胸骨Dmean剂量增大均为患者2级及以上中性粒细胞减少症发生的危险因素(P<0.05)。见表2。

表2 影响2级及以上中性粒细胞减少症发生的多因素logistic回归分析
2.3 2级及以上中性粒细胞减少症发生的危险因素的ROC曲线分析
ROC曲线图显示,放疗PTV的cut-off值为733.28 mL,AUC为0.664,灵敏度83.9%,特异度56.5%;胸骨Dmean的cut-off值为2 213.5 cGy,AUC为0.749,灵敏度80.6%,特异度67.7%。通过串联试验得出两指标联合的AUC为0.786,灵敏度96.8%,特异度58.4%。见图1。
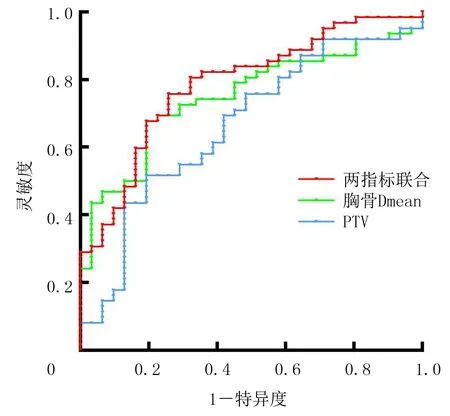
图1 PTV、胸骨Dmean及两指标联合预测2级及以上中性粒细胞减少症发生的ROC曲线
3 讨 论
乳腺癌是女性最常见的恶性肿瘤。在中国,乳腺癌的发病率保持着3.9%的年增长率,2020年新发病例达42万,约有12万女性因乳腺癌死亡[7-8]。乳腺癌术后辅助放疗是乳腺癌综合治疗中不可或缺的一部分,可降低50%~70%的局部复发风险[9]。在乳腺癌临床放疗过程中,1级中性粒细胞减少症患者不需特殊处理即可安全完成放疗,一旦出现2级及以上中性粒细胞减少症,将会导致放疗中断,影响放疗效果,并有可能增加放疗局部皮肤软组织感染和放射性肺炎的发生率,严重时甚至危及患者生命[10]。另外,乳腺癌化疗多采用高中度致骨髓抑制风险的方案,且化疗过程中可能多次使用粒细胞刺激因子刺激造血,造成骨髓增殖活性、储备能力的明显下降[11],但化疗对随后放疗所致的骨髓抑制是否有影响,目前相关报道较少[4]。本研究结果表明,化疗过程中发生4级骨髓抑制的患者,放疗时发生2级及以上中性粒细胞减少症的风险较高。
成人的活性骨髓主要分布在扁骨中,其中骨盆中活性骨髓占比较大,约占50%[12],所以对盆腔放疗的患者骨髓保护的研究较多[13-14]。ROSE等[15]研究显示同步放化疗的宫颈癌患者骨盆诸骨V10>95%且V20>76%时,将加重骨髓抑制程度。罗建奇等[16]研究显示,进行骨髓保护可显著降低同步放化疗宫颈癌患者2级及以上骨髓抑制的发生率。王健仰等[17]研究同样显示,同期放化疗的直肠癌患者骨盆骨髓照射剂量与急性血液不良反应发生率及其严重程度明显相关。在胸部放疗中,胸骨及肋骨的照射体积和剂量往往与骨髓抑制的发生相关。高飞等[18]研究表明,在食管癌术后放疗患者中,发生2级及以上骨髓抑制患者的胸骨Dmean、V20、V30均显著高于未发生组。耿冲等[19]研究证实,接受放疗的食管癌患者胸骨Dmean、V30、V40、V50值越高,2级及以上的骨髓抑制发生的可能性则越大。王强等[4]研究显示,乳腺癌术后辅助调强放射治疗中肋骨与胸骨Dmean、V30、V40对骨髓增殖活性影响显著,与肋骨相比胸骨对射线更为敏感,发生2级骨髓抑制的胸骨Dmean界值为(1 963.43±222.11)cGy。本研究显示胸骨Dmean>2 213.5 cGy的患者发生2级及以上中性粒细胞减少症风险较高,与上述研究结果较为一致。乳腺癌患者术后放疗靶区范围也被认为是骨髓抑制的危险因素,接受锁骨上胸壁放疗的患者会引起较重的骨髓抑制[20]。由于本研究中纳入全乳照射患者较少(5.4%),故未得到相同的结果,但更大的照射范围意味着更多的胸骨及肋骨受到照射,本研究证实PTV>733.28 mL的患者更容易发生2度及以上中性粒细胞减少症,上述结论也与既往研究结果相符[21]。本研究表明,PTV>733.28 mL及胸骨Dmean>2 213.5 cGy是乳腺癌患者术后辅助放疗期间发生2级及以上中性粒细胞减少症的独立危险因素;但单一指标预测效能较低,联合预测可将AUC提高至0.786。临床工作中,乳腺癌术后辅助放疗PTV由患者临床特征决定,针对PTV>733.28 mL的乳腺癌患者,制作放疗计划时除了综合考虑心肺受照剂量外,还需尽可能避让胸骨,降低胸骨Dmean,以减少患者发生2级及以上中性粒细胞减少症的风险。
本研究存在一定不足之处,比如入组患者化疗方案各异,化疗期间预防性和治疗性升白细胞药物及用量各不相同,难以保证放疗前骨髓情况的一致性,应在后续研究中给予修正。本研究提示PTV>733.28 mL和胸骨Dmean>2 213.5 cGy是乳腺癌术后辅助放疗过程中发生2级及以上中性粒细胞减少症的独立危险因素,两指标联合对放疗中2级及以上中性粒细胞减少症的发生具有较高预测价值,可以为乳腺癌术后辅助放疗患者的临床治疗决策提供参考。
伦理批准和知情同意:本研究涉及的所有试验均已通过陕西省人民医院伦理委员会的审核批准(文件号2022伦审第R014号)。所有试验过程均遵照《涉及人的生物医学研究伦理审查办法》的条例进行。受试对象或其亲属已经签署知情同意书。
作者声明:金龙、马少君参与了研究设计;金龙、曹菲、张沥与了论文的写作和修改。所有作者均阅读并同意发表该论文,且均声明不存在利益冲突。
