原发性高血压患者血RASS系统与胰岛素抵抗的关系研究
2023-12-02刘丹丹张森
刘丹丹 张森
(延安大学咸阳医院,陕西 咸阳 712000)
原发性高血压(EH)发病于各个年龄段,长期高血压易诱发心、脑、肾、眼等多器官并发症,成为危害健康的头号杀手。肾素-血管紧张素-醛固酮系统(RAAS)是EH重要的发病机制,临床治疗中以RAAS为靶点的血管紧张素受体拮抗剂、血管紧张素转化酶抑制剂、醛固酮受体拮抗剂等抗高血压也取得了较好的效果[1]。调查发现[2],40%以上的高血压患者伴IR,并有研究显示[3],抑制RAAS活性可改善胰岛素β细胞功能,增加胰岛素分泌。因此,本文探究原发性高血压(EH)患者血RASS系统与胰岛素抵抗的关系,为阐明高血压发病发病机制提供依据。
1 资料与方法
1.1一般资料 选取2019年10月至2021年2月我院收治的原发性高血压初诊患者108例,纳入标准:符合《中国高血压防治指南(2018年修订版)》[3]中原发性高发性诊断标准;年龄18~80岁,性别不限;近1个月内未服用降压药物或其他抗高血压治疗;能按时参加随访;排除标准:继发性高血压患者;合并糖尿病、高尿酸血症肝、肾功能异常、急性心脑血管疾病、严重感染及恶性肿瘤;双侧肾动脉狭窄;高钾血症(血钾>5.5 mmol/L);计划妊娠或妊娠期、哺乳期妇女。根据胰岛素抵抗水平分为非胰岛素抵抗组(HOMA-IR<2.69)46例与胰岛素抵抗组(HOMA-IR≥2.69)62例,非胰岛素抵抗组46例,另选取本院体检科健康自愿者50例为对照组。对照组中男28例,女22例,平均年龄(58.50±7.21)岁,平均体质量(78.29±9.52)kg;非胰岛素抵抗组中男28例,女18例,平均年龄(52.72±8.14)岁,平均体质量(78.45±10.80)kg;胰岛素抵抗组中男41例,女21例,平均年龄(58.57±5.69)岁,平均体质量(81.32±9.82)kg。3组一般资料比较差异无统计学意义(P>0.05)。
1.2方法 (1)外周血RAAS系统及HOMA-I测定采集受试者早晨空腹卧位肘静脉5mL,离心处理(3 500 r/min,10 min)取血清层,使用全自动生化分析仪(罗氏Cobas 6 000 501型),采用酶免发光法测定RE、AngⅡ、ALD水平,检测试剂盒均购自郑州安图生物工程股份有限公司;采用己糖激酶法测定空腹血糖(FPG),采用电化学发光法测定空腹胰岛素(FIN),计算胰岛素抵抗指数(HOMA-IR),HOMA-IR=FPG×FIN/22.5。所有检测操作均由检验科高年资检验师完成。(2)血压测量 使用臂式电子血压计(深圳市优瑞恩科技有限公司,BP913型)测量受试者非同日血压3次,取均值,每次均早晨8:30~9:00由同一测试者使用相同血压计测量同侧臂血压,嘱受试者测血压前不喝咖啡或酒,测试前30 min内不剧烈运动,心绪平稳,静坐休息15 min。
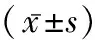
2 结 果
2.1伴/不伴胰岛素抵抗高血压患者临床参数比较 胰岛素抵抗组FPG、FINS、AngⅡ、ALD水平均明显高于对照组、非胰岛素抵抗组(P均<0.05);而PRA低于对照组、非胰岛素抵抗组(P均<0.05);3组间RE、AngⅡ、ALD水平两两比较差异均有统计学意义(P<0.05);非胰岛素抵抗组与胰岛素抵抗组高血压分级存在显著差异(P<0.05)。见表1。
2.2不同高血压病情患者临床参数比较 随高血压分级增高,FPG、FINS、HOMA-IR、AngⅡ、ALD水平增高,而RE水平下降,3组间上述指标两两比较差异均有统计学意义(P均<0.05)。见表2。
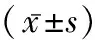
表1 伴/不伴胰岛素抵抗高血压患者临床参数比较
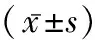
表2 不同高血压分级患者临床参数比较
2.3RAAS系统与胰岛素抵抗的关系 RE、AngⅡ、ALD与FPG、FINS均无相关性(P<0.05);HOMA-IR与RE呈负相关(r=-0.386,P<0.001),与AngⅡ、ALD呈正相关(r=0.421、0.267,P<0.05)。见表3。
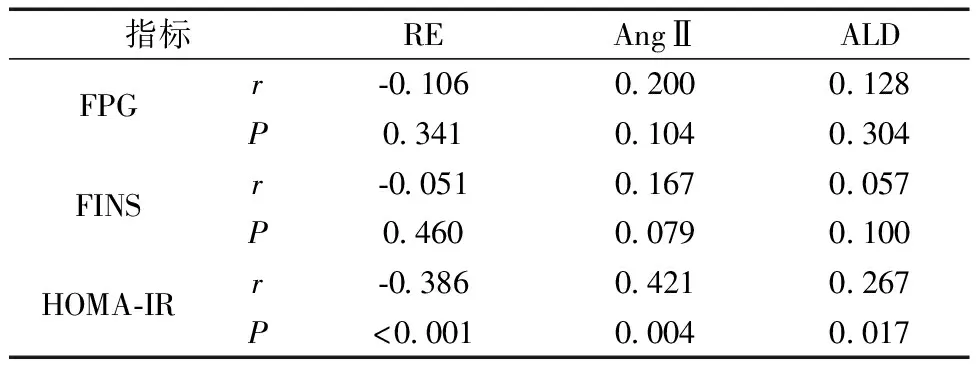
表3 RAAS系统与胰岛素抵抗的Pearson相关性回归分析
3 讨 论
研究指出[4],RAAS是EH发病的重要机制,其主要通过诱发血管收缩和水钠潴留,增加容量负荷途径参与EH的发病和进展。有调查发现[5],RAAS活性不高EH患者应用抗RAAS药物效果不明显。由此可知,RAAS系统在EH的发病与临床治疗中占据重要地位。
本文结果显示,随高血压分级增高,AngⅡ、ALD水平增高,而RE水平下降,3组间上述指标两两比较差异均有统计学意义(P均<0.05),进一步说明RAAS系统参与了EH的病情进展,与Kwakernaak AJ 等报道结果一致[6]。肾脏球旁细胞通过分泌肾素,并作用于血管紧张素原,诱导其转化为AngⅠ,AngⅠ可在肺循环血管内皮细胞上的血管紧张素转化酶诱导下转化为AngⅡ、AngⅢ,其中AngⅡ可进一步作用于全身血管紧张素受体而引起血管收缩,AngⅢ则会刺激ALD分泌和释放,ALD具有保钠排钾,可促进钠、水重吸收,而引起肾脏对钠盐排泄异常,导致水钠潴留,引发EH[7]。
本文结果发现,伴或不伴胰岛素抵抗EH患者高血压分级及RAAS系统活性存在显著差异,与严晓伟等研究报道结果相符[8],提示胰岛素抵抗与EH发病有关,同时还可能与RAAS系统活性存在一定关系。分析机制,胰岛素可诱导主动脉内皮细胞合成与内皮素分泌,而内皮素具有强效的血管收缩作用,胰岛素抵抗下胰岛素水平升高,引起内皮素分泌增多,进而导致血管收缩,外周血流阻力增大[9];同时,胰岛素抵抗还可通过活化α肾上腺能受体,使血管收缩,导致血压升高;此外,胰岛素抵抗还可调节近曲小管对钠的重吸收作用,引发水钠潴留,使血容量增加而引起高血压[10]。本文结果发现,HOMA-IR与RE呈负相关(r=-0.386,P<0.001),与AngⅡ、ALD呈正相关(r=0.421、0.267,P<0.05),提示RAAS系统活性与胰岛素抵抗存在相关。分析原因,AngⅡ可直接作用与血管平滑肌引起血管收缩,血压升高,而胰岛素抵抗状态下,胰岛素刺激内皮细胞合成舒张血管平滑肌物质一氧化氮的合成减少,导致拮抗血管收缩能力下降,血压升高[11];
综上,RAAS系统与胰岛素抵抗均为EH发病的重要机制,二者存在一定的关联性,值得深入探讨。
