基于多重实时荧光定量PCR技术检测高危型人乳头瘤病毒E6/E7 mRNA的临床研究
2023-12-02刘娜李倩鲁洁
刘娜 李倩 鲁洁
(延安大学附属医院检验科,陕西 延安 716000)
有研究认为,高危型人乳头瘤病毒(HPV)感染通常和宫颈癌的发生发展存在密切关系,绝大多数宫颈癌患者是由高危HPV的持续感染引起,故此,高危HPV持续感染成为宫颈癌发生及发展的必要条件。但部分女性感染的HPV存在一过性,其中长时间持续感染率仅10%左右[1]。既往临床认为HPV DNA检查存在一定应用价值,但实际使用中发现其特异度较低,在临床诊断中局限性较大,甚至增加误诊漏诊风险[2]。此外,高危HPV一旦感染宿主后,其自身病毒基因组通常整合至宿主基因组内,若HPV本身的核酸整合进入宿主基因组,其转录水平随之提升,说明宫颈组织出现异常,并逐渐恶化[3]。而HPV E6/E7 mRNA在病毒的活动程度和疾病的进程中具有一定监测作用,可达到早发现、早治疗的目的,并为宫颈癌筛查提供参考[4]。因此,本文研究基于多重实时荧光定量PCR技术检测高危型人乳头瘤病毒(HPV)E6/E7 mRNA的价值。现报告如下。
1 资料与方法
1.1一般资料 选择2022年1月至2022年7月我院进行宫颈癌筛查的患者60例,年龄25~61岁,平均年龄(43.09±2.54)岁;体质指数17~23 kg/m2,平均体质指数(20.06±1.11)kg/m2;小学至初中18例,高中26例,大专至以上16例。纳入标准[5]:患者及家属均知情同意;均通过病理检验确诊;已婚或存在性生活史;意识清楚,有基本的听说读写能力。排除标准:有宫颈手术史或者子宫切除史;妊娠或者哺乳期女性;精神疾病、认知障碍或者沟通障碍者;中途退出试验者。
1.2方法 收集患者宫颈分泌物标本,置于2~8℃下保存,72h之内检测。(1)薄层液基细胞学检查:选择ThinPrep 2 000制片系统对患者标本进行液基薄层细胞制片技术处理,妥善固定并染色后实施镜检。将获得的结果通过TBS系统进行细胞分类,鳞状细胞包含:正常、鳞状细胞癌(SCC)、未明确诊断意义的不典型鳞状上皮细胞(ASCUS)、高度鳞状上皮内病变(HSIL)、腺癌(AC)、低度鳞状上皮内病变(LSIL)。(2)病理学检查:选择阴道镜进行多点活检,宫颈组织分类包含:正常或炎症、异型上皮细胞限制于宫颈上皮的下1/3(CINⅠ)、异型上皮细胞累及宫颈上皮的下1/3~2/3(CINⅡ)、异型上皮细胞超出宫颈上皮全层的2/3或累及全层宫颈腺但未突破基底膜(CINⅢ)、浸润癌。(3)制备HPV E6/E7 mRNA:参考国家标准规定的标准品制备及验证方式,并通过测序验证,其中PCR模板为14种高危HPV全基因组参考品。(4)转录介导等温核酸扩增技术:选择转录介导等温核酸扩增技术测定各个高危HPV E6/E7 mRNA,并遵照说明书要求进行检测。(5)多重实时荧光定量PCR技术:选择TIANamp Virus DNA/ RNA Kit将RNA进行提取,并按说明书要求操作,通过DEPC水(50 μL)洗脱。将提取到的RNA和2×DNase Ⅰ buffer、DNase Ⅰ混合,37℃条件下30 min。此次反应总体积40 μL,引物和探针信号分别是:16F,AAGCCACTGTGTCCTGAAGAAAA;16P,CAAAGACATCTGGACAAAA;16R,GACCCCTTATATTATGGAATCTTTGC;18R,TGGCTTCACACTTACAACACATACA;18F,CCGACGAGCCGAACCA;18P,AACG TCACACAATGTT;31R,GGATGTGTCCGGTTCTGCTT;31F,CGACAGCTCAGATGAGGAGGAT;31P,TCATAGACAGTCCAGCTGG等。反应条件:40℃条件下30 min,80℃条件下2 min,95℃条件下2 min,重复40次,最后在72℃时收集荧光信号,并将反应于LightCycler 480 PCR 仪上进行,按循环阈值(Ct)<38判定成标本和内参阳性的阈值,如若Ct>38即标本不合格。(6)灵敏度及特异度:从HPV E6/E7 mRNA标准品内提取RNA,并通过数字PCR进行定量,按照检测的拷贝数使用含有人基因组的TE溶液遵照十倍梯度进行稀释,各个梯度中选择RNA(2μL)作为模板开展多重实时荧光定量PCR反应,测定其灵敏度,同时各个梯度反复测定20次,若19次为阳性的浓度梯度即可成为检出限。另外选择 TIANamp Virus DNA/ RNA Kit提取大肠埃希菌、取淋病奈瑟菌、梅毒螺旋体、金黄色葡萄球菌等,选择2μL作为模板,开展多重实时荧光定量PCR反应,测定其特异度。
1.3观察指标 比较薄层液基细胞学和病理学检查结果,并观察所有患者多重实时荧光定量PCR技术的检测结果,计算其符合率、灵敏度及特异度。
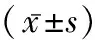
2 结 果
2.1多重实时荧光定量PCR的灵敏度及特异度 经检测发现,HPV 16、18、31、33等九类型的最低检测为10 copies/μL,但HPV 51、52、56、58等五类型最低检测是100 copies/μL。另外通过多重实时荧光定量PCR检测高危HPV E6/E7 mRNA和生殖道内常见病原菌例如大肠埃希菌、取淋病奈瑟菌、梅毒螺旋体、金黄色葡萄球菌等,其结果均显示阴性,且检测结果的特异性良好。
2.2所有患者的检查结果分析 薄层液基细胞学的检查结果与病理学检查并无差别(P>0.05)。见表1。
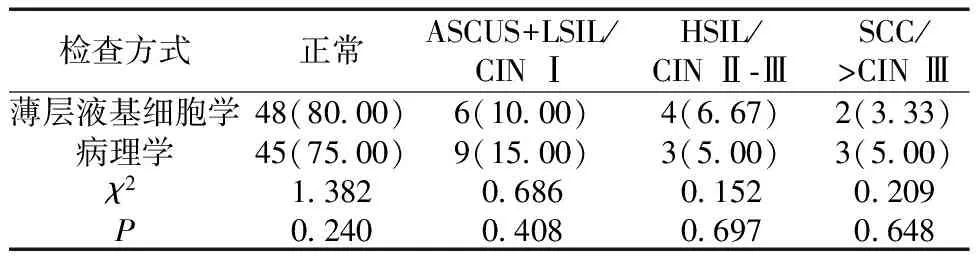
表1 所有患者的检查结果分析[n=60,n(%)]
2.3不同技术的检测结果分析 多重实时荧光定量PCR技术的符合率91.67%(55/60),灵敏度83.33%(15/18),特异度95.24%(40/42)。见表2。

表2 不同技术的检测结果分析
3 讨 论
目前,临床对于HPV E6/E7 mRNA的检测方式较多,例如Hologic Gen-Probe的Aptima HPV Assay作为美国食品药品监督管理局批准测定高危HPV的方式,但其检查设备通常呈现封闭式,在国内的普及率较低[6-7]。而PRETECT HPV-Proofer可检测的型别较少,仅可对五种高危HPV E6/E7 mRNA进行检测[8]。近些年,随着医疗技术的持续进步,发现Kodia的高危HPV E6/E7mRNA定量检测成为国内批准的产品,主要利用b-DNA 信号放大法,但操作方法较复杂,且检测时间较长,直接限制其在临床的应用[9-10]。
本文则是基于多重实时荧光定量PCR技术进行HPV E6/E7 mRNA检测,发现其不仅能够检测多达十几种的高危HPV E6/E7 mRNA,同时操作较为简便,明显缩短检查时间[11-12]。故此,本文比较基于多重实时荧光定量PCR技术和转录介导等温核酸扩增技术,结果发现HPV 16、18、31、33等九类型的最低检测为10 copies/μL,但HPV 51、52、56、58等五类型最低检测是100 copies/μL;另外通过多重实时荧光定量PCR检测高危HPV E6/E7 mRNA和生殖道内常见病原菌例如大肠埃希菌、取淋病奈瑟菌、梅毒螺旋体、金黄色葡萄球菌等,其结果均显示阴性,且检测结果的特异性良好;薄层液基细胞学的检查结果与病理学检查并无差别(P>0.05);多重实时荧光定量PCR技术的符合率91.67%(55/60),灵敏度83.33%(15/18),特异度95.24%(40/42),提示随着细胞学病变程度的日益加重,高危HPV E6/E7 mRNA的检出率也明显增加,从而证实HPV E6/E7 mRNA转录水平和宫颈病变的严重程度息息相关。
综上所述,基于多重实时荧光定量PCR技术在HPV E6/E7 mRNA检测中意义重大,存在较高的灵敏度及特异度,可成为宫颈病变筛查的主要方式。
