miR-133a调控RUNX2/BMP2信号通路参与激素性股骨头坏死的机制
2023-12-01杨森林张国秋李超李克文
杨森林,张国秋,李超,李克文
(青海大学附属医院骨科,西宁 810000)
激素性股骨头坏死 (steroid-induced osteonecrosis of the femoral head,SONFH) 是破坏退行性疾病,是近年来随着糖皮质激素广泛应用而引发的股骨坏死疾病[1]。皮质类固醇是引起SONFH发生的最常见原因[2]。SONFH病理上表现为股骨头局部血液循环障碍导致股骨头供血减少、骨髓间充质干细胞 (bone manrrow mesenchymal stem cells,BMSCs) 成骨分化受到抑制、破骨细胞异常活化,导致骨吸收和新骨重建失衡,最终股骨头坏死、塌陷[3]。目前,SONFH发病机制尚不明确,缺乏统一的治疗方法。因此,寻找相关治疗靶点至关重要。微RNA (microRNA,miRNA) 异常表达影响骨骼代谢[4]。其中,miR-133a在骨骼增殖、分化等功能中发挥重要作用[5],沉默miR-133a表达能够缓解糖皮质激素诱导的骨质疏松,并影响间充质干细胞功能,在骨代谢中发挥重要作用[6]。生长相关转录因子2 (runt-related transcription factor 2,RUNX2) 在骨发育及后期均调解骨形成,RUNX2失活抑制间充质干细胞向成骨分化[7];骨形态蛋白2 (bone morphogenetic protein 2,BMP2) 能够诱导骨和软骨形成,其靶细胞是未分化的间充质干细胞[8]。进一步研究[9]发现miR-133a能够靶向调控RUNX2,抑制miR-133a能够增强RUNX2的活性和增加骨骼修复能力,推测miR-133a在SONFH中可能发挥类似功效影响骨代谢。本研究分析SONFH患者BMSCs中miR-133a的表达情况,探讨miR-133a调控RUNX2/ BMP2信号通路参与SONFH的机制,旨在为SONFH靶向治疗提供参考依据。
1 材料与方法
1.1 样本来源及处理
收集2021年6月至2022年6月青海大学附属医院接受髋关节置换的SONFH患者 (SONFH组) 骨髓(2 mL) 及股骨颈骨折不愈合患者 (对照组) 骨髓 (2 mL)。本研究获得青海大学附属医院伦理委员会批准 (20210403)。将骨髓与含有抗凝剂的10%胎牛血清α-MEM培养液轻轻混合,取BMSCs (1.073 g/mL) 分离液在离心管中放置至室温,转移至15 mL离心管中,液面上缓慢滴加BMSCs分离液,2 000 r/min离心15 min;离心后箭头吸管轻轻吸取云雾状细胞层,经磷酸缓冲液清洗、2 000 r/min离心5 min,弃上清后加10%胎牛血清α-MEM培养液1 000 r/min离心5 min,弃上清后加10%胎牛血清α-MEM培养液,调整细胞浓度为5×105/mL接种至6 cm板中,置于37 ℃、CO2培养箱培养。
1.2 试剂与仪器
引物由上海生工生物工程有限公司合成,RUNX2-3’UTR-WT、RUNX2-3’UTR-MUT、miR-133a模拟物 (miR-133a mimic)、miR-133a模拟物对照 (mimic con)、miR-133a抑制剂 (miR-133a inhibitor)、miR-133a抑制剂对照(inhibitor con)、si-RUNX2均由广州锐博生物科技有限公司提供。一抗RUNX2、BMP2、骨钙素 (osteocalcin,OCN)、Ⅰ型胶原蛋白 (collagen Ⅰ,COL-Ⅰ),二抗山羊抗兔,CCK-8试剂盒 (英国Abcam公司,货号分别为ab236639、ab214821、ab108397、ab34710、ab6721、ab228554);茜素红染色液 (上海爱必信生物科技有限公司,abs42012987);油红O染色液 (上海经科化学科技有限公司,WB1016);cDNA第一条链合成试剂盒 (碧云天科技有限公司,D7178S);双荧光素酶报告基因检测试剂盒 (上海翌圣生物科技股份有限公司,11401ES)。主要仪器包括流式细胞仪 (美国BD公司,FACSCalibur)、实时定量PCR (real-time quantitative PCR,RT-qPCR) 仪 (赛默飞世尔公司,7500)、蛋白凝胶成像仪 (美国Bio-Rad公司,BIO-RADXR)、酶标仪 (深圳汇松科技发展有限公司,MB-530)。
1.3 方法
1.3.1 BMSCs鉴定:
1.3.1.1 细胞表型鉴定 细胞培养至第3代,经胰蛋白酶消化、1 500 r/min离心15 min,收集细胞沉淀,经磷酸缓冲液清洗后制成1×105/mL细胞,取100 μL荧光标记的抗体[CD71、CD44、CD34、人类白细胞抗原DR等位基因 (human leukocyte antigen DR allele,HLA-DR) ]10 μL室温孵育30 min,磷酸缓冲液洗去未标记抗体,上清中添加300 μL磷酸缓冲液,流式细胞术检测细胞表型。
1.3.1.2 定向诱导BMSCs成骨分化 细胞按照1×104/mL接种至细胞爬片上,置于6孔板中,37 ℃、CO2培养箱中培养24 h,吸取原培养液,加入1×10-7mol/L地塞米松、10 mmol/L β-甘油磷酸钠、50 mg/L L-抗坏血酸、5 μg/L rhTGF-β1、10%胎牛血清α-MEM培养液;空白对照添加10%胎牛血清α-MEM培养液培养,倒置显微镜每天观察细胞生长及增殖情况。第21天取出载玻片,茜素红染色鉴定成骨分化能力。
1.3.1.3 定向诱导BMSCs成脂分化 细胞按照3×103/mL接种至细胞爬片上,置于6孔板中,待细胞80%~90%时,加入1 μmol/L地塞米松、0.5 mmol/L IBMX、10 mg/L牛胰岛素、1 mmol/L吲哚美辛、10%胎牛血清α-MEM培养液;空白对照添加10%胎牛血清α-MEM培养液培养,7 d后取出玻片,油红O染色并拍照。
1.3.2 RT-qPCR检测BMSCs中miR-133a、RUNX2mRNA表达:对照组、SONFH组经鉴定的1×105/mL BMSCs,TRIzol法提取总RNA,cDNA第一条链合成试剂盒合成cDNA,RT-qPCR仪检测miR-133a、RUNX2mRNA表达。miR-133a,正向 5’-TTTGGTCCCCTTCAAC-3’,反向 5’-TAGCTATCCTTTGCT-3’;U6,正向5’-CGCTTCGGCAGCACATATAC-3’,反向5’-CAGGGGCCA TGCTAATCTT-3’;RUNX2,正向5’-TTGGAATCGAT GGTAATTATCTTTAG-3’,反向5’-AATCCTATTGCG GTAATCTTACCTTAAT-3’;GAPDH,正向5’-ACGG CAAGTTCAACGGCACAG-3’,反向 5’-GAAGACGC CAGTAGACTCCACGAC-3’。20 μL反应体系:400 ng/μL cDNA 1 μL、2×SYBR qPCR Mix 10 μL、正向/反向引物 (10 μmol/L) 各0.5 μL,ddH2O 8 μL。反应条件:95 ℃、30 s;95 ℃、30 s,miR-133a:61 ℃、30 s;RUNX2:60 ℃、30 s,40个循环。2-ΔΔCt法计算miR-133a、RUNX2mRNA相对表达水平。
1.3.3 Western blotting检测BMSCs中RUNX2蛋白表达:对照组、SONFH组经鉴定的BMSCs细胞添加蛋白裂解酶冰上裂解细胞20 min,12 000 r/min 4 ℃离心20 min,上清即为总蛋白。每个样品 (20 μg) 分离蛋白,PVDF膜280 mA 40 min转膜、5%脱脂奶粉室温封闭2 h,对应一抗RUNX2、GAPDH,4 ℃孵育过夜;加入对应二抗室温孵育1 h,蛋白显色液显膜,蛋白凝胶成像仪拍照并定量分析。
1.3.4 双荧光素酶验证miR-133a与RUNX2的靶向位点:生物信息学软件ENCORI/starBase (https://rnasysu.com/encori/) 预测miR-133a与RUNX2存在结合位点。设计合成RUNX2的3’UTR-WT和MUT,分别与miR-133a mimic或mimic con共转染至SONFH患者骨髓提取的BMSCs中,双荧光素酶报告基因检测试剂盒检测各组荧光素酶活性。
1.3.5 实验分组:实验分为对照组、SONFH组、inhibitor con组、miR-133a inhibitor组、miR-133a inhibitor+si-RUNX2组。除对照组外,其他各组均用SONFH分离的BMSCs实验,按照Lipofectamine 2000试剂说明书分别转染inhibitor con、miR-133a inhibitor、miR-133a inhibitor+si-RUNX2,转染6 h后更换为10%胎牛血清α-MEM培养液。
1.3.6 RT-qPCR检测各组细胞中miR-133a、RUNX2mRNA:各组细胞继续培养48 h,参照1.3.2方法检测。
1.3.7 Western blotting检测各组BMSCs中RUNX2蛋白:各组细胞继续培养48 h,参照1.3.3方法检测。
1.3.8 CCK-8检测细胞增殖情况:各组细胞按照1×105/mL置于96孔板中,每孔100 μL,10%胎牛血清的α-MEM培养液置于37 ℃、5% CO2培养箱中继续培养,分别在培养24、48、72 h时各组对应添加CCK-8试剂 (10 μL) 继续培养2 h,酶标仪检测450 nm处吸光度 (optical density,OD)值。
1.3.9 茜素红染色鉴定细胞矿化能力:各组细胞按照1×105/mL置于6孔板中,继续培养21 d,茜素红染液染色,倒置显微镜下观察矿化结节情况。显微镜视野下每个样品计数5个孔,采用Image-J软件定量分析,每个视野下矿化结节数量为矿化结节相对数量。
1.3.10 Western blotting检测BMSCs中BMP2、BGP、COL-Ⅰ蛋白:各组细胞继续培养48 h,参照1.3.3方法检测。
1.4 统计学分析
利用GraphPad Prism7.0软件进行统计分析,计量资料采用±s表示,两组比较采用t检验;多组比较采用单因素方差分析,组内两两比较采用SNK-q检验。P< 0.05为差异有统计学意义。
2 结果
2.1 BMSCs鉴定结果
结果显示,对照组和SONFH组细胞表面CD71、CD44表达,CD34、HLA-DR不表达。见图1。成骨分化21 d茜素红染色对照组、SONFH组均出现矿化结节,结节呈红色散落分布;空白对照细胞为阴性。见图2。成脂分化7 d油红O染色,显微镜下对照组、SONFH组均可见脂滴被染,呈橙红色;细胞内脂滴沉着,且数量较多,部分细胞内脂滴融合变大成泡状,细胞核位于中央或被挤向外周。空白对照显微镜下未见橙红色出现,未形成脂滴。见图3。以上结果提示BMSCs提取成功。

图1 BMSCs鉴定结果Fig.1 BMSCs identification results
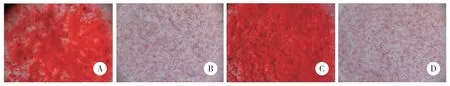
图2 茜素红染色结果 ×40Fig.2 Alizarin red staining results ×40
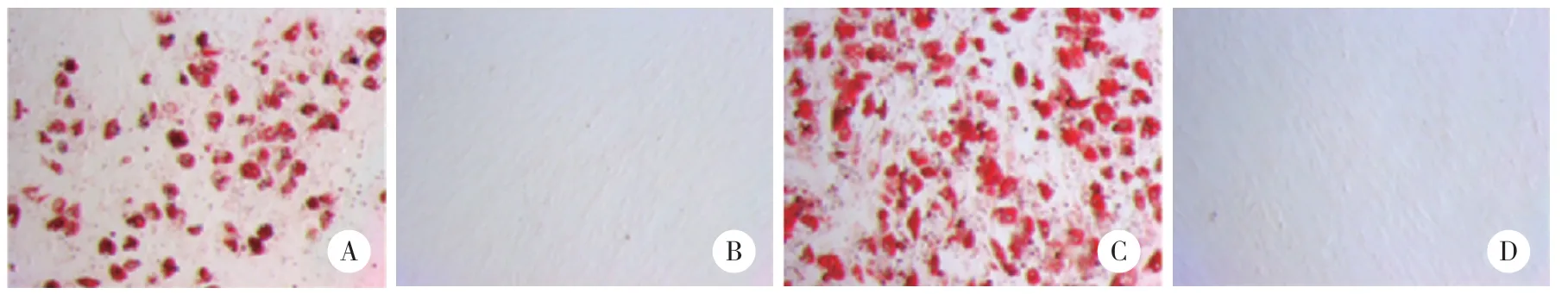
图3 油红O染色结果×100Fig.3 Oil red O staining results×100
2.2 对照组和SONFH组BMSCs中miR-133a、RUNX2 mRNA及蛋白表达
结果显示,与对照组比较,SONFH组BMSCs中miR-133a表达升高 (P< 0.05),RUNX2mRNA和蛋白表达降低 (P< 0.05)。见图4、表1。

表1 对照组和SONFH组BMSCs中miR-133a、RUNX2 mRNA和蛋白表达 (n = 6 )Tab.1 Expression of miR-133a and RUNX2 mRNA and protein in BMSCs in the control group and SONFH group (n = 6 )

图4 对照组和SONFH组BMSCs中RUNX2蛋白表达Fig.4 Expression of RUNX2 protein in BMSCs in the control group and SONFH group
2.3 miR-133a与RUNX2的靶向关系验证
结果显示,miR-133a与RUNX2存在特异性结合位点,见图5。双荧光素酶验证结果显示,与mimic con+RUNX2 3’UTR-WT组 (1.01±0.08) 相比,miR-133a mimic+RUNX2 3’UTR-WT组 (0.52±0.06) 细胞荧光素酶活性下降 (P< 0.05)。而mimic con+RUNX2 3’UTRMUT组 (0.99±0.07) 与miR-133a mimic+RUNX2 3’UTRMUT组 (1.00±0.11) 细胞荧光素酶活性比较差异无统计学意义 (P> 0.05)。

图5 预测miR-133a与RUNX2的特异性结合位点Fig.5 Predicted specific binding sites of miR-133a and RUNX2
2.4 各组BMSCs中miR-133a、RUNX2 mRNA和蛋白表达
结果显示,与对照组相比,SONFH组、inhibitor con组、miR-133a inhibitor组、miR-133a inhibitor+si-RUNX2组BMSCs中miR-133a表达升高 (P< 0.05),RUNX2mRNA和蛋白表达降低 (P< 0.05)。与SONFH组和inhibitor con组比较,miR-133a inhibitor组、miR-133a inhibitor+si-RUNX2组BMSCs中miR-133a表达降低 (P< 0.05),RUNX2mRNA和蛋白表达升高 (P< 0.05)。与miR-133a inhibitor组比较,miR-133a inhibitor+si-RUNX2组BMSCs中miR-133a表达升高 (P< 0.05),RUNX2mRNA和蛋白表达降低 (P< 0.05)。见图6、表2。

表2 各组BMSCs中miR-133a、RUNX2 mRNA和蛋白表达 (n = 6 )Tab.2 Expressions of miR-133a,RUNX2 mRNA,and RUNX2 protein in BMSCs among the groups (n = 6 )
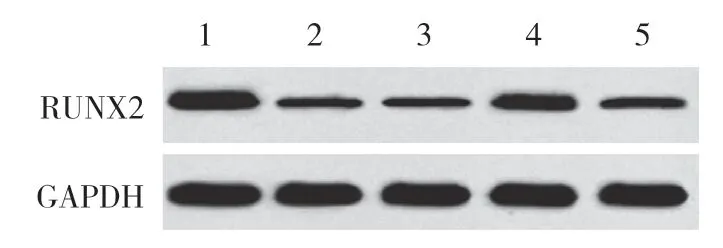
图6 各组BMSCs中RUNX2蛋白表达比较Fig.6 Comparison of RUNX2 protein expression in BMSCs in each group
2.5 miR-133a对各组BMSCs增殖的影响
24、48、72 h检测细胞增殖的结果显示,与对照组相比,SONFH组、inhibitor con组、miR-133a inhibitor组、miR-133a inhibitor+si-RUNX2组OD值降低 (P<0.05)。与SONFH组和inhibitor con组相比,miR-133a inhibitor组、miR-133a inhibitor+si-RUNX2组OD值升高 (P< 0.05)。与miR-133a inhibitor组相比,miR-133a inhibitor+si-RUNX2组OD值降低 (P< 0.05)。见表3。

表3 各组不同时间OD值比较 (n = 6 )Tab.3 Comparison of OD values at different times in each group (n = 6 )
2.6 miR-133a对BMSCs矿化的影响
结果显示,与对照组 (68.48±7.18) 相比,SONFH组 (23.42±3.26)、inhibitor con组 (23.51±3.44)、miR-133a inhibitor组 (53.67±6.26)、miR-133a inhibitor+si-RUNX2组 (34.85±4.09) BMSCs矿化结节相对数量减少 (P< 0.05)。与SONFH组和inhibitor con组相比,miR-133a inhibitor组、miR-133a inhibitor+si-RUNX2组BMSCs矿化结节相对数量增加 (P< 0.05)。与miR-133a inhibitor组相比,miR-133a inhibitor+si-RUNX2组BMSCs矿化结节相对数量减少 (P< 0.05)。见图7。
2.7 miR-133a对各组BMP2、BGP、COL-Ⅰ蛋白表达的影响
与对照组相比,SONFH组、inhibitor con组、miR-133a inhibitor组、miR-133a inhibitor+si-RUNX2组BMSCs中BMP2、BGP、COL-Ⅰ蛋白表达降低 (P< 0.05);与SONFH组、inhibitor con组相比,miR-133a inhibitor组BMSCs中BMP2、BGP、COL-Ⅰ蛋白表达,miR-133a inhibitor+si-RUNX2组BMSCs中BMP2、COL-Ⅰ蛋白表达升高 (P< 0.05);与miR-133a inhibitor组相比,miR-133a inhibitor+si-RUNX2组BMSCs中BMP2、BGP、COL-Ⅰ蛋白表达降低 (P< 0.05)。见图8、表4。
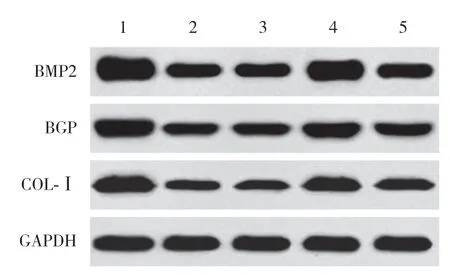
图8 各组BMSCs中BMP2、BGP、COL-Ⅰ蛋白表达比较Fig.8 Comparison of BMP2,BGP and COL-Ⅰ protein expression in BMSCs among all groups
3 讨论
近年来由于激素的不规范使用,SONFH发生率明显增加;激素已成为股骨头坏死的第一致病因子[10]。研究[11]发现股骨头坏死患者成骨分化能力明显降低、坏死组织中出现大量凋亡细胞,成骨细胞数量减少和功能障碍,导致成骨能力不足,引起骨修复障碍,加重疾病。BMSCs具有多向分化潜能,在特定条件下能够成骨分化,在伤口愈合、股骨头坏死的治疗中具有重要作用[12]。因此,发现与BMSCs定向分化有关的因子,进而寻找SONFH治疗靶点尤为重要。本研究发现SONFH组BMSCs矿化结节相对数量比对照组减少,提示SONFH患者BMSCs中成骨分化能力降低,进而影响成骨细胞数量,导致骨修复障碍。
miR-133a抑制剂增强转化生长因子-β1诱导的肌成纤维细胞分化,产生高水平胶原蛋白的肌成纤维细胞,从而导致肺弹性和功能丧失[13]。miR-133a模拟物可诱导线粒体生成和成肌细胞分化,而miR-133a抑制剂会减弱细胞分化[14];miR-133a抑制剂可显著促进糖皮质激素 (地塞米松) 处理的间充质干细胞的细胞增殖、活力和成骨细胞分化,并抑制向脂肪细胞分化[6]。本研究结果显示,SONFH患者BMSCs中miR-133a高表达,BMSCs增殖受到抑制、矿化结节数量减少;降低miR-133a水平后促进细胞增殖、矿化结节数量增加,提示miR-133a可能抑制SONFH患者BMSCs的成骨分化能力和增殖能力。
miRNA靶向调控基因表达影响疾病进展。RUNX2是miR-133a靶基因之一,miR-133a能够靶向抑制RUNX2/BMP2信号通路抑制骨形成,从而负向调节骨折愈合[15]。RUNX2作为成熟成骨分化重要指标和促进分子,在成骨细胞和间充质干细胞中高表达,是骨形成必要转录因子。RUNX2能够通过结合RUNX共有序列 (PuACCPuCA) 调控骨谱系细胞[16],可调控多种因子发挥作用,且这些调控元件在成骨细胞基因启动子中均可找到[17]。BMP2作为RUNX2下游调控因子之一,可作用间充质干细胞,促进间充质干细胞的成骨分化[18]。BGP、COL-Ⅰ作为成骨细胞晚期表型和功能蛋白,在成骨合成、矿化反应、骨形成中发挥作用[19]。本研究发现miR-133a与RUNX2存在靶向结合位点,并经双荧光素酶验证。降低miR-133a表达能够上调RUNX2表达,进而调控下游BMP2水平,升高BGP、COL-Ⅰ表达促进成骨分化。在降低miR-133a基础上干扰RUNX2可逆转上述过程。提示抑制miR-133a的表达能够靶向上调RUNX2的表达,从而促进BMSCs成骨分化和增殖,进而可能缓解疾病进展。
综上所述,SONFH患者BMSCs中miR-133a高表达,抑制miR-133a表达可通过激活RUNX2/BMP2信号通路促进BMSCs成骨分化、增殖。本研究为临床上SOFNH的治疗提供一定理论依据,但RUNX2仅是miR-133a靶基因之一,miR-133a亦可能通过别的靶基因发挥作用,今后需进一步研究论证。
