肝细胞癌自发性破裂危险因素分析及术前临床预测模型建立
2023-12-01韩帅李晓航张城硕杨召铭李峰孙宁张佳林
韩帅,李晓航,张城硕,杨召铭,李峰,孙宁,张佳林
(1.中国医科大学附属第一医院肝胆外科,沈阳 110001;2.宁波大学附属第一医院肝胆外科,浙江 宁波 315010)
肝细胞癌是临床最常见的恶性肿瘤之一,我国乙肝病毒感染人群基数庞大,肝细胞癌的发病率逐年增高。肝细胞癌自发性破裂是肝细胞癌最严重的并发症之一,其发生率占肝细胞癌的2.3%~15%[1-3],一旦肿瘤破裂,患者预后往往较差,约34%~71%患者在肿瘤破裂的30 d内死于失血性休克或术后肝功能衰竭。此外,肝细胞癌自发性破裂也增加了癌细胞转移的风险[4-5]。日本肝癌协会TNM分期中将发生肝细胞癌自发性破裂肿瘤 (不考虑肿瘤大小、数目、是否有血管及胆道侵犯) 归为T4期[6]。
近年来,越来越多的研究聚焦于肝细胞癌自发性破裂的危险因素研究。一些研究者认为,突出于肝脏表面的肿瘤自发性破裂的风险要明显高于被正常肝组织环绕的肿瘤[7-11],且发生破裂的肝细胞癌直径要明显大于未发生破裂的肝细胞癌[7,11-12]。已有研究[7]发现,生长在肝脏左叶的肝细胞癌相对于生长于右叶的肝细胞癌更容易发生自发性破裂。ZHU等[11]研究发现,如果患有高血压或肝硬化等基础疾病的患者其肿瘤更容易出现自发性破裂。肝细胞癌自发性破裂最常见的临床症状是腹部疼痛以及由失血性休克引起的相关临床表现[13-15]。然而,临床上部分肝细胞癌自发性破裂患者入院时并无明显症状。因此,探讨肝细胞癌自发性破裂的危险因素,构建术前临床预测模型意义重大。目前,临床上针对肝细胞癌自发性破裂的临床预测模型尚未见报道。本研究基于中国医科大学附属第一医院肝细胞癌患者的临床资料,探讨肝细胞癌自发性破裂的危险因素并构建术前临床预测模型,旨在为肝细胞癌患者提供针对性的治疗策略,有效改善患者预后提供依据。
1 材料与方法
1.1 临床资料及分组
本研究为单中心回顾性病例对照研究。收集2011年3月至2020年5月就诊于中国医科大学附属第一医院确诊为肝细胞癌自发性破裂患者的临床资料。纳入标准:(1) 术后病理学诊断为肝细胞癌;(2) 未合并其他恶性肿瘤;(3) 无肝脏肿瘤手术史;(4)术前未进行化疗或者放疗;(5) 临床资料完整。共纳入132例 (破裂组)。同期按照同样纳入标准将性别、年龄、体质量指数相匹配的132例肝细胞癌未破裂患者作为对照 (对照组)。本研究已获得医院伦理委员会批准。
1.2 检测指标
通过医院电子病历系统收集2组患者各项临床指标,包括7项临床特征 (高血压病、糖尿病、Child-Pugh分级、乙型肝炎、丙型肝炎、肝硬化、腹水)、4项实验室指标 (甲胎蛋白、国际标准化比值、谷丙转氨酶、血小板计数)、8项影像学特征 (最大肿瘤直径、肿瘤是否位于肝左叶、肿瘤数、食管胃底静脉曲张、门脉侵犯、增强CT检查可见瘤内血管强化、肿瘤突出于肝脏表面、肿瘤累及肝段数)。增强CT可见血管强化的定义[12]:在增强CT检查中,在动脉期、门脉期、静脉期或延迟期4期像中的单个或多个期像观测到肿瘤内血管明显强化于周围肿瘤组织。对照组有多个肿瘤时,选取直径最大的肿瘤测量最大肿瘤直径、肿瘤是否位于肝左叶、门脉侵犯和增强CT检查可见瘤内血管强化等对应影像学特征。
1.3 统计学分析
正态分布的计量资料采用±s表示,组间比较采用t检验;不符合正态分布的计量资料采用M(P25~P75) 表示,组间比较采用Mann-WhitneyU检验。计数资料以率 (%) 表示,组间比较采用χ2检验。单因素分析中具有统计学差异 (P< 0.1) 指标纳入多因素回归分析。将多因素分析中P< 0.05指标纳入术前临床预测模型并绘制列线图,采用受试者操作特征曲线及校准曲线来评估模型,并采取Bootstrap方法内部验证。其中,单因素及多因素回归分析通过SPSS 25.0软件完成;交叉验证、Bootstrap内部验证、绘制列线图、绘制校准曲线通过R (3.63) 软件完成;受试者操作特征曲线通过MedCalc 15.2.2软件绘制。P< 0.05为差异有统计学意义。
2 结果
2.1 肝细胞癌自发性破裂的危险因素分析(表1)

表1 对照组与破裂组患者各项临床指标比较Tab.1 Comparison of clinical data between the control and rupture groups
单因素分析结果显示,破裂组与对照组Child-Pugh分级、国际标准化比值、谷丙转氨酶、最大肿瘤直径、肿瘤是否位于肝左叶、增强CT检查可见瘤内血管强化、肿瘤突出于肝脏表面、肿瘤累及肝段数比较差异有统计学意义 (均P< 0.05)。可见,肝功能较差、肿瘤直径较大以及肿瘤突出于肝脏表面患者更易发生肝细胞癌自发性破裂,位于左叶和供血丰富的肿瘤也更易发生自发性破裂。
将单因素分析中具有统计学差异 (P< 0.1) 指标纳入多因素回归分析。结果如表2所示,Child-Pugh分级为B或C级、最大肿瘤直径>5 cm、增强CT检查可见瘤内血管强化、肿瘤突出于肝脏表面、国际标准化比值高是肝细胞癌自发性破裂的独立危险因素(均P< 0.05)。
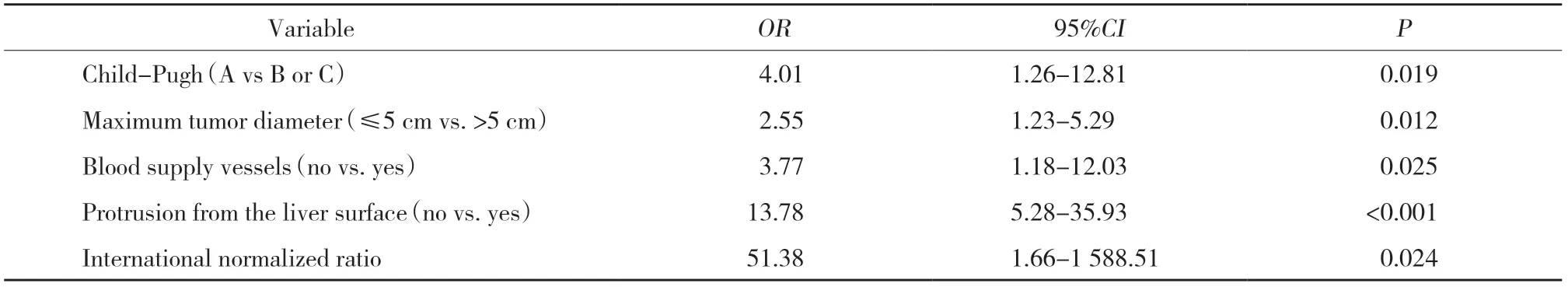
表2 肝细胞癌自发性破裂危险因素的多因素回归分析Tab.2 Multivariable regression analysis of risk factors for spontaneous rupture of hepatocellular carcinoma
2.2 术后临床预测模型的构建及验证
由Child-Pugh分级为B或C级、最大肿瘤直径>5 cm、增强CT检查可见瘤内血管强化、肿瘤突出于肝脏表面、国际标准化比值高5项独立危险因素构建预测模型列线图,见图1。通过模型计算患者发生阳性结果的概率,绘制受试者操作特征曲线,见图2。曲线下面积为0.868 (95%CI:0.821~0.906),结合校准曲线可知,术前临床预测模型对预测肿瘤是否会发生自发性破裂的区分与校准能力良好。内部验证结果显示,模型预测结果与实际观察值一致性良好。见图3。

图1 肝细胞癌自发性破裂术前预测模型Fig.1 Nomogram of the model for predicting spontaneous rupture of hepatocellular carcinoma
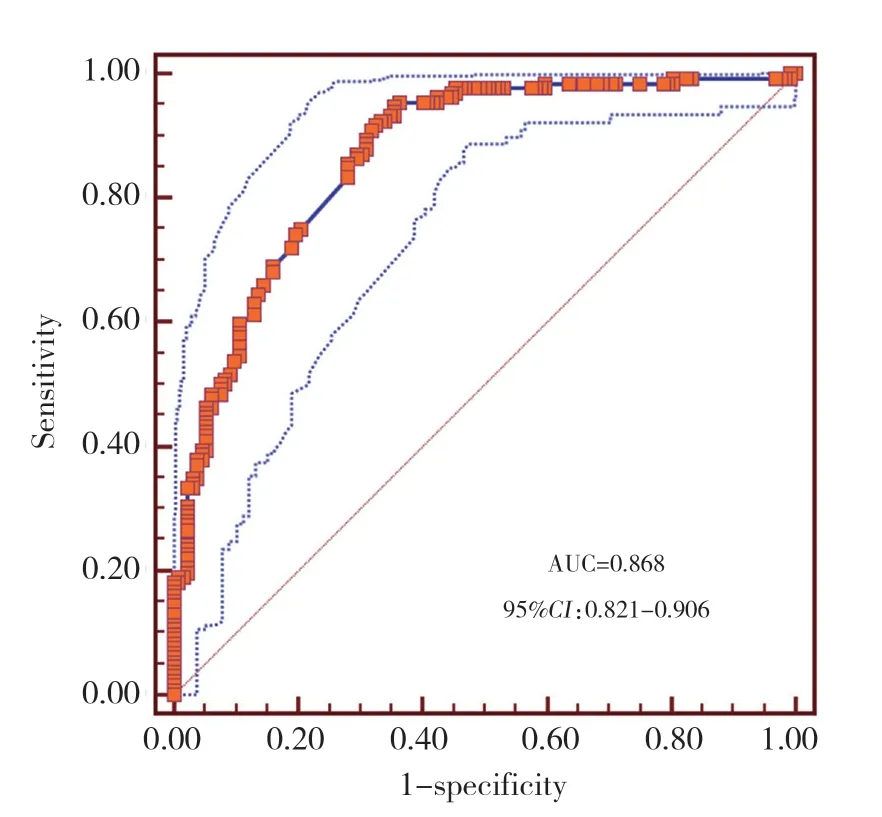
图2 术前预测模型的受试者操作特征曲线Fig.2 Receiver operating characteristic curves for the nomogram
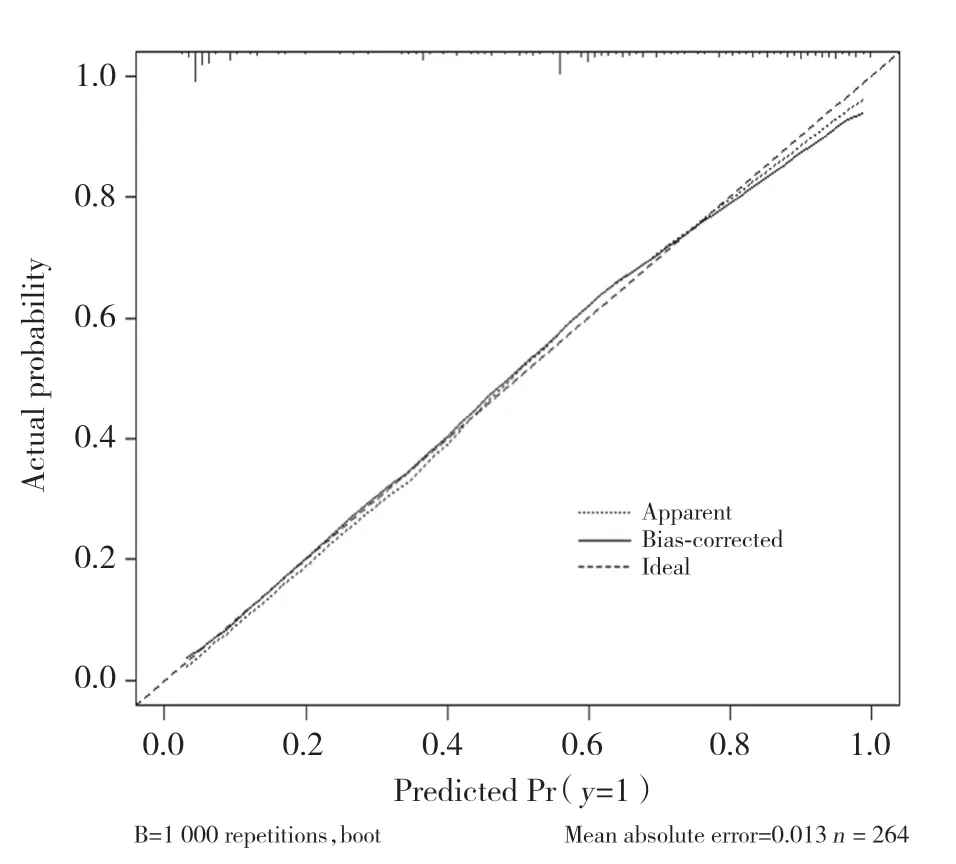
图3 术前临床预测模型的校准曲线Fig.3 Calibration curves for the nomogram for predicting spontaneous rupture of hepatocellular carcinoma
3 讨论
伴随着影像学检查水平及医疗条件的提高,肝细胞癌自发性破裂的诊断准确率正在逐步提升。但仍有部分隐性症状的肝细胞癌自发性破裂患者直至术中才获得确切诊断。虽然已有一些针对肝细胞癌自发性破裂的临床研究,但未能得到广泛的学术认可,临床预测模型[7-8,11-12,16]亦没有经过系统验证。
肝细胞癌自发性破裂的发生机制尚未完全阐明。目前,普遍认可的发生机制是,随着肝内血管的主干或分支被肿瘤侵犯,逐渐阻塞血管内部血流,瘤内血管压力也随之升高,加之肿瘤中心癌组织由于缺血缺氧坏死,肿瘤外周的实性组织随着肿瘤向外部逐渐扩张而变薄弱,直至肿瘤发生自发性破裂[17-18]。另一方面,研究[5,19]显示肝细胞癌自发性破裂患者血管内弹性蛋白退化及Ⅳ型胶原蛋白失活使瘤内血管管壁更加脆弱且缺乏弹性。
本研究结果显示,肿瘤突出于肝脏表面、Child-Pugh分级、肿瘤最大直径>5 cm是肝细胞癌自发性破裂的独立危险因素,与既往研究结论一致。此外,本研究还发现增强CT检查可见瘤内血管强化及国际标准化比值也是肝细胞癌自发性破裂的独立危险因素 (均P< 0.05)。分析其原因可能为:(1) 增强CT显示瘤内血管强化意味着瘤内血管扩张或肿瘤由肝动脉及门静脉的低级别分支供血,皆为瘤内血管内压力较大的体现;(2) 国际标准化比值更高提示患者凝血功能紊乱,存在出血倾向;一旦血管损伤或破溃出血极难控制。
本研究成功构建了肝细胞癌自发性破裂的术前临床预测模型,并根据患者的临床资料预测肝细胞癌发生自发性破裂的概率。术前临床预测模型的预测效能评估及内部验证结果显示,模型可以有效预测肝细胞癌自发性破裂的发生,并具备精简、高效的优点。在此基础上本研究建立了在线化列线图(https://neutrophil.shinyapps.io/dynnomapp/),便于将此成果应用于临床。
肝细胞癌发生破裂后患者预后较差,因此临床上应给予自发性破裂高危风险肝细胞癌患者外科手术优先权,即术前预测模型中划分的高风险肝细胞癌患者,应尽早采取治疗措施,即使尚无明显肿瘤破裂相关的临床症状或体征,只要患者肝脏储备功能及基础状态允许,在具备可切除手术条件时,应尽可能减少手术等待时间。如患者不具备外科手术切除条件或者基础状态及肝脏功能不允许,亦应考虑介入下化疗栓塞或射频消融等替代治疗手段,以改善患者的预后。
综上所述,Child-Pugh分级B或C级、最大肿瘤直径>5 cm、增强CT显示瘤内血管强化、肿瘤突出于肝脏表面、国际标准化比值高是肝细胞癌自发性破裂的独立危险因素。此外,本研究构建的术前临床预测模型具备良好的区分及校准能力,内部验证也显示具备较高的稳定性,因此,术前临床预测模型对识别肝细胞癌自发性破裂高风险患者具备较高的临床应用价值。本研究是基于单中心数据进行的研究,样本量较少,今后需扩大样本量来进一步论证。
