刺槐素对非小细胞肺癌A549细胞的抑制作用及其机制
2023-11-24闫庆韬万斯傲刘意陆健吴占敖
闫庆韬, 万斯傲, 刘意, 陆健,2, 吴占敖
(1. 江苏大学生命科学学院, 江苏 镇江 212013; 2. 江苏大学医学院, 江苏 镇江 212013; 3. 南京大学医学院附属金陵医院口腔科, 江苏 南京 210093)
我国肺癌发病率和死亡率均位于恶性肿瘤首位[1]。由于多数肺癌患者确诊时已属晚期,且肺癌治疗有限、容易复发和易产生耐药性等,其临床治疗成功率很低[2-3]。根据组织学分类,肺癌可分为小细胞肺癌和非小细胞肺癌(non-small cell lung carcinoma,NSCLC),其中NSCLC约占所有肺癌病例85%[4]。NSCLC治疗方法通常为手术、化疗和放疗等,其中化疗是改善癌症患者生活质量和提高生存率的有效治疗手段,但对部分患者无显著治疗效果,部分晚期NSCLC患者仅能存活9~12个月[5]。
已有文献表明,膳食药物可有效降低癌症风险[6],通过饮食中的生物活性化合物抑制或预防癌症也是临床癌症治疗中的重要方法[7]。刺槐素(acacetin)又名金合欢素,化学名5,7-二羟基-4′-甲氧基黄酮,属黄酮类化合物,广泛存在于野菊花、藿香和刺槐等天然植物中[8]。研究表明,刺槐素具有抗肿瘤活性,可通过阻断细胞周期进展和诱导细胞凋亡进而抑制肝癌HepG2细胞[9]和NSCLC A549细胞[10]增殖,但具体作用机制尚未十分清晰。
血管内皮生长因子(vascular endothelial growth factor,VEGF)家族包括VEGF-A、VEGF-B、VEGF-C、VEGF-D、VEGF-E和胎盘生长因子(PLGF)6个成员[11]。其中,VEGF-A常代指为VEGF,在有血管生成的NSCLC组织中呈高表达[12],对维持肺癌发展起重要作用[13],是肺癌治疗的潜在分子靶点[14]。研究表明,NSCLC中VEGF表达水平可影响肿瘤平均血管密度[15],从而影响肿瘤血管生成。在六价铬致人肺支气管上皮细胞(Beas-2B)恶性转化的过程中,VEGF可通过影响迁移和侵袭相关蛋白如E-钙黏蛋白(E-cadherin)和基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)等表达,从而调控细胞迁移、侵袭以及血管生成[16]。在鼻咽癌中,VEGF可通过自分泌调节MMP-9和E-cadherin等蛋白表达,影响细胞迁移、侵袭和血管生成[17]。E-cadherin是上皮间质转化标志蛋白,其在肿瘤细胞中表达降低,进而增强肿瘤细胞侵袭和转移[18]。MMP-9是参与肿瘤细胞转移的蛋白水解酶[19],其表达增加可破坏基底膜和细胞外基质,从而介导肿瘤的侵袭和转移[20-22]。因此,本研究拟以肺癌A549细胞为研究对象,探究刺槐素对其迁移、侵袭及血管生成能力的影响。
1 材料与方法
1.1 细胞、主要试剂及仪器
人肺癌A549细胞及人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)由江苏大学医学院2506实验室馈赠。刺槐素(纯度>97%)购于美国Sigma公司;RPMI-1640培养基、Opti-MEM、胎牛血清、胰酶购于美国Gibco公司;Lipofectamine 2000转染试剂、基质胶购于美国Life Science公司;BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶制备试剂盒、4%低聚甲醛和结晶紫染色液购于上海碧云天生物公司;VEGF-A165兔抗人单克隆抗体购于美国Santa Cruz公司;E-cadherin、MMP-9兔抗人单克隆抗体购于美国Immunoway公司;GAPDH兔抗人单克隆抗体、山羊抗兔IgG二抗购于美国Cell公司;VEGF-A重组质粒由上海吉凯基因化学技术有限公司构建;siRNA由广州锐博生物技术有限公司合成;罗丹明标记鬼笔环肽荧光染料、DAPI核荧光染料购于北京索莱宝公司;Transwell小室(8.0 μm)购于美国Corning公司;血管生成载玻片购于德国Ibidi公司。
细胞培养箱、化学发光凝胶成像分析系统(美国Thermo公司);CKX41倒置显微镜(日本Olympus公司);酶标仪(美国Bio-rad公司);Cytation5细胞成像多功能酶标仪(美国Biotek公司)。
1.2 刺槐素对A549细胞迁移、侵袭及血管生成的影响
1.2.1 细胞培养与刺槐素处理 A549细胞及HUVEC用RPMI-1640完全培养基(含10%胎牛血清、1%链霉素与青霉素)于37 ℃、5% CO2细胞培养箱内培养;细胞生长至融合率达70%时进行传代培养。
将适量刺槐素溶于二甲基亚砜中,配制成1 mg/mL母液,并用0.22 μm滤器过滤后备用。实验时用完全培养基稀释母液至所需浓度(二甲基亚砜终浓度<0.2%)。
1.2.2 MTT法检测细胞活力 将A549细胞分为0、1、2.5、5、10、20、30、40、50 μmol/L刺槐素组。将处于对数生长期的A549细胞以4×104/mL细胞密度接种于96孔板,每孔加入100 μL细胞悬液;待细胞贴壁后,按照分组加入相应浓度刺槐素,0 μmol/L组为对照组,每组设置5个复孔;孵育24 h;弃培养基,每孔加入100 μL溶有MTT(5 mg/mL)的培养基,37 ℃孵育4 h;弃培养基,每孔加入150 μL二甲基亚砜充分溶解振匀,检测490 nm波长处光密度(D)值。细胞活力(%)=D加药组/D对照组×100%,根据公式计算细胞活力。采用软件GraphPad Prism 8.0.1计算刺槐素的半数抑制浓度(half maximal inhibitory concentration,IC50)。
1.2.3 蛋白免疫印迹法检测细胞VEGF、E-cadherin及MMP-9蛋白表达水平 将A549细胞分为0、10、20、40 μmol/L刺槐素组,分别加入对应浓度刺槐素处理24 h;提取各组细胞总蛋白,根据BCA蛋白浓度检测试剂盒测定蛋白浓度。配制10% SDS-PAGE凝胶,80 V电泳30 min,120 V电泳50 min;300 mA转膜90 min,将蛋白转移至PVDF膜;5%脱脂奶粉室温封闭2 h;加入对应VEGF-A、E-cadherin、MMP-9、GAPDH抗体(内参),稀释比均为1 ∶1 000,4 ℃孵育过夜;TBST洗膜3次;加入二抗羊抗兔抗体,稀释比为1 ∶20 000,室温孵育2 h;TBST洗膜3次;加入ECL曝光液显影并拍摄,Image J软件分析目的蛋白相对表达水平。
1.2.4 划痕愈合实验检测细胞迁移能力 将处于对数生长期的A549细胞接种于6孔板中,同“1.2.3”处理后培养至细胞融合率达80%~90%;用200 μL枪头划痕,PBS漂洗2次;加入新鲜培养基,倒置显微镜下观察,每孔随机选取6个视野拍照(0 h);继续培养24 h,于相同视野拍照(24 h)。Image J软件分析计算划痕面积。划痕愈合率(%)=(0 h划痕面积-24 h划痕面积)/0 h划痕面积×100%,根据公式计算划痕愈合率。
1.2.5 Transwell实验检测细胞迁移及侵袭能力 取60 μL基质胶 ∶1%浓度血清的培养基比例为1 ∶5~1 ∶8的混合液,铺匀Transwell小室底部,37 ℃凝固4 h用于细胞侵袭实验。
消化、收集“1.2.3”各组细胞,计数并用含1%血清培养基调整细胞密度;以每孔3×103个细胞(迁移实验)或5×103个细胞(侵袭实验)密度接种于小室中(200 μL/孔);在下室(24孔板)中加入600 μL含20%血清的培养基,每组设3个平行对照,培养24 h;弃上室内培养基,用棉签轻柔除去上室内未迁移细胞,迁移至膜底部的细胞用4%低聚甲醛固定30 min;结晶紫染色30 min;显微镜下随机观察6个视野并拍照记录,Image J软件计数。
1.2.6 免疫荧光实验检测细胞骨架重排能力 消化、收集“1.2.3”各组细胞,以每孔5×103个细胞接种于24孔板中(500 μL/孔),每组设3个平行对照,培养至细胞融合率为40%~50%;弃培养基,每孔加入600 μL 4%低聚甲醛,室温固定20 min;每孔加入600 μL 0.5% Trinton X-100,室温透化10 min;现配含1%浓度牛血清白蛋白的罗丹明-鬼笔环肽工作液(100 nmol/L),每孔加入200 μL工作液37 ℃避光孵育30 min;现配10 μg/mL DAPI染液,每孔加入200 μL染液复染细胞核,室温避光孵育5 min;Cytation5细胞成像多功能酶标仪观察并拍照。
1.2.7 小管生成实验检测细胞血管生成能力 收集“1.2.3”各组细胞上清液分别培养HUVEC 24 h;将基质胶4 ℃过夜融化;血管生成载玻片上每孔加10 μL基质胶,37 ℃放置30 min至基质胶凝固;将HUVEC以每孔1×103个细胞密度加入制备好的血管生成载玻片中(50 μL/孔),每组设置两个平行对照,培养12 h;显微镜下观察并拍照记录,Image J软件分析管腔总分支长度和成管节点数。
1.3 VEGF调控A549细胞迁移、侵袭及血管生成
1.3.1 细胞分组及转染 将A549细胞分为空白对照组、过表达阴性对照组、过表达组、敲减阴性对照组和敲减组;空白对照组细胞仅更换培养基,过表达阴性对照组细胞转染空载体质粒,过表达组细胞转染VEGF-A重组质粒,敲减阴性对照组细胞转染含无义序列siRNA片段,敲减组细胞转染VEGF siRNA。细胞转染过程如下:
使用无双抗的完全培养基传代培养A549细胞并接种至6孔板,继续培养至细胞融合率达70%时,PBS漂洗3次,换为1.5 mL RPMI-1640培养基。用250 μL Opti-MEM稀释2~3 μL Lipofectamine 2000配置成溶液Ⅰ;用250 μL Opti-MEM分别稀释2.5 μg VEGF-A重组质粒、空载体质粒或分别稀释250 nmol/L VEGF siRNA、无义序列siRNA配置成溶液Ⅱ;分别将溶液Ⅰ与各组别溶液Ⅱ混匀,室温静置20 min;加至对应组别的细胞中轻柔摇匀,培养6 h;换液,转染24 h;收集细胞进行后续实验。
1.3.2 蛋白免疫印迹法检测细胞VEGF、E-cadherin及MMP-9蛋白表达水平 提取“1.3.1”处理后的A549细胞总蛋白,后续实验操作同“1.2.3”。
1.3.3 划痕愈合实验检测细胞迁移能力 取“1.3.1”处理后的A549细胞,后续实验操作同“1.2.4”。
1.3.4 Transwell实验检测细胞迁移及侵袭能力 消化收集“1.3.1”处理后的A549细胞,后续实验操作同“1.2.5”。
1.3.5 免疫荧光实验检测细胞骨架重排能力 消化收集“1.3.1”处理后的A549细胞,后续实验操作同“1.2.6”。
1.3.6 小管生成实验检测细胞血管生成能力 收集“1.3.1”不同组细胞上清液分别培养HUVEC 24 h;后续实验操作同“1.2.7”。
1.4 数据统计分析
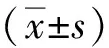
2 结果
2.1 刺槐素抑制A549细胞迁移、侵袭及血管生成
2.1.1 刺槐素抑制A549细胞活力 MTT实验结果显示(图1),与0 μmol/L组相比,10、20、30、40、50 μmol/L刺槐素组A549细胞活力均明显降低(P均<0.05)。分别与1、2.5、5、10 μmol/L刺槐素组相比,20、30、40、50 μmol/L组A549细胞活力均显著降低(P均<0.05),即在一定浓度范围内,随着刺槐素浓度升高,细胞活力逐渐降低。测定刺槐素对A549细胞的IC50为34.49 μmol/L,由此选择10、20、40 μmol/L刺槐素浓度进行后续实验。

a:P<0.05,与0 μmol/L组相比;b:P<0.05,与1 μmol/L组相比;c:P<0.05,与2.5 μmol/L组相比;d:P<0.05,与5 μmol/L组相比;e:P<0.05,与10 μmol/L组相比
2.1.2 刺槐素调控A549细胞中VEGF及迁移与侵袭相关蛋白的表达 蛋白免疫印迹结果显示(图2),与0 μmol/L组相比,10、20、40 μmol/L刺槐素组A549细胞中VEGF和MMP-9蛋白表达水平明显降低(P均<0.01),E-cadherin蛋白表达水平明显升高(P均<0.01);与10 μmol/L组相比,40 μmol/L组VEGF蛋白表达水平明显降低(t=10.750,P<0.05),20、40 μmol/L组MMP-9蛋白表达水平明显降低(t=5.138,15.250,P<0.05或<0.01),20、40 μmol/L组E-cadherin蛋白表达水平明显升高(t=4.495,6.745,P<0.05或<0.01);与20 μmol/L组相比,40 μmol/L组MMP-9蛋白表达水平明显降低(t=8.983,P<0.01),E-cadherin无显著性差异。由此表明,刺槐素可调控A549细胞中VEGF、E-cadherin及MMP-9蛋白表达,呈一定的浓度依赖性。
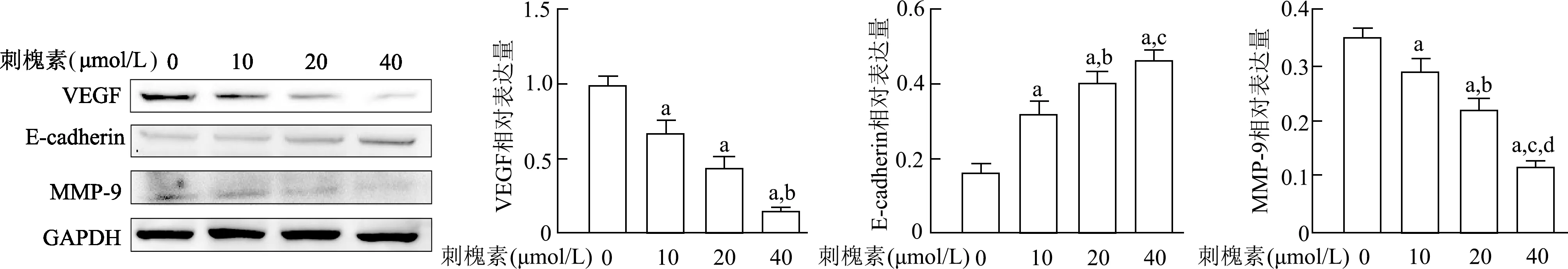
a:P<0.01,与0 μmol/L组相比;b:P<0.05,c:P<0.01,与10 μmol/L组相比;d:P<0.01,与20 μmol/L组相比
2.1.3 刺槐素抑制A549细胞迁移与侵袭 划痕实验结果显示,与0 μmol/L组相比,10、20、40 μmol/L刺槐素组细胞划痕愈合率显著降低(t=7.352,9.719,10.720,P<0.05或<0.01),其中,40 μmol/L组划痕愈合率明显低于10 μmol/L组(t=5.730,P<0.01)。见图3。迁移实验结果显示,与0 μmol/L组相比,10、20、40 μmol/L刺槐素组A549细胞迁移细胞数显著降低(t=5.684,11.700,18.370,P均<0.01);其中,20、40 μmol/L组迁移细胞数明显少于10 μmol/L组(t=6.892,15.000,P均<0.01),40 μmol/L组迁移细胞数明显少于20 μmol/L组(t=9.725,P<0.01)。见图4。

a:P<0.05,b:P<0.01,与0 μmol/L组相比;c:P<0.01,与10 μmol/L组相比

a:P<0.01,与0 μmol/L组相比;b:P<0.01,与10 μmol/L组相比;c:P<0.01,与20 μmol/L组相比
Transwell侵袭实验结果显示,与0 μmol/L组相比,10、20、40 μmol/L刺槐素组A549细胞侵袭细胞数显著降低(t=15.500,22.100,23.890,P均<0.01);20、40 μmol/L组侵袭细胞数明显少于10 μmol/L组(t=5.096,7.367,P<0.05或<0.01),一定范围内侵袭细胞数随刺槐素浓度升高而降低。见图5。免疫荧光实验结果显示,与0 μmol/L组相比,10、20、40 μmol/L刺槐素组中与细胞运动能力直接相关的胞质内丝状团块状骨架肌动蛋白减少,有序性排布减弱。见图6。由此表明,刺槐素可抑制肺癌A549细胞迁移和侵袭。
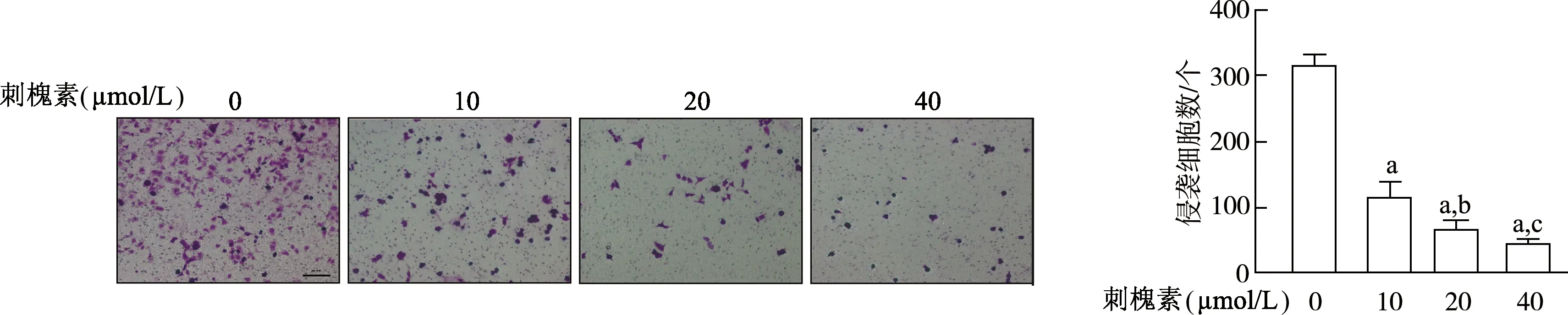
a:P<0.01,与0 μmol/L组相比;b:P<0.05,c:P<0.01,与10 μmol/L组相比

图6 免疫荧光实验检测A549细胞经刺槐素处理后F-肌动蛋白分布及重排情况(×200)
2.1.4 经刺槐素培养的A549细胞上清液抑制HUVEC血管生成能力 小管生成实验结果显示(图7),与0 μmol/L组相比,10、20、40 μmol/L刺槐素组HUVEC小管总分支长度明显缩短及节点数明显减少(P<0.05或<0.01);20、40 μmol/L组小管总分支长度明显短于10 μmol/L组(t=5.495,10.820,P<0.05或<0.01),40 μmol/L组小管总分支长度明显短于20 μmol/L组(t=4.552,P<0.05);40 μmol/L组小管节点数明显少于10 μmol/L组(t=8.854,P<0.01)。由此表明,经刺槐素培养的A549细胞上清液抑制HUVEC血管生成。

a:P<0.05,b:P<0.01,与0 μmol/L组相比;c:P<0.05,d:P<0.01,与10 μmol/L组相比;e:P<0.05,与20 μmol/L组相比
2.2 VEGF促进A549细胞迁移、侵袭及血管生成
2.2.1 调控VEGF表达影响A549细胞中迁移和侵袭相关蛋白的表达 蛋白免疫印迹结果显示(图8),与空白对照及过表达阴性对照组相比,过表达组A549细胞中VEGF、MMP-9蛋白表达水平均明显升高(P<0.01或<0.001),而E-caherin蛋白表达水平明显降低(P均<0.001);与空白对照及敲减阴性对照组相比,敲减组A549细胞中VEGF、MMP-9蛋白表达水平均明显降低(P<0.01或<0.001),而E-caherin蛋白表达水平明显升高(P<0.01或<0.001)。由此表明,调控A549细胞中VEGF表达可影响迁移与侵袭相关蛋白E-cadherin及MMP-9的表达。

图8 蛋白质印迹检测调控VEGF表达水平后A549细胞中迁移侵袭相关蛋白质的表达
2.2.2 VEGF促进A549细胞迁移侵袭 划痕愈合实验结果显示,与空白对照及过表达阴性对照组相比,VEGF过表达组A549细胞划痕愈合率明显升高(t=6.724,6.152,P<0.05或<0.01),VEGF敲减组则明显降低(t=8.757,7.250,P<0.01或<0.05)。见图9。Transwell迁移实验结果显示,与空白对照及过表达阴性对照组相比,VEGF过表达组细胞迁移数明显增多(t=5.840,8.598,P<0.05或<0.01);与空白对照及敲减阴性对照组相比,VEGF敲减组则明显减少(t=11.010,18.020,P<0.05或<0.01)。见图10。

图9 伤痕愈合实验检测调控VEGF表达后A549细胞的水平迁移能力(×40)
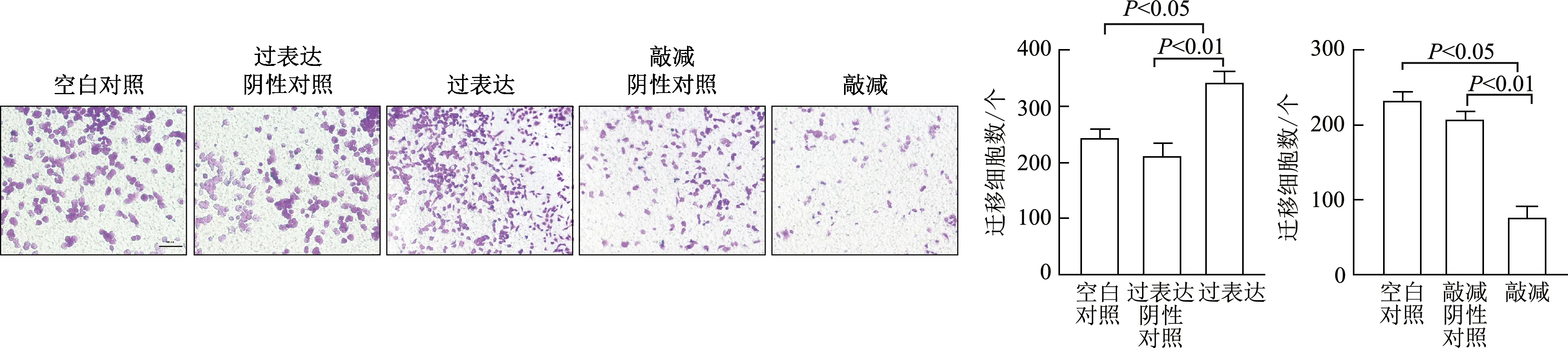
图10 Transwell迁移实验检测调控VEGF表达后A549细胞的垂直迁移能力(×100)
Transwell侵袭实验结果显示,与空白对照及过表达阴性对照组相比,VEGF过表达组侵袭细胞数明显增多(t=4.481,8.536,P<0.05或<0.01);与空白对照及敲减阴性对照组相比,VEGF敲减组则明显减少(t=7.837,17.200,P<0.05或<0.001)。见图11。

图11 Transwell侵袭实验检测调控VEGF表达后A549细胞的侵袭能力(×100)
免疫荧光实验结果显示,与空白对照及过表达阴性对照组相比,VEGF过表达组A549细胞肌动蛋白纤维排列更有序,且胞质荧光强度更强;与空白对照及敲减阴性对照组相比,VEGF敲减组细胞胞质内丝状团块状骨架肌动蛋白减少,且荧光强度减弱。见图12。

图12 免疫荧光实验检测调控VEGF表达后A549细胞F-肌动蛋白分布及重排情况(×200)
2.2.3 VEGF促进A549细胞血管生成 小管生成实验结果显示(图13),与空白对照及过表达阴性对照组相比,VEGF过表达组HUVEC细胞形成小管的管腔完整,轮廓清晰,总分支长度及节点数明显升高(P<0.05或<0.01);与空白对照及敲减阴性对照组相比,VEGF敲减组小管形成不明显,仍有许多散在的细胞团,总分支长度明显变短及节点数明显减少(P<0.05或<0.01)。由此表明,VEGF可促进A549细胞血管生成。
3 讨论
刺槐素是一种具有抗肿瘤活性作用的天然化合物[23]。本研究首先通过MTT法筛选刺槐素加药浓度,发现较低浓度(10 μmol/L)的刺槐素即可抑制A549细胞活力,且抑制作用呈一定的浓度依赖性,IC50为34.49 μmol/L,因此选择低于IC50的20 μmol/L为刺槐素的有效作用浓度,再加入10 μmol/L和40 μmol/L以体现不同刺槐素药物浓度与生物学效应的关系。划痕愈合、Transwell以及免疫荧光实验结果表明,刺槐素可抑制肺癌A549细胞迁移和侵袭,且呈一定的浓度依赖性,初步证实刺槐素在肺癌细胞中的抗肿瘤活性。此外,刺槐素可致A549细胞中VEGF和MMP-9蛋白表达降低,而E-cadherin蛋白表达升高,进一步证实其对A549细胞迁移和侵袭的抑制作用。同时,经刺槐素处理后的A549细胞上清液可抑制HUVEC的小管生成能力,表明刺槐素可能通过抑制A549细胞旁分泌VEGF,从而抑制其血管生成能力。VEGF作为与肿瘤关系最为密切的血管生成因子,可诱导血管生成,为肿瘤侵袭和转移创造条件[13-15,24],因此推测刺槐素可能通过调控VEGF进而抑制A549细胞迁移、侵袭和血管生成。
在本研究中,通过细胞转染上调A549细胞中VEGF蛋白表达后,细胞迁移、侵袭和血管生成能力明显增强;而敲减A549细胞中VEGF蛋白表达后,其结果则相反,由此表明VEGF可调控A549细胞迁移、侵袭和血管生成。此外,VEGF可正向调控A549细胞中MMP-9蛋白表达,负向调控E-cadherin蛋白表达,该结果与VEGF调控A549细胞迁移、侵袭和血管生成能力的现象一致,提示VEGF可能通过上皮间质转化影响细胞迁移和侵袭,并通过MMP-9分解基质,发挥促血管生成作用。由此可见,A549细胞可通过表达VEGF蛋白以自分泌的方式调控MMP-9及E-cadherin等相关蛋白的表达,或以旁分泌的方式刺激内皮细胞,从而促进细胞外基质降解及上皮间质转化并诱导血管形成,为A549细胞迁移、侵袭以及血管生成提供有利条件。
综上所述,本研究表明刺槐素可能通过降低VEGF表达进而抑制肺癌A549细胞迁移、侵袭和血管生成。然而,本研究仅在体外肺癌A549细胞中进行,缺乏体内研究,后续有待通过动物实验进一步阐明VEGF与A549细胞迁移、侵袭及血管生成的相关性。此外,VEGF调节A549细胞生物学功能的相关信号通路仍需进一步研究。