术中洛铂腹腔灌注化疗在原发性肝癌患者中的应用效果▲
2023-11-24麻元亮韦海苏招富林陈家豪
麻元亮 黄 海 韦海苏 招富林 陈家豪
(广西医科大学附属武鸣医院,1 肝胆外科,2 胃肠外科,广西南宁市 530199)
原发性肝癌病程短、进展快、病死率高,是目前我国第4位常见恶性肿瘤及第2位肿瘤致死病因[1],该病严重威胁患者的生命健康,给社会医疗资源和患者家庭带来沉重负担。手术治疗是提高原发性肝癌患者生存率的有效方法,但其术后5年复发率、转移率高达40%~70%[1]。研究显示,原发性肝癌患者腹膜转移发生率为2%~16%[2],是患者预后不良的主要原因。随着医疗水平的提高,腹腔化疗技术也得到快速发展,目前该技术已被用于胃癌、肠癌等的治疗,且均获得较好的疗效[3-4]。研究报告显示,给予肝癌根治术后患者预防性腹腔化疗,可以降低术后腹膜转移的发生率,提高患者生存率[5]。洛铂是第三代铂类抗肿瘤药物,其对多种肝癌细胞系表现出明显的抗癌活性,并且几乎不经肝脏代谢,对肝脏毒副反应小[6]。目前,对于原发性肝癌患者洛铂腹腔灌注化疗的研究数据较少,其临床效果仍需要更多临床数据加以验证。我院对接受原发性肝癌切除术的患者于术中采用洛铂进行腹腔灌注化疗,取得满意的疗效,现报告如下。
1 资料与方法
1.1 临床资料 选取我院2021年1月至2022年8月收治的140例原发性肝癌患者作为研究对象。纳入标准:(1)经临床或病理组织学检查初次诊断为原发性肝癌;(2)Child-Pugh分级为A级或B级;(3)入组前未接受其他针对肿瘤的治疗;(4)年龄25~70岁;(5)根据中国肝癌(China Liver Cancer,CNLC)分期,符合手术切除指征。排除标准:(1)合并严重并发症不能耐受术中化疗者;(2)合并其他恶性肿瘤者;(3)存在心、脑、肺功能障碍等肝切除手术禁忌证者;(4)临床资料不全或出院后失访者。采用随机数字表法将患者分为研究组和对照组,各70例。两组患者的性别、年龄、肿瘤直径、合并症、Child-Pugh分级、CNLC分期等一般资料比较差异无统计学意义(P>0.05),具有可比性,见表1。本研究已获我院医学伦理委员会审核批准[伦理批号:伦审WM-2021(163)],患者均签署知情同意书。
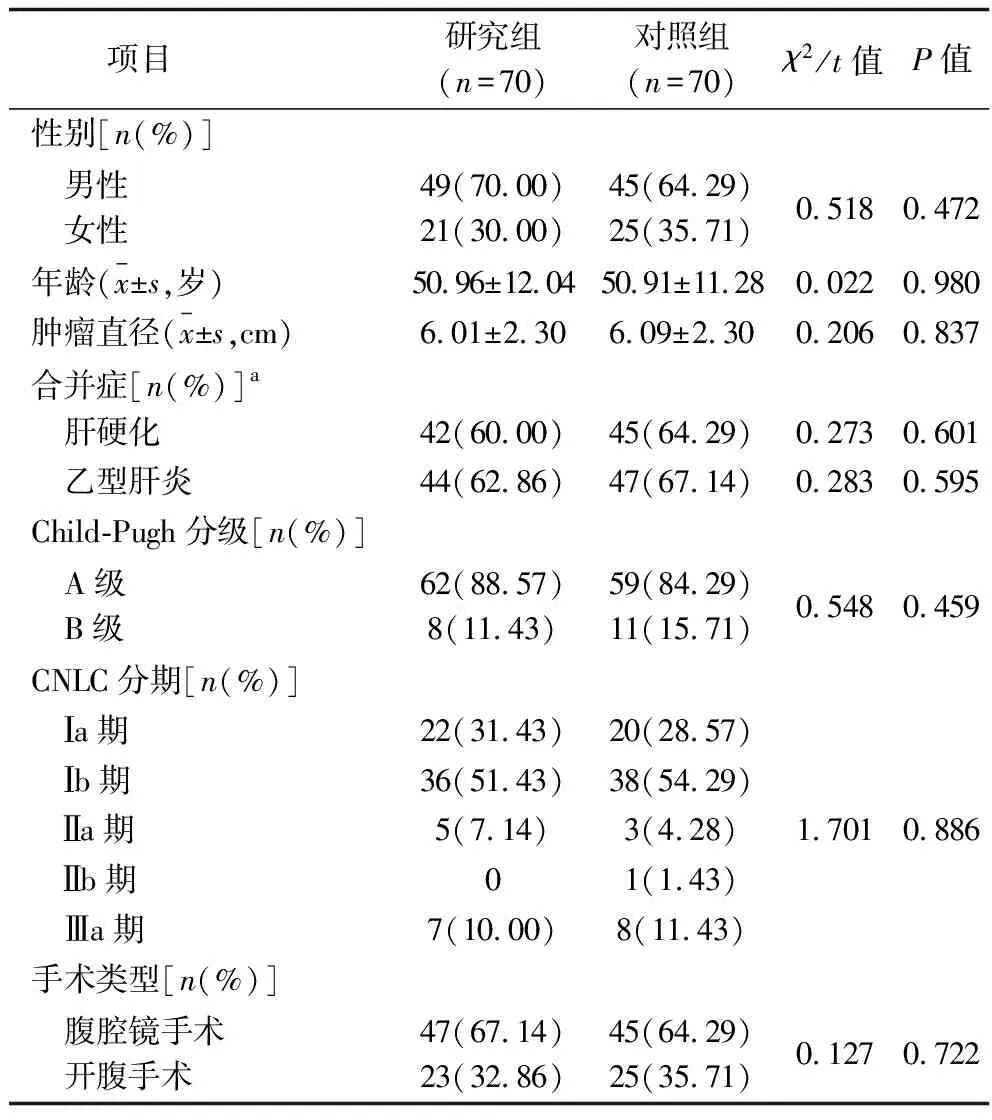
表1 两组患者一般资料的比较
1.2 治疗方法 两组患者均接受腹腔镜下或开腹肝肿瘤切除术治疗,手术由同一组医生及护士完成。术前行CT增强扫描检查,评估肿瘤大小、位置、数目、边缘是否清晰,判断有无静脉癌栓,评估患者肝功能及病灶切除范围。两组均采用气管插管行全身麻醉复合硬膜外麻醉,取仰卧位。行腹腔镜下肝切除术患者于脐下做1 cm切口,建立气腹,置入腹腔镜,采用超声刀切除病灶及其周围至少2 cm组织,病灶切除后送检,使用双极电凝对断面进行止血;行开腹肝切除术患者按常规肝肿瘤切除进行手术,肿瘤切除后进行创面止血。对照组患者于创面止血后立即放置引流管、缝合创口,结束手术。研究组患者在切除病灶后,使用50 mg洛铂(海南长安国际制药有限公司,国药准字H20080359)+200 mL温生理盐水灌洗腹腔20 min,吸除残液后放置引流管,缝合创口。术后密切观察两组患者的生命体征,并给予相应的术后辅助治疗。
1.3 评价指标 (1)肝功能:分别于术前、术后7 d、术后1个月、术后2个月采集患者清晨空腹外周静脉血4 mL,使用全自动生化仪(Beckman Coulter Life Sciences公司,型号:AU5800)检测AST、ALT、总胆红素水平。(2)肿瘤标志物:分别于术前、术后7 d、术后1个月、术后2个月采集患者外周肘静脉血5 mL,使用电化学发光免疫分析仪(Roche公司,型号:Cobas E801)检测血清甲胎蛋白、异常凝血酶原水平。(3)相关实验室指标:分别于术前、术后3 d、术后7 d,采集患者外周肘静脉血5 mL,以检测肌酐、尿素氮、血红蛋白水平,以及白细胞计数、血小板计数等指标。其中,肌酐、尿素氮使用全自动生化仪(Beckman Coulter Life Sciences公司,型号:AU5800)检测,血红蛋白水平、白细胞计数、血小板计数使用全自动血液分析仪(Sysmex公司,型号:Sysmex XN-2800)检测。(4)肝癌根治性切除率:肝癌根治性手术效果的判断标准为术后2个月进行超声、CT和(或)MRI检查(必须有其中两项),未发现肿瘤病灶;术前甲胎蛋白阳性者,在术后2个月内血清甲胎蛋白水平降至正常。以上影像学结果和血清甲胎蛋白水平均符合方可判断为根治性切除。(5)并发症:统计两组患者术后并发症的发生情况,包括恶心呕吐、腹痛、发热、肺部感染、腹腔感染、切口感染等。(6)预后:术后随访6个月,以门诊复查或电话方式进行随访,记录患者肿瘤复发、转移和生存情况。肿瘤复发的诊断标准为术后定期行CT增强扫描或MRI等影像学检查,若肝脏组织内有“快进快出”的典型肝癌影像学表现,记为肿瘤复发[7]。肿瘤转移的判断标准为术后定期行超声、CT、MRI等影像学检查,若发现其他器官(如肺、胸部、脑、骨等)出现新的病灶,记为肿瘤转移。
1.4 统计学分析 应用SPSS 23.0软件进行统计学分析。计量资料以(x±s)表示,组间比较采用两独立样本t检验;重复测量数据采用重复测量方差分析;计数资料以例数(百分比)表示,组间比较采用χ2检验或确切概率法。以P<0.05为差异有统计学意义。
2 结 果
2.1 手术前后两组患者肝功能指标的比较 两组患者的AST、ALT、总胆红素水平比较,差异无统计学意义(F组间=0.230,P组间=0.630;F组间=0.023,P组间=0.880;F组间=1.534,P组间=0.218);两组患者的AST、ALT、总胆红素水平均有随时间变化的趋势(F时间=2 231.186,P时间<0.001;F时间=2 652.278,P时间<0.001;F时间=2 632.550,P时间<0.001);AST、ALT、总胆红素水平分组与时间无交互效应(F交互=0.175,P交互=0.854;F交互=0.668,P交互=0.490;F交互=0.061,P交互=0.943),见表2。
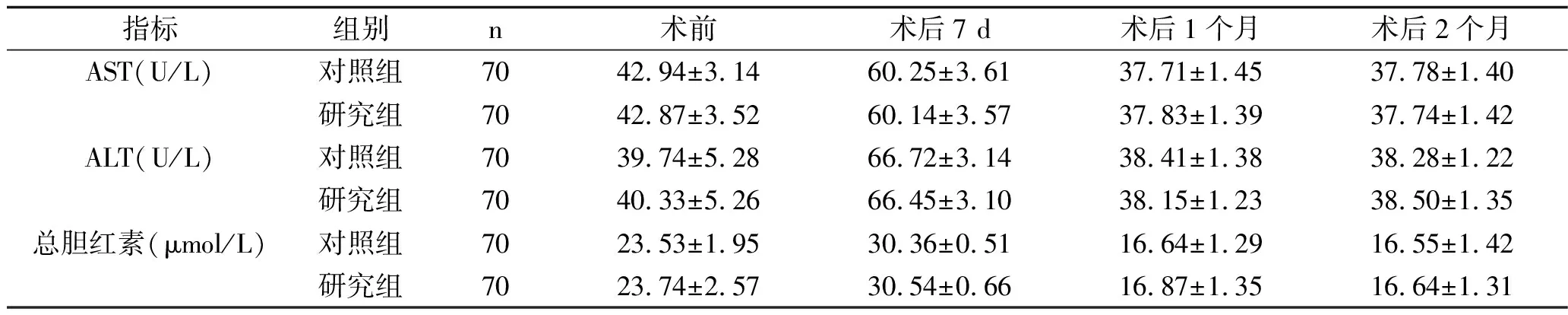
表2 手术前后两组患者肝功能指标的比较(x±s)
2.2 手术前后两组患者血清肿瘤标志物水平的比较 两组患者的血清甲胎蛋白、异常凝血酶原水平比较,差异有统计学意义(F组间=11.016,P组间=0.001;F组间=70.413,P组间<0.001);两组患者的血清甲胎蛋白、异常凝血酶原水平有随时间变化的趋势(F时间=2 728.888,P时间<0.001;F时间=282 165.169,P时间<0.001),血清甲胎蛋白水平分组与时间不存在交互效应(F交互=1.125,P交互=0.308);血清异常凝血酶原水平分组与时间存在交互效应(F交互=11.791,P交互<0.001)。其中,术后7 d、术后1个月、术后2个月,研究组血清甲胎蛋白、异常凝血酶原水平低于对照组(P<0.05),见表3。

表3 手术前后两组患者血清肿瘤标志物水平的比较(x±s)
2.3 手术前后两组患者相关实验室指标的比较 两组患者的肌酐、尿素氮、血红蛋白水平,以及白细胞计数、血小板计数比较,差异无统计学意义(F组间=0.015,P组间=0.904;F组间=0.023,P组间=0.880;F组间=0.171,P组间=0.680;F组间=0.052,P组间=0.820;F组间=0.084,P组间=0.777);两组患者的肌酐、尿素氮水平无随时间变化的趋势(F时间=1.211,P时间=0.300;F时间=0.002,P时间=0.998),而血红蛋白水平、白细胞计数、血小板计数有随时间变化的趋势(F时间=28.975,P时间<0.001;F时间=163.689,P时间<0.001;F时间=17.819,P时间<0.001);上述指标水平分组与时间无交互效应(F交互=0.384,P交互=0.682;F交互=0.068,P交互=0.952;F交互=0.389,P交互=0.678;F交互=0.139,P交互=0.854;F交互=0.003,P交互=0.997),见表4。
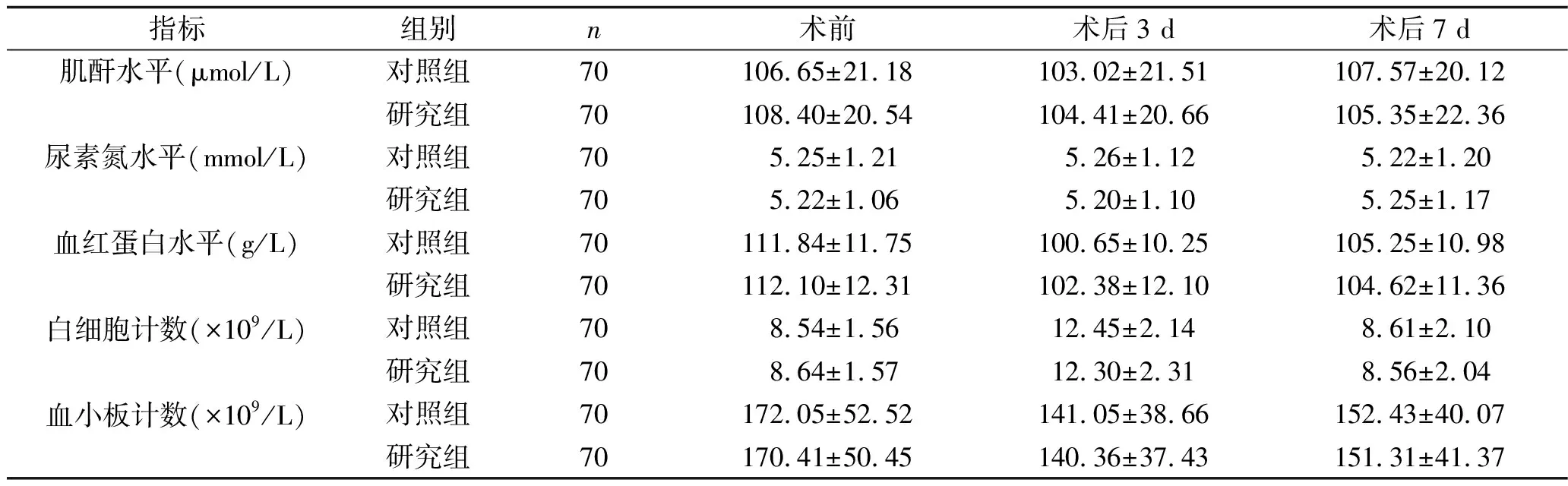
表4 手术前后两组患者相关实验室指标的比较(x±s)
2.4 两组患者肝癌根治性切除率的比较 术后2个月,研究组肝癌根治性切除率为97.14%(68/70),高于对照组的85.71%(60/70)(χ2=5.833,P=0.016)。
2.5 两组患者术后并发症发生率的比较 研究组患者的并发症总发生率为15.71%(11/70),观察组的并发症总发生率为18.57%(13/70),两组的并发症总发生率比较,差异无统计学意义(χ2=0.201,P=0.654),见表5。
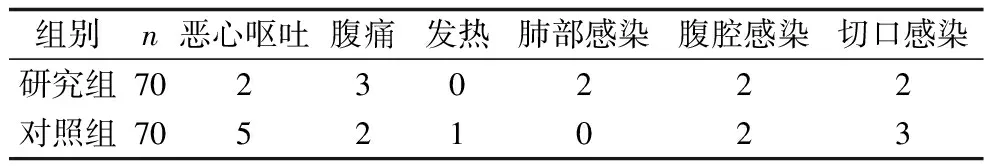
表5 两组患者术后并发症发生率的比较(n)
2.6 两组患者预后情况的比较 术后随访6个月,研究组共2例(2.86%)患者复发,对照组共12例(17.14%)患者复发,研究组患者的肿瘤复发率低于对照组(χ2=7.937,P=0.005)。研究组共1例(1.43%)患者发生转移,对照组共10例(14.29%)患者发生转移,研究组的转移率低于对照组(χ2=7.992,P=0.005)。研究组无死亡病例,对照组1例患者死亡,两组患者的死亡率差异无统计学意义(确切概率法P>0.999)。
3 讨 论
原发性肝癌的发生和发展具有较强的隐匿性,约75%的早期原发性肝癌患者临床症状缺乏特异性,大多数患者确诊时已经进展至中晚期,错过最佳的手术时机[8]。此外,由于肿瘤复杂的免疫微环境,即使接受了根治性切除手术,原发性肝癌患者术后也存在肿瘤复发和转移的可能。有研究表明,解剖性肝切除术可降低肝癌患者术后的复发率,延长患者术后远期生存期[9]。但术中仍难以避免存在肉眼不可见的肝内肿瘤残留、肝切面肿瘤细胞残留与腹腔肿瘤细胞残留,尤其是大肝癌和存在肝癌微破裂者,如果术后的综合治疗措施及机体的免疫力无法清除残留肿瘤细胞,或抑制其生长,可导致肿瘤复发及腹膜转移。对于出现肿瘤腹膜转移的患者,由于“腹膜-血浆屏障”的影响,全身化疗难以取得预期的效果[10]。腹腔灌注化疗是将含有高浓度的化疗药物灌入腹腔进行微循环灌注,通过热疗、局部化疗,以及持续冲刷、过滤肿瘤细胞以杀灭术后脱落于腹膜内的肿瘤细胞,进而达到预防肿瘤细胞在腹膜内种植转移,抑制肿瘤进展的目的[11]。
目前,腹腔灌注化疗技术已经在胃肠外科及妇科恶性肿瘤腹膜转移领域获得Ⅰ级证据,国内也有少部分研究将其应用于肝癌患者腹膜转移的预防[12-13],但尚缺乏多中心随机对照研究提供足够的证据作为支撑。对于化疗药物的选择,顺铂作为第一代铂类抗肿瘤药物,因具有抗癌广谱、作用效果强等优势而被广泛应用于各类肿瘤的腹腔灌注化疗,其虽能够有效降低术后肿瘤的复发率和转移率,但仍存在一定毒性作用[14]。而洛铂作为第三代铂类抗肿瘤药物,其兼备良好的抗癌活性及较小的肝脏毒性。有研究表明,洛铂治疗肿瘤导致的恶性胸腔积液和腹腔积液效果明显[15],且在肝癌治疗中不良反应较轻[16-17]。因此,本研究选择洛铂作为化疗药物,观察腹腔灌注化疗在原发性肝癌中的应用效果,为制订原发性肝癌的治疗方案提供参考。
肝癌患者多合并有慢性肝病,术后使用腹腔灌注化疗可能会增加肝功能衰竭的风险[13]。本研究结果显示,手术前后两组患者的AST、ALT、总胆红素水平比较差异无统计学意义(P>0.05)。这提示在肝癌切除术中采用洛铂腹腔灌注化疗并未增加患者肝功能损伤。分析其原因可能为,洛铂对癌细胞具有较强的细胞毒性,而对正常细胞的毒性相对较低。此外,肝脏具有较强的再生能力,可在一定时间内通过再生修复受损的组织,因此洛铂腹腔灌注化疗对肝脏的损伤作用相对较小。此外,有学者发现,洛铂静脉化疗可导致患者出现血红蛋白和血小板减少[18]。本研究中,两组患者术前、术后3 d、术后7 d的肌酐水平、尿素氮水平、血红蛋白水平,以及白细胞计数、血小板计数比较,差异无统计学意义(P>0.05),提示肝癌切除术中采用洛铂腹腔灌注化疗并不增加患者的肾功能损害及骨髓抑制。分析原因可能为,洛铂灌注腹腔治疗属于局部化疗,不同于静脉用药的全身化疗,其药物主要局限在腹腔内,进入血液循环系统较少,因此对患者的肾功能损伤和骨髓抑制作用相对较小。
甲胎蛋白和异常凝血酶原是诊断肝癌的标志物,两者在肝癌患者血液中的水平异常升高,且其表达水平与病情严重程度密切相关[19]。本研究中,研究组术后7 d、1个月、2个月的血清甲胎蛋白、异常凝血酶原水平低于对照组,且肝癌根治性切除率高于对照组(P<0.05)。这提示与单纯肿瘤切除术相比,术中采用洛铂腹腔灌注化疗能更好地抑制肿瘤细胞的生长,从而增加肝癌根治性切除率,提高近期疗效。腹腔灌注化疗的并发症以恶心呕吐、腹痛、腹胀最为常见,少数患者会出现胰腺炎、腹腔脓肿等严重并发症[20]。本研究中两组患者并发症的总发生率差异无统计学意义(P>0.05)。这提示洛铂腹腔灌注化疗的安全性较高。此外,术后随访6个月,研究组的肿瘤复发率、转移率低于对照组(P<0.05),表明采用洛铂腹腔灌注化疗治疗原发性肝癌远期疗效显著。分析原因可能为,腹膜-血浆屏障可以阻隔化疗药物中大分子物质的进出,经静脉化疗途径给药的化疗药物难以进入腹膜组织,进而影响疗效[11]。洛铂腹腔灌注化疗可将更多的药物较精准地释放到腹腔内,有利于抑制肝癌肿瘤细胞的生长和转移,减少术后肿瘤复发和转移的风险。
综上所述,相较于单纯肝癌肿瘤切除术,肝癌切除术中联合洛铂腹腔灌注化疗能有效提高肝癌根治性切除率,降低患者血清甲胎蛋白、异常凝血酶原水平,减少术后肿瘤复发率、转移率,临床疗效显著,且不增加肝功能损害、肾功能损害及骨髓抑制风险,临床应用安全性高。但本研究的样本量较小,今后需要进一步增加样本量,探讨洛铂腹腔灌注化疗治疗原发性肝癌的疗效。
