基于常规MRI VASARI特征集构建胶质瘤病理分级列线图预测模型▲
2023-11-24陈思睿裴圣林徐小雯陈振宇王梓羽
肖 磊 陈思睿 裴圣林 徐小雯 陈振宇 王梓羽 廖 海
[广西医科大学附属肿瘤医院医学影像中心,广西临床重点专科(医学影像科),广西医科大学附属肿瘤医院优势培育学科(医学影像科),广西南宁市 530021]
胶质瘤是起源于神经上皮的原发性颅内肿瘤,占成人恶性原发性脑肿瘤的60%以上[1],其类型包括星形细胞瘤、少突胶质细胞瘤和室管膜瘤。WHO根据病理表现将胶质瘤分为4个等级,Ⅰ级和Ⅱ级胶质瘤属于低级别胶质瘤,Ⅲ级和Ⅳ级胶质瘤属于高级别胶质瘤,高级别胶质瘤患者的预后往往较差[2-3]。目前,组织活检仍是胶质瘤病理分级的金标准,然而侵入性组织活检具有一定的神经功能损伤风险[4]。因此,亟须寻找一种能够早期评估胶质瘤病理分级的无创方法,以更好地指导个体化治疗方案的制订,以及准确评估患者预后。
由于MRI具有无创、可重复性高等优点,现已成为胶质瘤诊断和疗效评估的重要手段,然而常规MRI信息因其易受放射科医师主观影响,在定量诊断方面存在较大挑战。为了使胶质瘤的MRI特征评估更加准确并可被量化,美国国家癌症研究所于2008年发布了伦勃朗视觉感受图像(visually accessible Rembrandt images,VASARI)特征集以用于评估肿瘤的影像学征象,其通过独特的视觉成像特征帮助影像医师对神经胶质瘤进行全面描述[5]。研究表明,VASARI特征集中的部分特征在评估胶质瘤病理分级、判断分子亚型及预测预后等方面有一定的应用价值[6-9]。然而,目前国内尚未见基于VASARI特征集构建的胶质瘤病理分级列线图预测模型的相关报告。因此,本研究利用常规MRI VASARI特征及临床特征联合构建胶质瘤病理分级列线图预测模型,旨在提高常规MRI在术前胶质瘤病理分级评估中的应用价值。
1 资料与方法
1.1 临床资料 回顾性分析2017年3月至2022年6月于广西医科大学附属肿瘤医院接受手术治疗且经术后病理检查确诊的216例胶质瘤患者的临床资料。纳入标准:(1)根据2016年WHO分类标准确诊为胶质瘤[10];(2)年龄>18岁;(3)确诊前未接受过任何颅内肿瘤相关干预;(4)治疗前均接受MRI检查;(5)未合并其他肿瘤。排除标准:MRI图像质量不佳。最终纳入190例胶质瘤患者,其中男性101例、女性89例,年龄18~87(47.5±14.8)岁。低级别胶质瘤患者共74例,其中14例为少突胶质细胞瘤,3例为室管膜瘤,57例为弥漫性星形细胞瘤;高级别胶质瘤患者116例,其中8例为间变性少突胶质细胞瘤,21例为间变性星形细胞瘤,87例为胶质母细胞瘤。使用RStudio 4.2.2软件R包“sample”函数按照7∶3的比例将患者随机分为训练集(n=133)和验证集(n=57)。
1.2 常规MRI扫描方法 运用GE Discovery MR750 3.0T和SIEMENS MAGNETOM Avanto 1.5T MRI设备采集以下序列的图像,包括轴位T1WI、轴位T2WI、轴位液体衰减反转恢复(fluid-attenuated inversion recovery,FLAIR)及轴位扩散加权成像(diffusion-weighted imaging,DWI)。T1WI参数:重复时间(repetition time,TR)218 ms,回波时间(echo time,TE)4.67 ms,层厚5 mm,矩阵256×256,视野(field of view,FOV)230 mm×230 mm。T2WI参数:TR 4 000 ms,TE 105 ms。FLAIR:TR 9 000 ms,TE 84.88 ms。轴位DWI参数:TR 4 880 ms,TE 77.8 ms,b值取0 s/mm2和1 000 s/mm2。表观扩散系数(apparent diffusion coefficient,ADC)图由机器自动生成。增强扫描采用的对比剂为钆喷酸葡胺,剂量为0.1 mmol/kg,经前臂静脉推注,采集轴位、冠状位及矢状位T1WI图像,参数同平扫T1WI。
1.3 VASARI特征的提取 美国国家癌症研究所发布的VASARI特征集由30个不同的影像学征象组成,包括病灶位置、形态、病灶边缘的形态、病灶附近和远处的改变等定量或半定量参数。本研究中,提取与胶质瘤病理分级更为相关的25个特征用于构建列线图预测模型,包括肿瘤部位(F1)、肿瘤中心点部位(F2)、脑功能区受累(F3)、强化程度(F4)、强化百分比(F5)、未强化百分比(F6)、坏死百分比(F7)、囊变(F8)、多灶或多中心(F9)、T1WI图像与FLAIR图像异常信号面积比(F10)、强化边缘厚度(F11)、强化边缘清晰度(F12)、未强化边缘清晰度(F13)、水肿百分比(F14)、水肿跨中线情况(F15)、出血(F16)、扩散(F17)、软脑膜侵犯(F18)、室管膜侵犯(F19)、皮层受累(F20)、深部脑白质侵犯(F21)、未强化区跨中线情况(F22)、强化区跨中线情况(F23)、卫星灶(F24)、颅骨重塑(F25)。由2名颅脑MRI诊断经验较为丰富的放射科医师根据VASARI特征集对患者的常规MRI图像进行描述,并对其进行积分,意见不统一时与另一名高年资放射科医师商议后决定。VASARI特征集的具体描述及积分方法参照文献[11]。
1.4 统计学分析 采用SPSS 26.0软件和RStudio 4.2.2软件R包进行统计学分析。所有计量资料均服从正态分布且方差齐,以(x±s)表示,组间比较采用两独立样本t检验;计数资料以例数(百分比)表示,组间比较采用χ2检验或Fisher确切概率法。采用单因素和多因素Logistic回归模型分析与高级别胶质瘤相关的因素。根据多因素Logistic回归分析结果构建胶质瘤病理分级列线图预测模型。模型验证时采用Bootstrap法重复抽样1 000次,采用一致性指数评估模型的区分度,采用受试者工作特征(receiver operating characteristic,ROC)曲线评估模型的预测效能,采用校准曲线评估模型的准确性,采用决策曲线分析(decision curve analysis,DCA)评估模型的临床适用性。以P<0.05为差异有统计学意义。
2 结 果
2.1 训练集中高级别、低级别胶质瘤患者临床特征及VASARI特征的比较 在训练集中,高、低级别胶质瘤患者的14个影像特征(F1、F3、F4、F5、F6、F7、F11、F12、F14、F17、F18、F19、F20、F24)及年龄差异有统计学意义(P<0.05),见表1。

表1 训练集中高级别、低级别胶质瘤患者临床特征及VASARI特征的比较
2.2 与高级别胶质瘤相关的因素筛选 在训练集中,将胶质瘤患者的病理分级(高级别=1,低级别=0)设为因变量,以患者性别、年龄和25个VASARI特征设为自变量(赋值见表2),进行单因素Logistic回归分析,结果显示年龄、F3、F7、F13、F14、F17、F18、F19、F20及F24可能与高级别胶质瘤相关(P<0.05),见表3。将单因素分析中有统计学意义的自变量(赋值同表2)纳入多因素Logistic回归分析,结果显示F7、F17及F24与高级别胶质瘤相关(P<0.05),见表4。

表2 变量赋值情况

表3 单因素Logistic回归分析结果
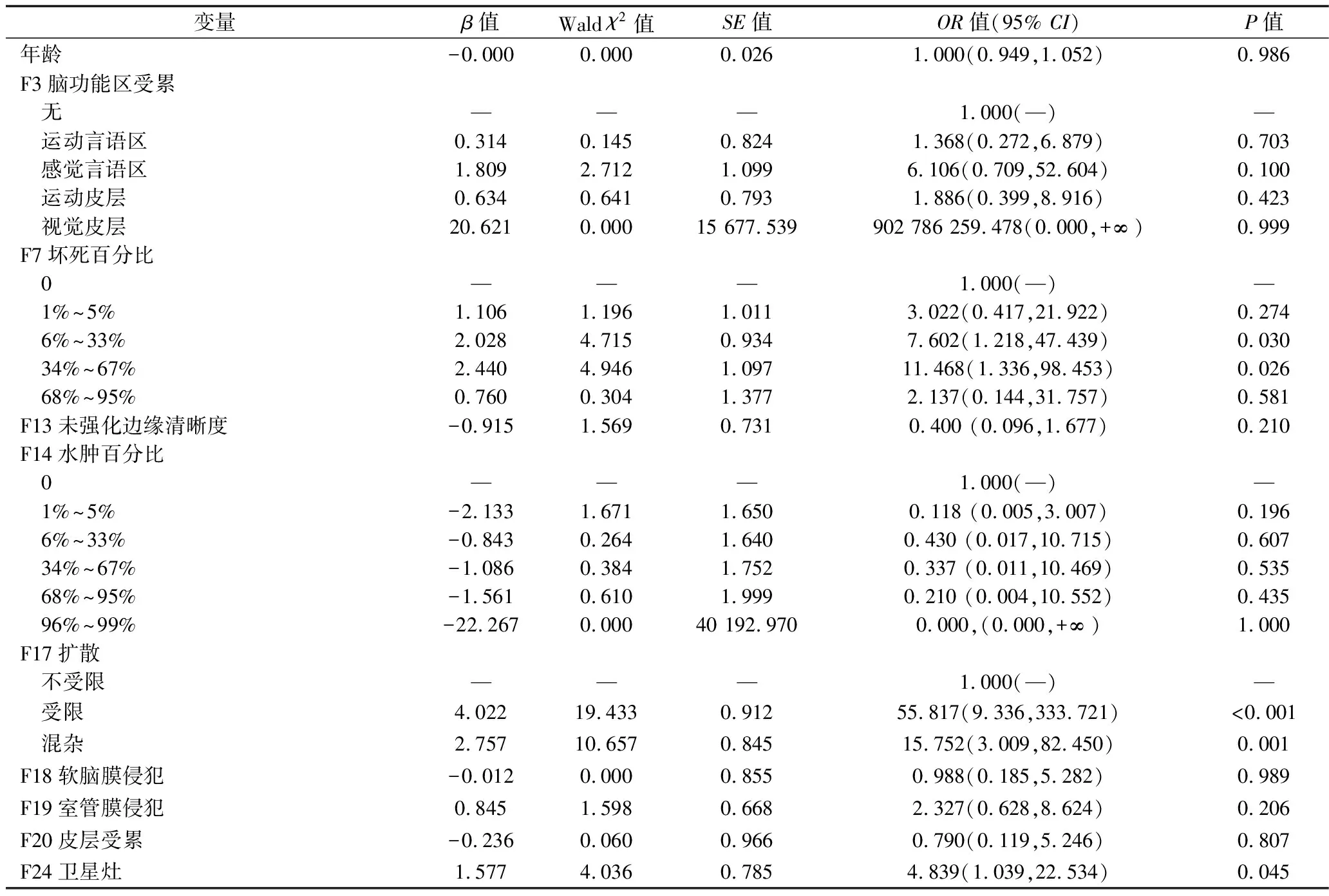
表4 多因素Logistic回归分析结果
2.3 胶质瘤病理分级列线图预测模型的构建及验证结果 利用多因素Logistic回归分析中有统计学意义的变量构建胶质瘤病理分级列线图预测模型(见图1)。对该模型进行内部验证,列线图预测模型的一致性指数为0.902(95%CI:0.852,0.952),说明该模型区分度良好;ROC曲线分析结果显示,在训练集与验证集中该模型的曲线下面积分别为0.903(95%CI:0.853,0.953)、0.860(95%CI:0.760,0.959),说明该模型的预测效能较高,见图2;校准曲线显示预测概率与实测概率吻合程度较高,可见在训练集与验证集中该模型的准确性较高,见图3。
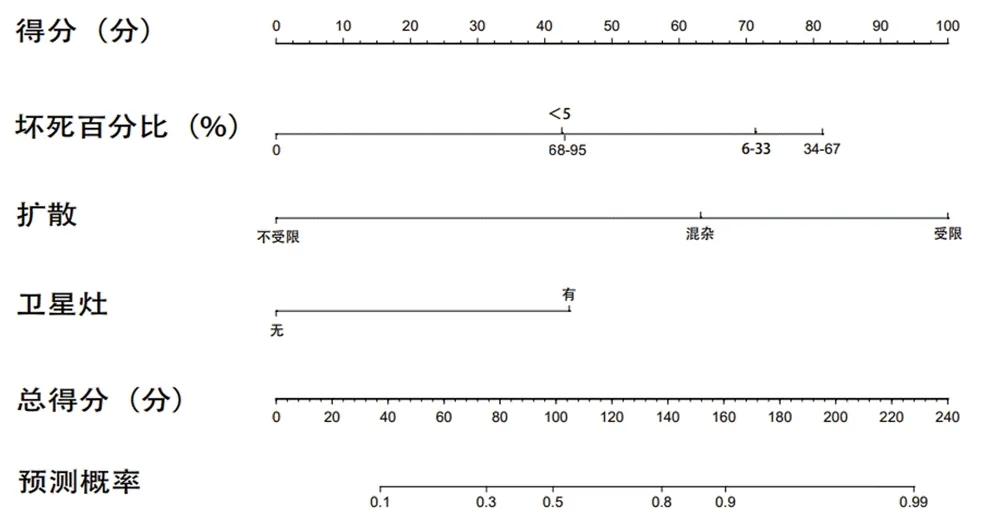
图1 胶质瘤病理分级列线图预测模型
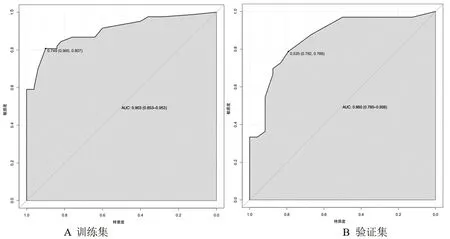
图2 ROC曲线图

图3 校准曲线图
2.4 胶质瘤病理分级列线图预测模型的临床适用性评价 DCA曲线提示,在一定阈值范围内,该模型在评估胶质瘤病理分级(中央粗红色曲线线段)时有较高的净获益性,见图4。
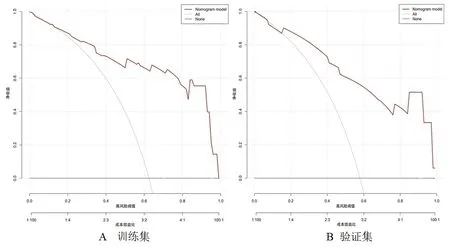
图4 DCA曲线图
3 讨 论
术前准确预测胶质瘤病理分级对于制订治疗策略、评估预后及监测治疗反应至关重要[12]。列线图作为一种简便实用的个体化预测工具,已经被广泛应用于疾病诊断、疗效评估和预后预测等研究中[13],相较于复杂的公式,其具有快速、直观、精确的优势,有利于临床医生进行个体化预测,在胶质瘤病理分级评估中有重要的应用前景。
本研究纳入性别、年龄及VASARI特征集中的25个影像学特征进行分析,结果显示高级别、低级别胶质瘤患者的14个影像学特征(F1、F3、F4、F5、F6、F7、F11、F12、F14、F17、F18、F19、F20、F24)及年龄差异有统计学意义(P<0.05);随后依次进行单因素分析及多因素分析,结果显示有3个VASARI特征与高级别胶质瘤密切相关(P<0.05),分别为坏死百分比(F7)、扩散(F17)、卫星灶(F24)。本研究结果提示高级别胶质瘤的坏死程度往往比低级别胶质瘤更明显,在MRI图像上坏死表现为瘤体内出现范围较大的不规则液性信号区域,信号强度可稍高于脑脊液,瘤壁厚薄不一且通常与瘤体强化程度一致。研究显示,高级别胶质瘤的生物学特点是快速且具有浸润性的蔓延行为和不可控的细胞增殖,这一特点导致微环境内缺氧和糖酵解增加,且通常伴有局部微血管增生,导致坏死的形成[14-15]。Dolen等[16]的研究也表明,坏死与高级别胶质瘤的发生呈正相关。同时,本研究结果提示,相对于低级别胶质瘤,高级别胶质瘤更易出现扩散受限或混杂,前者表现为肿瘤实质部分在轴位DWI序列上呈明显高信号,ADC值明显减低,而后者表现为信号强度介于高、低之间,ADC值正常或稍低。轴位DWI通过观测组织中水分子的弥散运动来预估细胞增殖活性[17],而ADC值反映的是肿瘤实质区多因素对水分子扩散情况的影响[18]。高级别胶质瘤出现此种成像特点,其病理学依据为瘤体级别越高,其内部实性组织细胞数量越多,细胞核变大且表现出高度异型性,导致细胞外间隙变小,使得水分子扩散运动受限加剧,故其ADC值降低、轴位DWI信号增高[17]。彭令荣等[19]发现,胶质瘤的ADC值与病理分级呈负相关,即肿瘤扩散受限情况越明显则为高级别胶质瘤的可能性越大,这进一步佐证本研究结果。此外,本研究结果显示卫星灶也与高级别胶质瘤有关。在VASARI特征集中,卫星灶被描述为在优势肿瘤周围的信号异常区域内的异常增强区域,但其任意部位与优势肿瘤都不相连,此定义与传统临床上认为的多灶性胶质瘤(即不同病灶在空间和/或发生时间上相互独立)的概念有所差异[20]。既往研究表明,MRI图像上瘤周出现卫星灶预示着脑胶质瘤病理等级较高,患者的总生存期缩短[21]。Batzdorf等[22]于1963年将胶质瘤从某个原发灶扩散到其他脑实质的行为定义为多灶性扩散,在MRI图像上典型表现为环绕原发灶周边出现多个大小不等、边界欠清楚的“卫星灶”。因此,笔者认为卫星灶可以被视为肿瘤由单灶性向多灶性发展的一个“中间产物”,而高级别胶质瘤中卫星灶出现的次数增加提示肿瘤从某个原发灶通过多灶性扩散的方式散播到其他脑实质的倾向增加。由此可见,上述3个VASARI特征与高级别胶质瘤密切相关,故本研究基于这3个重要特征构建胶质瘤病理分级列线图预测模型,获得的预测模型的一致性达0.902,提示该模型对高级别、低级别胶质瘤的区分度良好。ROC曲线结果提示,该模型的曲线下面积大于0.85,说明该模型具有较好的预测能力。此外,校准曲线提示预测概率与实测概率吻合程度较高,DCA曲线也提示该模型在预测胶质瘤病理分级中具有较高的临床价值。因此,本研究构建的胶质瘤病理分级列线图预测模型具有较高的准确性、稳定性和临床获益性。该模型或可作为临床术前准确预测胶质瘤病理分级的一种简便实用的个体化预测工具。
本研究仍存在一些局限性。首先,本研究是单中心研究,且研究样本量相对较小,未来需要开展多中心、大样本研究来证实当前研究结果。其次,本研究在临床特征方面仅纳入了患者的年龄与性别,今后需要增加更多有助于预测胶质瘤病理分级的生化指标。
总之,VASARI特征集中的坏死百分比、扩散、卫星灶与胶质瘤的病理分级密切相关。基于上述参数建立的胶质瘤病理分级列线图预测模型不仅具有可视化、可量化及操作简便的优点,而且还具有较高的预测效能,提升常规MRI在胶质瘤术前病理分级评估中的临床应用价值。
