脓毒症相关凝血功能紊乱的研究进展
2023-11-24白凡白欢华中科技大学同济医学院附属同济医院检验科武汉430030
白凡,白欢(华中科技大学同济医学院附属同济医院检验科,武汉 430030)
脓毒症是宿主对感染的反应失调所导致的危及生命的器官功能障碍综合征[1],发病率高、病死率高,是重症监护病房(intensive care unit,ICU)患者的首要死因[2]。脓毒症的发生、发展与预后转归往往伴随凝血功能异常,轻者仅存在轻微血小板减少和/或亚临床型凝血激活(高凝状态),重者则伴随失控的系统性凝血激活、微血管血栓的大量沉积,最终导致血小板与凝血因子的大量消耗,弥散性血管内凝血(disseminated intravascular coagulation,DIC)形成[3-4]。脓毒症抗凝治疗尚存争议,精准识别脓毒症凝血紊乱阶段,进而准确把握合适的抗凝时机,可能是脓毒症患者抗凝治疗获益与否的关键。本文旨在就脓毒症相关凝血功能紊乱发生机制、脓毒症DIC及脓毒症抗凝治疗等作一简要综述。
1 脓毒症相关凝血紊乱机制
1.1脓毒症促凝活性上调
1.1.1组织因子高表达 组织因子(tissue factor,TF)为Ⅰ型整合膜糖蛋白,存在于血管系统中的多种细胞表面,如单核/巨噬细胞、中性粒细胞、血小板、内皮细胞等,为细胞因子受体超家族成员[5-6]。生理状态下,TF仅极少量存在于循环血液中,而在脓毒症中,由于病原体及内毒素诱发机体产生大量促炎细胞因子,主要包括肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-1、IL-6和IL-8等,致使单核细胞、内皮细胞大量表达TF。大量表达的TF又可募集、活化循环中的Ⅶ因子(FⅦ),并与FⅦ(a)形成TF-FⅦ(a)复合物,介导外源性凝血途径,导致凝血酶大量生成,继而纤维蛋白凝块大量形成、沉积,微血管血栓形成,严重者可导致组织灌注障碍、多器官功能衰竭,甚至死亡。在此过程中,参与外源凝血途径的凝血因子(如FⅦ等)被不断消耗,导致凝血酶原时间(prothrombin time,PT)延长,PT是筛查外源性凝血途径因子缺乏的临床常用指标,其延长程度与不良预后显著相关[7]。TF在“炎-凝交互”中处于中心位置,并充当重要桥梁,是炎症诱导凝血激活的关键启动因子[8-9]。基于此,针对TF的靶向治疗方案对缓解脓毒症患者凝血紊乱、改善多器官功能不全,进而降低病死率可能有益。然而,尽管在脓毒症动物模型中,给予外源性TF及TF-FⅦa抑制物,如组织因子途径抑制剂(tissue factor pathway inhibitor,TFPI)对缓解炎症诱导的凝血功能紊乱有极好的获益[10-11],但在针对人体的临床随机对照试验中却并未显示出明显疗效[6]。
1.1.2血小板激活 近年来越来越多的研究证实,血小板除参与脓毒症凝血过程外,亦广泛参与炎症、免疫、补体激活等多种病理生理过程[12-14]。血小板的进行性减少与其病死率增加显著相关,是脓毒症患者预后的良好预测指标[15-16]。在脓毒症中,由入侵人体的病原体、内毒素、脂多糖等成分组成病原体相关分子模式(pathogen associated molecular patterns,PAMPs)和由活化或凋亡细胞所释放的核物质、组蛋白等成分组成损伤相关分子模式(damage associated molecular patterns,DAMPs),通过识别血小板表面蛋白酶激活受体(protease-activated receptors,PARs),主要为Toll样受体(Toll-like receptors,TLR),激活血小板[9];此外TF-FⅦa介导的外源性凝血途径及内源性接触激活凝血途径所生成的凝血酶,亦是血小板的强力激活剂[9,12]。血小板被激活后,一方面可与受损血管暴露的胶原及血管性血友病因子(von Willebrand factor,vWF)结合,并发生黏附、聚集、活化,形成血小板栓子,堵塞微血管[12];另一方面活化的血小板表面构象发生改变,暴露带负电荷的磷脂酰丝氨酸表面,为凝血酶复合物形成提供良好的反应场所,加速凝血级联反应的过程[12];此外,活化的血小板还可招募并结合、聚集于中性粒细胞表面,是中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs)释放的关键触发因子。NETs在脓毒症凝血紊乱中可直接激活血小板、参与微血管血栓形成,并抑制纤溶[17-18]。再者,激活的血小板亦可通过自分泌及旁分泌方式释放血栓烷A2 (thromboxane A2,TXA2)及二磷酸腺苷(adenosine diphosphate,ADP)等物质,进一步以指数方式扩大血小板的激活,加剧凝血紊乱[19]。另外,白细胞介素-1β(interleukin-1β,IL-1β)主要由激活的血小板释放,激活的血小板可通过IL-1β、核因子κB(nuclear factor kappa-B,NF-κB)等多种途径参与并加剧炎症反应,形成恶性循环[12]。基于血小板在脓毒症凝血紊乱、炎症反应中的重要作用,抗血小板治疗对缓解脓毒症患者凝血功能紊乱、减轻炎症反应,继而改善多器官功能不全,提高生存率体现出巨大的潜在价值[20]。当前抗血小板治疗的药物主要包括环氧化酶抑制剂(如阿司匹林等),P2Y12受体抑制剂(如氯吡格雷、替格瑞洛等)、血小板糖蛋白(GPⅡb/Ⅲa)受体拮抗剂(如替罗非班等)、凝血酶受体抑制剂、5-羟色胺受体拮抗剂等几大类[21],其中环氧化酶抑制剂、P2Y12受体抑制剂及GPⅡb/Ⅲa受体拮抗剂目前应用最为广泛[22]。既往开展的大量动物试验及临床回顾性研究均显示出抗血小板治疗在降低脓毒症病死率、改善预后上的显著功效[23-25],然而当前研究尚缺乏证据等级更高的大型前瞻性随机对照试验数据的支持[20]。
1.1.3NETs促微血栓形成 NETs是由活化的中性粒细胞所释放的染色质细丝网状结构物质,主要由组蛋白、DNA链、溶酶体酶(如髓过氧化物酶,中性粒弹性蛋白酶,组织蛋白酶G等)及蛋白质等组成[26]。在脓毒症中,各种不同种类的病原体,如细菌、真菌、病毒等,炎症细胞因子、活性氧自由基(reactive oxygen species,ROS)等均可活化中性粒细胞、释放NETs,此外,特别值得关注的是,激活态的血小板亦可导致中性粒细胞活化,是促使NETs形成的强效诱导剂[27]。NETs可诱捕、限制及杀灭入侵病原体,最初被认为是机体固有免疫系统的重要组成部分[28]。然而近来越来越多的证据表明,NETs在脓毒症“炎-凝交互”过程中扮演重要角色,是促使广泛微血管血栓形成,导致严重凝血功能紊乱的重要因素[29-31]。Fuchs等[17]最早报道,NETs形成后可募集血小板、红细胞及其他一些参加血栓形成的组分,如vWF、纤维连接蛋白、纤维蛋白原、细胞衍生组织因子等,其三维立体空间结构本身具备促进血栓形成的能力,此外,NETs与纤维蛋白共位,可与微血栓中纤维蛋白链紧密交联,从而可加固所形成的血栓结构稳定性[17,32]。再者,NETs中的组分,如组蛋白、DNA、酶类及蛋白质等具有极强的促栓属性,可促进微血栓形成。基于NETs在脓毒症凝血功能紊乱中的重要作用,有学者提出,NETs可作为治疗脓毒症微循环功能障碍最佳的治疗靶点[33]。试验表明,抑制NETs可同时减少血管内凝血及器官功能损伤,而单纯的抗凝治疗对器官机能恢复并无显著疗效。然而当前以NETs为靶标治疗人群脓毒症的研究尚待开展。
1.1.4微粒体的促凝活性 微粒体(microparticles,MPs),亦称之为胞外囊泡(extracellular vesicles,EVs),是由活化或凋亡的血小板、单核细胞、内皮细胞等释放入血浆或其他部位的,大小在亚微米级别、包被磷脂双分子层的球形粒子[34],在脓毒症凝血紊乱、DIC、微血管血栓栓塞、多器官功能不全等病理生理过程中扮演至关重要的作用[34]。MPs表达促凝活性,主要通过以下两方面[35-36]:(1)MPs表面的磷脂双分子层可为凝血级联反应的顺利进行提供良好的催化表面;(2)MPs富含TF,而TF是外源性凝血途径激活的重要启动因子,通过与循环中FⅦ(a)结合,启动外源性凝血反应过程。值得关注的是,血小板源性的MPs被认为是导致脓毒症凝血紊乱的主要类型,而内皮细胞、白细胞、红细胞及其他细胞来源的MPs亦广泛参与炎症及凝血反应的过程[29,37]。基于MPs强大的促凝属性及在脓毒症凝血紊乱中的重要作用,针对MPs的靶向治疗似乎前景远大。Boisrame-Helms等[38]报道,在小鼠脓毒症休克动物模型中,采用活化蛋白C治疗可显著降低白细胞源性MPs,从而限制血管炎症反应,并改善血流动力学。Essandoh等[39]研究发现,在小鼠脓毒症动物模型中,预先用鞘磷脂酶抑制剂阻断被细菌感染的巨噬细胞释放MPs,可保护心脏功能,并延长生存时间。然而当前的研究尚处于动物试验阶段,缺乏更多人体临床试验数据支持,其在脓毒症人群治疗中的安全性及有效性如何尚待进一步论证。
1.2脓毒症抗凝机制下调 完整的血管内皮、足够的抗凝蛋白是保证抗凝机制正常运转的关键[40]。在脓毒症中,病原体、内毒素、脂多糖及炎症介质等均可导致血管内皮受损、糖萼降解,血管内皮结构破坏,机体的血管内皮继而由抗凝抗栓属性向促凝促栓特性转变[41-42],其发生原因包括:一方面受损的血管内皮可募集白细胞、血小板,活化的血小板粘附、聚集在内皮细胞表面,促进微血栓的形成;另一方面血管内皮细胞受损、糖萼降解致使抗凝抗栓组分,如一氧化氮(nitric oxide,NO)、前列环素(prostacyclin)、组织因子途径抑制物(tissue factor pathway inhibitor,TFPI)、硫酸乙酰肝素(heparan sulfate)等合成分泌减少,并使血栓调节蛋白(thrombomodulin,TM)及内皮细胞蛋白C受体(endothelial cell protein C receptor,EPCR)结构、功能及完整性遭到破坏。TFPI合成减少,致使经TF启始的外源性凝血途径不能得到有效抑制,凝血反应不断放大;抗凝血酶(antithrombin,AT)因硫酸乙酰肝素合成分泌减少,抗凝活性大大降低;而抑制蛋白C(protein C,PC)因缺乏TM及EPCR辅助,激活及抗凝活性受抑。AT是机体发挥抗凝作用最重要的抗凝蛋白,主要在肝脏中合成,脓毒症发生、发展过程中大量生成的凝血酶可极大中和、消耗循环中的AT,此外,脓毒症所致肝损伤亦会使其合成减少,再者,血管受损、通透性增加,亦会导致AT丢失增多,最终导致循环血液中AT浓度减少,抗凝活性降低[41,43]。血浆中AT水平与脓毒症炎症反应、内皮受损、凝血紊乱及重要脏器功能不全均显著相关,有学者提出可将其作为预后评估的良好生物标志物[44]。脓毒症抗凝治疗尚存争议[45],然基于血管内皮在脓毒症凝血紊乱中的重要作用,保护内皮糖萼、重建糖萼功能似乎更具临床现实意义,当前针对保护、重建血管内皮糖萼功能的治疗措施主要包括液流管理、血糖控制、糖皮质激素治疗、血浆蛋白输注、肝素及类肝素使用、糖萼成分补充等方面,并取得良好临床获益[41]。
1.3脓毒症纤溶系统“关闭” 适中的纤维蛋白溶解是保证凝血激活后,沉积于血管的不可溶纤维蛋白得到及时有效清除,进而使得血管通畅、防止血栓形成的关键[46]。纤溶系统的核心组成成分为纤溶酶原(plasminogen),此外,组织型纤溶酶原激活物(tissue type plasminogen activator,t-PA)、尿激酶型纤溶酶原激活物(urokinase type plasminogen activator, u-PA)、纤溶酶原活化剂抑制物-1(plasminogen activator inhibitor -1,PAI-1)及纤溶酶原活化剂抑制物-2(plasminogen activator inhibitor-2,PAI-2)及α2-纤溶酶抑制物(α2-plasmin inhibitor,PI)作为主要成分参与其中,共同保证纤溶系统稳态的维持[46]。PAI-1的大量释放与凝血酶激活的纤溶抑制物(thrombin-activatable fibrinolysis inhibitor,TAFI)的广泛激活是脓毒症纤溶“关闭”两大主要原因[27,47]。纤溶“关闭”致使沉积于微血管的纤维蛋白得不到及时、有效清除,从而导致血流堵塞、组织灌注障碍,多器官功能不全,甚至死亡。Semeraro等[47]研究指出,纤溶“关闭”与脓毒症患者90 d病死率升高相关,PAI-1水平升高与TAFI水平降低(注:伴随激活态的TAFI水平升高,TAFI因激活、消耗而减少)是预测脓毒症患者短期死亡的独立危险因素,可作为脓毒症患者危险分层及治疗监测的良好指标。当前有关以纤溶标志物为治疗靶点的临床试验仍近乎于空白[47],基于纤溶系统在脓毒症凝血紊乱中的重要作用,后续相关的研究值得尝试。
2 脓毒症与DIC
DIC作为脓毒症凝血功能异常最为严重的类型,广泛存在于严重脓毒症及脓毒性休克患者中,约35%的脓毒症患者可伴随DIC的发生,入住ICU的脓毒症患者DIC发生率更高,提示DIC的发生与脓毒症病情严重程度及预后密切相关[48]。
2001年国际血栓与止血学会(The International Society of Thrombosis and Haemostasis, ISTH)将DIC定义为:不同病因所致局限性血管内凝血系统激活为特征的获得性综合征,它既可由微血管体系受损而致,又可导致微血管体系损伤。若损伤严重,可导致多器官功能不全(multiple organ dysfunction syndrome,MODS)[49]。当前对DIC的诊断尚缺乏可靠、单一、实用的生物标志物及金标准,其诊断多采用包括多项实验室凝血指标在内临床积分系统[4,49],如目前学界使用最为广泛的ISTH-DIC积分系统(见表1)。值得关注的是,DIC的早期诊断及识别对于临床及时采取有效干预措施(如必要的抗凝治疗等),改善预后意义重大[45]。有研究指出,入住ICU首日筛查DIC可显著降低病死率,而若入住ICU两日后重复筛查,效能更高,提示早期识别、筛查DIC,进而及时采取有针对性的处理措施,将有助于改善患者不良结局[50]。值得一提的是,脓毒症DIC患者凝血功能进展、多器官功能衰竭已然形成,这类患者从抗凝治疗中的获益可能有限,积极寻找脓毒症前DIC阶段作为抗凝治疗的时间窗口应更有理论及现实意义[45]。2017年ISTH首次提出脓毒症诱导凝血病(sepsis-induced coagulopathy,SIC)的概念,并推出SIC积分系统(见表1),以期识别脓毒症早期凝血紊乱,并适时启动抗凝治疗,避免病程进展至显性DIC阶段而不可逆转[51]。SIC积分系统因其仅包含国际标准化比值(international normalized ratio,INR)、血小板计数、序贯器官衰竭评估(Sequential organ failure assessment,SOFA)评分等参数,以其简明、实用,而迅速在世界范围内流行,其在指导脓毒症抗凝治疗中的功效已得到不少研究的证实[52-54]。
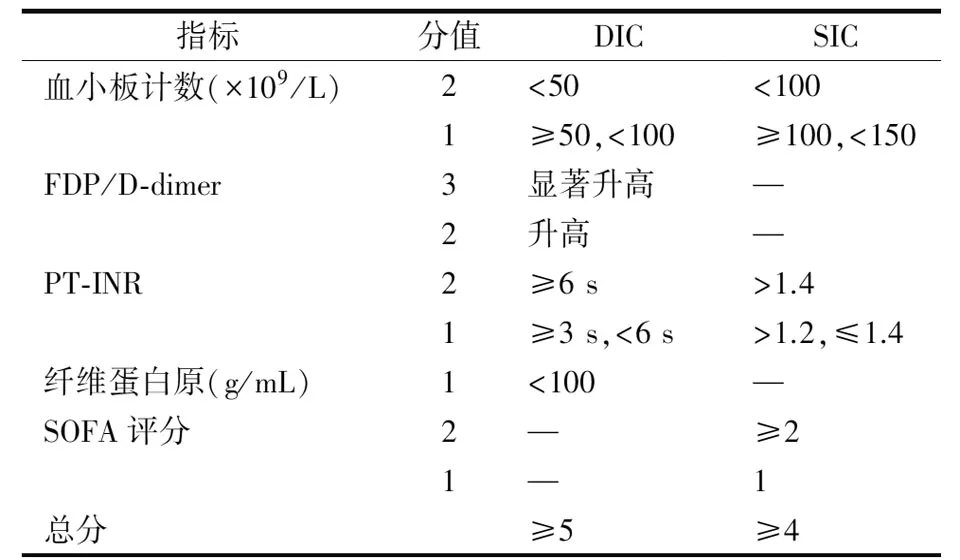
表1 ISTH-DIC/SIC积分系统[45]
3 脓毒症与抗凝治疗
病因治疗,包括适当的抗生素应用及感染源的控制是脓毒症治疗的基石,此外,适当的辅助支持治疗,如抗凝治疗对改善脓毒症凝血功能异常,缓解微循环组织血流灌注、多器官功能不全至关重要[9,45]。脓毒症患者往往伴随多种血栓并发症,如静脉血栓栓塞(venous thromboembolism,VTE)、急性脑梗死、急性心肌梗死等,“拯救脓毒症运动”(Surviving Sepsis Campaign,SCC)指南推荐在无明显禁忌症的前提下可使用低分子肝素/肝素用于脓毒症VTE的预防(强烈推荐,中等级别证据)[55]。Alhazzani主持的一项荟萃分析显示,在危重型脓毒症患者中预防性应用低分子肝素/肝素可显著减少下肢深静脉血栓(deep vein thrombosis,DVT)与肺栓塞(pulmonary embolism,PE)的发生,同时并不显著增加出血事件的发生,病死率亦有下降(尽管下降的程度在统计学上无差异)[56]。Liu等[57]在37例脓毒性相关前DIC患者中检验低分子肝素的疗效,发现低分子肝素的使用可显著改善脓毒症患者的高凝状态及多器官功能不全,并可缩短住院时间。然而遗憾的是,在既往开展的大部分临床随机对照试验研究中却并未显现肝素/低分子肝素在改善脓毒症患者预后、提高生存率等方面的功效[58]。除低分子肝素/肝素外,当前用于脓毒症抗凝治疗的主流药物包括AT、血栓调节蛋白(thrombomodulin,TM)等[45]。AT是循环中最为重要的生理性抗凝物质,主要抑制凝血酶的活性,同时亦可抑制急性炎症反应[45]。脓毒症患者AT水平显著降低,抗凝血酶的补充常用于脓毒症辅助治疗[45]。TM是内皮相关的抗凝辅因子,可促进并增强凝血酶介导的PC的激活[59]。脓毒症患者普遍存在内皮损伤,TM表达下调,对这类人群补充TM制剂,如重组可溶性血栓调节蛋白(recombinant soluble thrombomodulin,rsTM)将有助于重建机体抗凝功能[45],此外,以脓毒症为研究模型的临床前试验亦表明rsTM的应用在改善脓毒症凝血功能紊乱、缓解多器官功能不全中的价值[60]。然而,需要指出的是,后续开展的大部分大型随机对照试验研究却并未显现出抗凝治疗对降低脓毒症患者病死率的显著功效,这也让脓毒症抗凝治疗备受争议[6,57-58,61-66](详见表2)。脓毒症早期所生成的血栓,被认为是免疫性血栓或保护性血栓,可束缚病原体至局部,避免病原体播散至全身,此时若行抗凝治疗,不仅不能降低病死率,反而可能有害[51]。随着病情进展,凝血酶持续生成,微血栓不断形成,进展至脓毒症后期,尤其是显性DIC 阶段,多器官功能衰竭已不可逆转,这类患者从抗凝治疗中的获益亦会受限[45]。由此可见,精准识别脓毒症凝血紊乱阶段,进而准确把握合适的抗凝时机,可能是脓毒症患者抗凝治疗获益与否的关键[45]。ISTH推出的SIC积分系统[51],可较为早期地识别脓毒症凝血紊乱,在指导脓毒症患者抗凝治疗中显示出潜在的重要价值[45,51-54]。
4 总结与展望
脓毒症患者往往表现出TF大量表达、血小板广泛激活、NETs大量形成及MPs加剧释放等,从而致使促凝活性上调,与此同时,脓毒症患者血管内皮受损、糖萼破坏,可显著下调内皮相关的抗凝机制,如抑制蛋白C、AT及TFPI等的抗凝功能,此外,PAI-1及TAFI水平的显著上调,致使纤溶“关闭”。总体而言,脓毒症患者往往表现出高凝状态,凝血酶大量生成、纤维蛋白广泛沉积,微血管血栓形成,严重者可导致组织灌注障碍、多器官功能衰竭,DIC,甚至死亡。脓毒症抗凝治疗尚存争议,精准识别脓毒症凝血紊乱阶段,进而准确把握合适的抗凝时机,可能是脓毒症患者抗凝治疗获益与否的关键。ISTH推出的SIC积分系统,可较为早期地识别脓毒症凝血紊乱,在指导脓毒症患者抗凝治疗中正显现出潜在的重要价值。最后值得关注的是,传统抗凝治疗对改善多器官功能衰竭、提高生存率的价值仍然有限,重建糖萼功能及针对NETs为靶标的拮抗药物正成为极富有应用前景的新型抗凝治疗方案,然而尚需证据等级更高的循证医学数据的支持。
