大黄酸通过Sirt1/AMPK信号通路对非酒精性脂肪性肝病小鼠肝功能及肝细胞脂代谢的影响*
2023-11-23王希文
王希文 贺 琼 杜 凡 胡 维
1.武汉市红十字会医院药剂科 (湖北 武汉, 430000) 2.武汉市红十字会医院消化内科 3.华中科技大学同济医学院附属协和医院消化内科
非酒精性脂肪性肝病(NAFLD)影响全球约四分之一的成年人,是目前世界范围内最流行的慢性肝病之一[1]。然而,NAFLD发病机制尚不清楚,目前除了改变生活方式以减轻体重和增加体育活动外,没有其他治疗NAFLD的方法被批准[2]。因此,迫切需要探求NAFLD的有效治疗方法。大黄酸是中药大黄、首乌、虎杖等的主要活性成分之一,属蒽醌类衍生物,具有抗氧化应激、抗炎、降糖、调脂、免疫调节等多种药理作用[3,4]。研究证实大黄酸对大鼠和小鼠的NAFLD均具有治疗作用[5,6]。另外,大黄酸通过抑制氧化应激和脂质代谢紊乱来防治NAFLD[7],但目前关于大黄酸对NAFLD的保护机制研究仍极少报道。沉默信息调节因子2相关酶1(Sirt1)/amp活化蛋白激酶(AMPK)信号通路的激活有助于改善NAFLD的脂质积累和炎症[8]。此外,Sirt1被证明可以调节NAFLD中AMPK的激活,从而增强脂肪分解和β氧化,并改善肝脏脂肪过多[9,10]。为进一步明确大黄酸治疗NAFLD的治疗效果及其作用机制[11],本课题组在体内动物模型中研究证实了大黄酸对NAFLD小鼠的肝功能改善效果及对小鼠肝细胞脂代谢的影响,并在体内外模型中初步研究了大黄酸改善肝功能及脂代谢的分子机制,为其进一步的临床推广应用提供了理论依据。
1 材料与方法
1.1 实验动物 SPF级健康ICR小鼠,雄性,4周龄,购于湖南中医药大学动物实验中心,动物合格证号:SCXK(湘)2011-0003,均符合《实验动物管理条例》要求,并常规饲养待其完全适应新环境后进行实验研究。
1.2 仪器 ES-100E电子天平(长沙湘平科技有限公司);YXQ-LS-SⅡ型立式蒸汽灭菌器(上海博迅实业有限公司医疗设备厂);SW-CJ-1D型净化工作台(苏州净化设备有限公司);Allegra X-22R型多功能台式冷冻离心机(美国Beckman Coulter公司);全自动生化检测一体机(瑞士Roche cobas8000);Meta-Morph图像分析系统(美国Media Cybernetics公司);VICTOR X5型酶标仪(美国Perkin Elmer公司)等。
1.3 药品与试剂 大黄酸购于武汉欣申试化工科技有限公司(批号R111266),使用前取2 g大黄酸,将其溶于200 ml的0.9%氯化钠溶液,制成1%大黄酸混悬液;普通动物饲料(批号SPS9112)及高脂饲料(60%脂肪、20%碳水化合物、20%蛋白质,批号XTHF60)购自江苏省协同医药生物工程有限责任公司;丙氨酸氨基转移酶(ALT,批号BYX-002393-K)ELISA试剂盒购自常州贝源鑫生物科技有限公司;天门冬氨酸氨基转移酶(AST,批号69-21213)、乙酰辅酶羧化酶(ACC,批号69-21202)、ELISA试剂盒购自武汉默沙克生物科技有限公司,油红O染色试剂盒(批号C0157S,上海碧云天生物技术有限公司);棕榈酸(PA)购自上海吉至生化科技有限公司(批号P63761);兔抗鼠Sirt1、amp活化蛋白激酶α(AMPKα)、磷酸化AMPKα(p-AMPKα)、甘油醛-3-磷酸脱氢酶(GAPDH)抗体购自abcam公司(批号ab110304、ab32047、ab131357、ab8245)等。
1.4 NAFLD小鼠模型构建、分组及处理 将健康雄性ICR小鼠50只用于建模,标记并称重记录;以连续饲喂高脂饲料(8周)构建NAFLD小鼠模型,符合建模标准39只。建模成功判定依据为:肝细胞肿大变圆,可见大量脂滴,胞质疏松,肝细胞呈大泡型脂肪变性[12]。
将造模成功的36只小鼠随机分为4组,即模型组、低剂量大黄酸组、高剂量大黄酸组、高剂量大黄酸+EX527组,每组9只,另选择9只正常喂养的健康雄性ICR小鼠作为空白组。低、高剂量大黄酸组分别采用100、250 mg/kg大黄酸灌胃处理,其剂量依据参考文献和前期预实验确定;高剂量大黄酸+EX527组采用250 mg/kg大黄酸灌胃的同时腹腔注射10 mg/kg Sirt1抑制剂EX527[13],每天1次,连续8周;空白组和模型组给予等量0.9%生理盐水灌胃处理。各组小鼠自由进食进水,每周称重1次。8周干预完成后各组小鼠于大体实验前称重并记录。
1.5 NAFLD小鼠血清血脂、肝功能指标及氧化应激指标水平检测 干预8周后,小鼠经3%戊巴比妥钠腹腔注射麻醉(按每100 g体重注射0.14 ml),开腹,经下腔静脉采血2 ml,1 500转/min离心10 min取血清,用生理盐水稀释用于检测。其中全自动生化分析仪检测总胆固醇(TC)、甘油三酯(TG)、丙二醛(MDA)、游离脂肪酸(NEFA),ELISA检测ALT、AST,得出观测值水平,乘以稀释倍数换算作为实际水平。
1.6 ELISA法检测NAFLD小鼠肝脏组织脂代谢指标含量 小鼠经1.5处理后,游离肝脏并去除包膜,取出完整肝脏并称湿重;采集小块肝左叶组织,组织匀浆,经12 000转/min 4℃离心10 min取上清液,ELISA法检测肝脏组织ACC含量。
1.7 油红O、HE染色法检测小鼠肝脏病理变化 小鼠经1.5处理后,用巴氏吸管向肝组织表面缓慢滴加肝素生理盐水溶液(12 500 U肝素钠与100 ml生理盐水配比),待肝脏表面变白后投入4%多聚甲醛固定液,4℃冷藏18 h继续15%、40%沉糖脱水,最后OCT常规包埋行15 μm厚冰冻切片,弯头镊子小心摊开直接裱在防脱载玻片上。每组若干白片分别经油红O、HE染色后制片,最后扫描切片分析各组小鼠肝组织病理变化。
1.8 细胞培养及存活率检测 小鼠永生化AML-12肝细胞系购于中国科学院上海细胞培养库。将AML-12细胞培养于添加了10%胎牛血清、100 U/ml青霉素、100 g/ml链霉素、0.1 mol/L地塞米松和1%胰岛素-转铁蛋白-硒的DMEM/F12(1∶1)培养基中。用含大黄酸(0、2、4、8、16、32 μmol/L)的无血清培养基处理AML-12细胞24 h,以0.01 mol/L磷酸盐缓冲液(pH=7.2)中的大黄酸作为对照。处理后,去除含大黄酸的无血清培养基,加入新鲜培养基;然后孵育4 h使细胞稳定。最后,分别加入MTT溶液(5 g/L)10 μl,4 h后去除培养基,将活细胞中形成的不溶于水的甲瓒晶体溶解在100 μl DMSO中。使用酶标仪在490 nm处记录吸光度。实验重复3次,每次设置3个复孔。
1.9 NAFLD细胞模型构建、分组和处理 为了建立NAFLD细胞模型,将PA溶于牛血清白蛋白中,然后将AML-12细胞置于200 μmol/L PA中24 h[8]。PA刺激的AML-12细胞随机分为模型组,低、高剂量大黄酸组和高剂量大黄酸+EX527组,另选择常规培养的AML-12细胞作为空白组。低、高剂量大黄酸组分别用终浓度2、4 μmol/L大黄酸(溶于0.1%二甲基亚砜,原液浓度20 mmol/L,并用无血清培养基稀释成终浓度2、4 μmol/L的大黄酸)处理24 h,高剂量大黄酸+EX527组用4 μmol/L大黄酸和10 μmol/L EX527(溶于0.1%二甲基亚砜)[14]共处理24 h,模型组和空白组分别用等量的二甲基亚砜处理24 h。
1.10 细胞中TG含量检测 各组AML-12细胞处理后制备细胞悬液,4℃离心(3 000转/min)5 min后取上清液,采用全自动生化分析仪检测TG含量。实验重复3次,每次设置3个复孔。
1.11 油红O染色观察AML-12细胞脂质积累情况 AML-12细胞接种至6孔板,按1.9的方法处理后,用多聚甲醛(4%)固定10 min,接着使用油红O染色20 min,异丙醇(60%)和蒸馏水清洗后,在倒置荧光显微镜下观察各组AML-12细胞的脂质积累情况。实验重复3次,每次设置3个复孔。
1.12 Western Blot检测肝脏组织和AML-12细胞中Sirt1/AMPK信号通路相关蛋白表达 使用RIPA缓冲液裂解各组AML-12细胞和1.6中每组9只小鼠的剩余部分肝脏组织。等量提取蛋白经SDS-PAGE分离后转移到PVDF膜上。用5%脱脂乳在TBST中封闭膜,然后在4℃下与以下一抗孵育过夜:兔抗鼠Sirt1、AMPKα、p-AMPKα、GAPDH抗体。然后用辣根过氧化物酶结合的抗兔二抗孵育1 h,最后使用增强ECL试剂盒对印迹条带进行可视化,使用Image J凝胶分析软件分析条带强度。细胞实验重复3次,每次设置3个复孔。

2 结果
2.1 各组AML-12细胞存活率比较 与0 μmol/L大黄酸相比,2、4、8 μmol/L大黄酸处理AML-12细胞24 h后细胞存活率差异无统计学意义(P>0.05),16、32 μmol/L大黄酸处理AML-12细胞24 h后细胞存活率显著下降(P<0.05),故采用2、4 μmol/L的大黄酸作为低、高剂量组进行后续实验。见图1。
2.2 各组小鼠体重及肝脏湿重差异比较 见图2、3。

图2 各组小鼠体重差异比较 (n=9)
2.3 各组小鼠肝组织病理变化 空白组小鼠肝细胞呈正常形态,炎性细胞浸润少、细胞内无明显红色脂滴积聚;模型组小鼠出现肝硬变,细胞肿胀变形,有大量炎性细胞浸润,存在细胞坏死,红色脂滴密度高且分布均匀;低剂量大黄酸组小鼠肝组织未发现明显硬化坏死,肿胀减轻,但空泡化严重,脂滴密度高;高剂量大黄酸组小鼠肝细胞空泡化有所减轻,红色脂滴密度显著减少且较分散;与高剂量大黄酸组相比,高剂量大黄酸+EX527组小鼠肝组织炎性浸润明显,肝细胞空泡化严重,肿胀增加,脂滴密度升高。见图4、5。各组大鼠NAFLD活动度积分和脂质含量定量分析结果见图6。

图6 NAFLD活动度积分和脂质含量定量分析
2.4 各组小鼠不同浓度灌胃处理后血脂、肝功能和肝脏组织脂代谢相关指标差异比较 与空白组小鼠相比,模型组小鼠血清TG、TC、MDA、ALT、AST和NEFA水平显著升高,肝脏组织ACC含量显著降低(P<0.05);与模型组相比,低、高剂量大黄酸组小鼠血清TG、TC、MDA、ALT、AST和NEFA水平显著下降,肝脏组织ACC含量显著升高(P<0.05);与低剂量大黄酸组相比,高剂量大黄酸组小鼠血清TG、TC、MDA、ALT、AST和NEFA水平显著降低,肝脏组织ACC含量显著升高(P<0.05);与高剂量大黄酸组相比,高剂量大黄酸+EX527组小鼠血清TC、MDA、ALT、AST和NEFA水平显著升高,肝脏组织ACC含量显著降低(P<0.05)。见图7。

图7 各组小鼠不同浓度灌胃处理后肝功能和肝脏组织脂代谢相关指标比较(n=9)
2.5 各组小鼠不同浓度灌胃处理后肝脏组织Sirt1/AMPK通路蛋白表达比较 见图8、9。
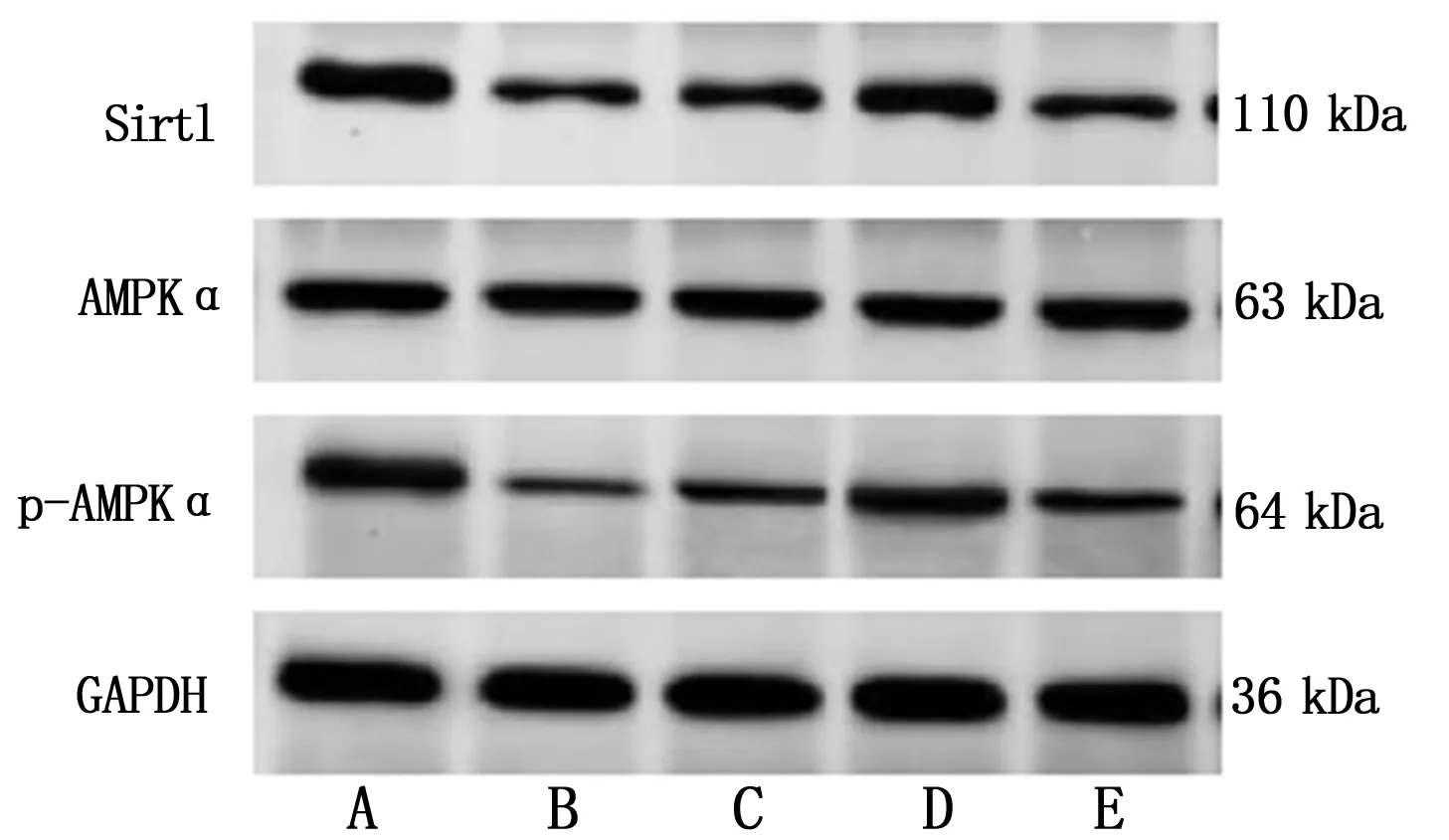
图8 各组小鼠肝脏组织中Sirt1、AMPKα、p-AMPKα蛋白表达比较

图9 各组小鼠不同浓度灌胃处理后肝脏组织Sirt1/AMPK通路蛋白表达比较(n=9)
2.6 各组AML-12细胞内TG含量和脂质积累水平比较 各组AML-12细胞内TG含量见图10。油红O染色结果显示,空白组无明显的红色脂滴聚集;模型组红色脂滴呈均匀分布且密度高;低剂量大黄酸组红色脂滴虽明显减少,但密度较高;高剂量大黄酸组相比低剂量大黄酸组红色脂滴减少且分散;高剂量大黄酸+EX527组相比高剂量大黄酸组的红色脂滴增多且呈紧密分布。见图11。

图10 各组AML-12细胞TG含量比较(n=3)
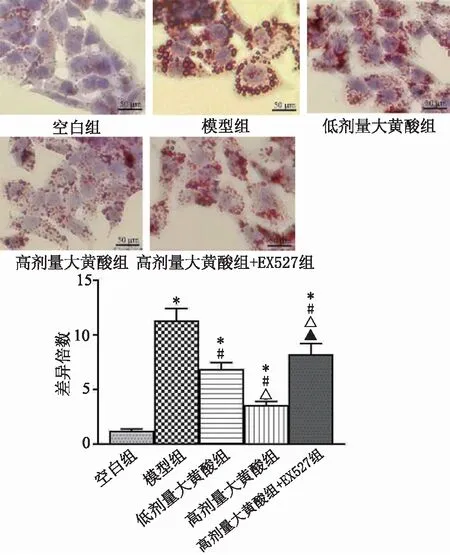
图11 各组AML-12细胞油红O染色结果及定量分析(×200,n=3)
2.7 各组AML-12细胞内Sirt1/AMPK通路蛋白表达比较 见图12、13。

图12 各组AML-12细胞中Sirt1、AMPKα、p-AMPKα蛋白表达比较

图13 各组AML-12细胞内Sirt1/AMPK通路蛋白表达差异比较(n=3)
3 讨论
在全球范围内,NAFLD的患病率迅速增加,NAFLD已成为慢性肝病的主要病因[15]。NAFLD除可直接导致失代偿期肝硬化、肝细胞癌外,还可影响其他慢性肝病的进展,并参与2型糖尿病和动脉粥样硬化的发病[16,17]。目前西医尚无针对NAFLD的特效治疗药物,在现代医学研究NAFLD逐渐深入的同时,越来越多的人将目光投向了中医药。中医药在NAFLD辨治用药中有着明显优势,突出体现在中药治疗能够根据个人不同体质及病因有针对性地进行治疗,近年来越来越受到大众的关注与认可[18]。
大黄酸具有减轻炎症反应、抗肿瘤、抑制氧化应激反应等多种药理活性,具备良好的生物活性,且使用起来较单味大黄熬汁取用更为安全,副作用也相对可控。研究表明大黄酸可降低HepG2细胞脂质代谢[19],对高脂饮食诱导的大鼠肥胖具治疗作用[20],对NAFLD变性有明显的改善作用[21]。然而,大黄酸对肝脏脂肪变性的有益作用机制尚未明确。本研究结果表明,低、高剂量的大黄酸均能降低TG、TC、MDA、ALT、AST、NEFA水平,升高ACC水平,体内肝细胞脂质积累得到明显改善,尤其是高剂量大黄酸的改善效果更好,这与之前的研究一致[7],提示大黄酸特别是高剂量大黄酸对NAFLD小鼠脂质代谢和肝脏损伤有明显的改善作用。NEFA水平极易受脂代谢因素影响,而ACC则催化细胞中脂肪酸的从头合成,二者对于脂代谢来说非常重要。研究显示NAFLD模型中,NEFA水平增加、ACC水平降低[22],与本研究结果一致,说明大黄酸通过调节NEFA、ACC水平改善肝功能和脂代谢。另外,本研究通过细胞实验发现,低、高剂量大黄酸能够明显降低NAFLD细胞模型中的TG含量并抑制脂质积累,且呈剂量依赖性,与Li等[8]的研究结果一致,提示大黄酸可改善细胞脂质代谢,进而抑制NAFLD病程。
Sirt1是细胞内脂质代谢的关键调节因子,可改善组织胰岛素敏感性并抑制肝脂肪变性的发生[23]。先前的一项研究表明,Sirt1的活性可以预防肝脂肪变性的发生,并且NAFLD患者的Sirt1表达低于健康个体[24]。AMPK的激活已被证明可以减少脂质生成,增强脂肪酸氧化,最终抑制肝脏TG的积累和NAFLD的发展[25]。既往研究发现,Sirt1可调控AMPK磷酸化水平,NAFLD小鼠中Sirt1和AMPK的表达被抑制,其表达上调可以预防高脂饮食诱导的肝脏脂肪变性、肝脏炎症和代谢紊乱[26]。在肝脏脂肪变性细胞模型中,Sirt1 mRNA/蛋白水平和AMPK磷酸化水平显著降低[27]。以上研究均说明激活Sirt1/AMPK通路有利于改善肝脏脂肪代谢。然而,大黄酸是否通过激活该通路改善NAFLD进程尚不清楚。本研究发现,不同剂量大黄酸均能激活Sirt1/AMPK信号通路相关蛋白表达,进而显著改善体内和体外肝细胞脂质积累,其中高剂量的大黄酸治疗效果更好,提示大黄酸对肝功能和脂代谢的改善作用可能与Sirt1/AMPK信号通路激活有关。进一步在高剂量大黄酸的基础上给予Sirt1抑制剂EX527处理后,Sirt1和AMPK的表达明显下降,说明EX527确实能抑制Sirt1/AMPK通路激活;同时,我们还发现EX527能够部分恢复高剂量大黄酸对肝功能、脂代谢的影响,再次证实大黄酸通过激活Sirt1/AMPK信号通路减轻NAFLD小鼠肝功能损伤并改善肝细胞脂代谢。
另外,本研究HE染色结果显示大黄酸可改善肝脏炎症,特别是高剂量大黄酸能显著降低NAFLD小鼠肝脏组织炎症。然而,大黄酸是否通过抑制炎症因子水平降低肝脏炎症损伤还不清楚,也是后期研究的重点。有研究表明炎症信号通路(如NF-κB和JNK通路)的激活在NAFLD的发病机制中起着至关重要的作用[8]。在多种炎症刺激下,IKK复合体的激活引起IκB磷酸化和随后的降解,释放NF-κB并允许其进入细胞核[28]。在接下来的研究中,我们将重点探讨大黄酸在NAFLD模型中对炎症因子水平及炎症通路的影响,进而完善大黄酸改善NAFLD小鼠肝功能和肝细胞脂代谢的调控机制。
综上所述,本研究首次证实大黄酸可能通过激活Sirt1/AMPK信号通路有效改善NAFLD小鼠的肝功能及强化其肝脏脂肪代谢速率,对于由高脂饮食诱发的脂肪肝具有一定的改善作用,为后续相关研究提供一定实验依据。
