脂滴在病原微生物感染中作用的研究进展
2019-08-07严梦楠综述李华茵审校
严梦楠(综述) 周 建 李华茵(审校)
(复旦大学附属中山医院呼吸内科 上海 200032)
脂滴是在19世纪由科学通过光学显微镜发现[1]。在20世纪90年代以前,认为脂滴在细胞中不发挥任何功能而忽视了对它的研究。直到1991年发现perilipin (PLIN)蛋白特异定位在脂滴表面,才开始关注脂滴的生物学功能[2]。脂滴在脂质代谢和维持机体能量稳态等方面起到重要的作用,脂滴功能受损会导致多种疾病。病原微生物可以利用脂滴进行生命活动,完成自身复制及其在宿主中的持续存在,而脂滴也可在一定程度上起到抵御病原微生物入侵细胞的作用。本文对近年来脂滴在病原微生物感染中作用的研究进展作一综述。
脂滴的概述脂滴广泛分布于真核细胞,在一些原核生物中有存在,是细胞内中性脂的储存场所[3-4]。
脂滴的形成 因为合成中性脂的酶类主要分布在内质网,因此目前普遍认为脂滴是在内质网形成的。虽然有不同的模型解释从中性脂合成到脂滴形成的过程,但均未被完全证实。较广泛接受的模型是中性脂在内质网双层膜中积聚并形成“透镜样脂质结构(lipid lens)”,积聚至一定程度后从内质网以出芽(budding)的方式形成新生脂滴并继续生长,最终形成成熟脂滴[5-6]。
脂滴的生物学特征及功能 脂滴由极性单磷脂层包裹疏水核心组成,是细胞内诸如三酰甘油、胆固醇酯等中性脂的贮存场所[7-8]。在脂肪细胞中,脂滴的直径可达到100 μm,而脂滴在非脂肪细胞中的直径则可小于1 μm[4]。一直以来,人们认为脂滴的主要功能是储存能量。随着蛋白质组学技术的发展与应用,在脂滴表面发现了许多功能蛋白,如PLIN蛋白家族中的PLIN1蛋白、PLIN2蛋白[又称为脂肪分化相关蛋白(adipose differentiation-related protein,ADRP)]以及PLIN3蛋白[又称为47 000的尾连蛋白(tail-interacting protein of 47 000,TIP47)][9]。同时发现脂滴能够与其他细胞结构如内质网、线粒体、过氧化物酶体、核内体等相互作用,以维持细胞稳态和应对不利情况[10-11]。脂滴的功能不仅局限于脂类储存与代谢。脂滴通过将游离脂肪酸转化为中性脂,可以有效避免积聚的脂肪酸及其衍生物对细胞的毒性作用[6]。脂滴在维持内质网稳态中也发挥了重要作用。当体内环境改变或有刺激因素存在时,会启动内质网应激(endoplasmic reticulum stress,ERS),并引起未折叠蛋白反应(unfold protein response,UPR),与此同时,脂滴也会相应增加,从而有助于清除错误折叠蛋白并恢复内质网脂质代谢平衡[12]。脂滴在自噬中也发挥了一定的调节作用[13]。当细胞营养不足时会引起自噬水平上调,导致氨基酸及脂类释放增多,而释放的脂类再被酯化成三酰甘油后进入脂滴。这一过程可以减少脂毒性对线粒体的损伤,保证线粒体功能正常[6]。此外,脂滴在膜转运和合成、蛋白质贮存和降解、信号传导、炎症反应等过程中也发挥重要作用。因此,脂滴被认为是一个复杂且处于动态变化的细胞器[8,11,14-15]。
脂滴在病原微生物感染中的作用近年来研究发现,包括病毒、细菌、寄生虫在内的一些病原微生物都能与脂滴相互作用。最初认为病原微生物主要是利用脂滴来获得能量及脂质等来源,而研究证据显示脂滴也可以在免疫反应中发挥媒介作用。
为病原微生物提供营养物质及能量 结核分枝杆菌感染宿主肺泡巨噬细胞后,局部炎症反应导致免疫细胞向感染部位聚集并形成肉芽肿。肉芽肿的中心由泡沫巨噬细胞和朗格汉斯多核巨细胞包围感染的巨噬细胞,周围由淋巴细胞、成纤维细胞环绕。泡沫巨噬细胞的形成是分枝杆菌感染的典型特征之一[16]。研究发现,包括结核分枝杆菌(Mycobacteriumtuberculosis)、牛型分枝杆菌(Mycobacteriumbovis)、麻风杆菌(Mycobacteriumleprae)、海鱼分枝杆菌(Mycobacteriummarinum)等在内的细菌感染宿主细胞后,均会导致脂滴重新分布,脂滴被认为是分枝杆菌慢性感染中主要的能量和碳来源[9]。海鱼分枝杆菌感染宿主细胞后,宿主细胞内原先散在分布的脂滴就会向吞噬了细菌的吞噬体处聚集,用荧光染料Bodipy493/503标记脂滴,吞噬体内中性脂的荧光强度增强。将荧光染料Bodipy558/568 C12标记的脂肪酸与宿主细胞共同培养,使宿主合成的脂质带荧光标记,同时细菌体内也出现荧光标记[17](图1)。结核分枝杆菌中有脂肪代谢相关酶类,编码三酰甘油合酶-1 (triacylglycerol synthase 1,Tgs1)的基因,可利用宿主来源的脂肪酸合成三酰甘油,并存储在细菌自身的脂滴中。结核分枝杆菌还编码脂肪酶LipY,可分解细菌储存的脂肪以供能,也可分解宿主细胞的三酰甘油来供细菌利用[18]。这些研究认为在分枝杆菌感染过程中,脂滴起到供能及为细菌代谢提供所需物质的作用。但Knight等[19]提出与传统观念不同的看法,在缺少脂滴的巨噬细胞中,结核分枝杆菌仍可以积累脂质,而巨噬细胞内脂滴形成离不开干扰素-γ(interferon-γ,IFN-γ)的作用。因此认为,结核分枝杆菌感染后,细菌能够获取非脂滴来源的营养物质及能量。巨噬细胞内脂滴的形成是依赖IFN-γ的程序化的巨噬细胞免疫反应,主要是为类花生酸的合成提供重要场所。
除了脂质代谢,脂滴还可以将细胞内的铁通过结核分枝杆菌分泌的亲脂性铁载体运输给细菌,为细菌提供必要的代谢物质[20]。
在对寄生虫的研究中同样发现,克氏锥虫(Trypanosomacruzi)、刚地弓形虫(Toxoplasmagondii)、利什曼原虫(Leishmaniamajor)等寄生虫也可以诱导宿主细胞中脂滴积聚,同样导致脂滴的重新分布[21]。这些寄生虫利用宿主的脂类合成自身的脂滴,完成增殖、复制等生命活动[22-23]。
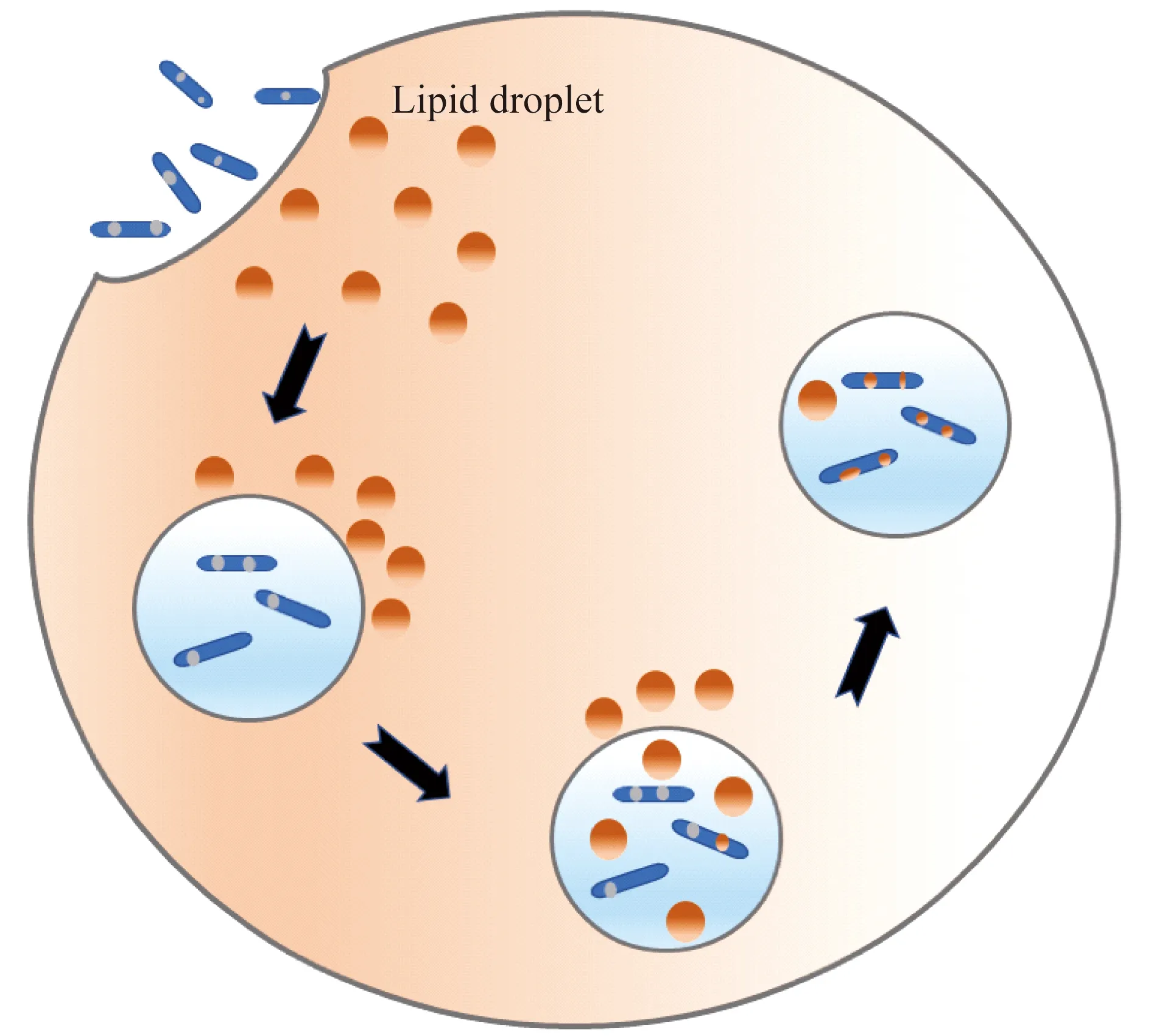
AfterMycobacteriummarinuminfection,LDs relocate to the bacterium-containing compartment and are found to accumulate inside the compartment.Later,LDs are transferred into the bacteria.
图1 分枝杆菌感染宿主细胞后脂质分布
Fig 1 Distribution of lipids duringMycobacteriummarinuminfection of host cell
为病毒复制提供组装平台 丙型肝炎病毒(hepatitis C virus,HCV)的复制发生在内质网上,而组装则发生在脂滴表面,病毒衣壳蛋白core蛋白和非结构蛋白5 (nonstructural protein 5,NS5A)蛋白在其中发挥重要的作用。HCV感染后,在内质网上形成core蛋白,包括D1和D2两个结构区域:D1区域为正电区域,可以结合RNA和蛋白质;D2区域则与脂滴结合[24]。NS5A在内质网和脂滴上均有分布[24]。NS5A蛋白与病毒RNA结合,将RNA从复制位点运到脂滴,从而被core蛋白包裹,形成一个完整的病毒颗粒[9]。在组装过程中,宿主的二酰甘油酰基转移酶(diacylglycerol acyltransferases 1,DGAT1)在内质网上与core蛋白和NS5A蛋白结合,并促进其正确定位到脂滴表面[25-26]。在组装过程中,TIP47和Ras相关蛋白18 (Rab18)起到重要作用:TIP47与NS5A相互作用,并依赖TIP47与脂滴的高亲和力,将结合了RNA的NS5A运送到脂滴表面[27];Rab18与NS5A结合,使病毒复制复合物与脂滴相互靠近[28](图2)。与HCV同属黄病毒科的登革热病毒(dengue virus,DENV)、GB病毒B(GBV-B)等也都通过core蛋白定位到脂滴表面,完成病毒颗粒组装[9,15]。
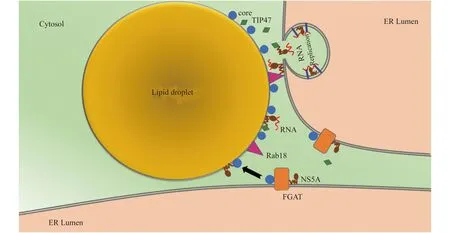
The replication of HCV genome is occurred on the cytoplasmic face of the ER.TIP47 brings RNA-loaded NS5A to the LD for the interaction with HCV core protein,resulting in the encapsidation of the viral RNA.TIP47:Tail-interacting protein of 47 000;Rab18:Ras-related protein 18;NS5A:Nonstructural protein 5 A;DGAT:Diacylglycerol acyltransferases;ER:Endoplasmic reticulum;RNA:Ribonucleic Acid.
图2 HCV病毒与脂滴相互作用的模式图
Fig 2 Model of interactions between HCV and lipid droplets
抵御病原微生物的感染 脂滴在病原微生物感染后的免疫反应中发挥重要作用。结核分枝杆菌、HCV、刚地弓形虫等病原微生物感染都会引起宿主细胞内脂滴数量增加[29-31]。脂滴的核心由磷脂和中性脂组成,在酶的作用下可以释放花生四烯酸。花生四烯酸是合成前列腺素、白三烯等类花生酸的主要底物,在脂滴中也存在合成类花生酸的酶类,包括环氧化酶(cyclooxygenases,COX)、前列腺素E2合成酶(prostaglandin E2 synthase)、白三烯C4合成酶(leukotriene C4 synthase)等,而类花生酸是参与炎症反应的重要信号分子[15,32-33]。当宿主细胞遇到病原微生物感染时,脂滴可以针对刺激产生相应的炎症介质,调节免疫反应。
脂滴上还存在抗病毒的蛋白。病毒抑制蛋白(virus inhibitory protein,Viperin)是由干扰素诱导产生的抗病毒蛋白。Viperin依赖N端的α-螺旋结构将其定位在内质网靠近细胞质的一面以及脂滴表面[34]。Viperin能在脂滴表面通过C末端区域与HCV的NS5A相互作用,从而发挥抑制病毒复制的作用[7]。HCV感染后,core蛋白能够诱导肝脏的脂肪变性,该作用需要TIP47的参与。敲低TIP47表达后,core蛋白表达相应减少,这可能成为减轻HCV感染后所致病理反应的有效方法[35]。
组蛋白(histone)有抗微生物的作用[36]。游离的组蛋白会对细胞造成严重损伤,许多生物都会将细胞质中游离的组蛋白降解掉[37]。从果蝇胚胎中提纯的脂滴上发现较多量的组蛋白且在体外实验中表现出很强的杀菌作用,组蛋白通过Jabba蛋白定位到脂滴上,Jabba突变型果蝇胚胎的脂滴上缺少组蛋白[12]。为了验证脂滴上的组蛋白在体内是否也能起到保护作用,将大肠埃希菌注入野生型和Jabba突变型果蝇胚胎,发现野生型细菌数量减少,而突变型细菌数量显著增多。用其他革兰阳性和革兰阴性细菌感染这两型胚胎,野生型存活数较突变型多[7]。因此认为,脂滴能通过组蛋白来保护果蝇免受细菌侵袭。
结语随着对脂滴的认识不断加深,其呈现出更多、更复杂的功能。在脂滴与病原微生物相互作用的过程中,仍然有许多问题需要解决,如:分枝杆菌具体是通过什么机制使脂滴得以在宿主细胞中重新分布,以及在脂滴相关研究中抑制剂的应用是否会影响体内脂质稳态,能否保证未来作为治疗手段使用时的安全性。通过揭示脂滴与病原微生物相互作用的详细过程及具体机制,能够为日后临床控制并治疗病原微生物感染提供新思路和新方法。
