TGF-β/Smad通路在羊栖菜多糖诱导肝癌细胞凋亡过程中的作用*
2023-11-23刘卫红张贵平张玉果
刘卫红 杨 晨 张贵平 张玉果
1.邯郸市中心医院神经科(河北 邯郸, 056001) 2.邯郸市中心医院肿瘤科 3.河北医科大学第三医院中西医结合肝病科
肝癌是消化系统常见的恶性肿瘤,大多数患者就诊时已处于中晚期,丧失了手术切除的最佳时机,而采用放化疗往往给患者带来较大副作用。目前,靶向治疗逐步成为治疗肝癌的重要手段,因此深入阐明肝癌发生发展的分子机制具有深远意义[1]。羊栖菜多糖是从羊栖菜中提取出来的水溶性多糖,具有抑制过氧化氢诱导的星形胶质细胞氧化应激和细胞凋亡,保护星形胶质细胞免受氧化损伤的作用[2]。羊栖菜多糖通过调节细胞凋亡相关蛋白和阻滞细胞周期可诱导白血病细胞凋亡[3]。转化生长因子β1(TGF-β1)是转化生长因子家族的一员,TGF-β1与肝癌密切相关。鳖甲煎丸可能通过减少由二乙基亚硝胺诱导的肝癌大鼠组织中TGF-β1表达水平,抑制由TGF-β/Smad通路激活介导的肝癌细胞上皮间质转化,从而达到抗肝细胞癌转移侵袭的作用[4]。水苏碱通过抑制TGF-β1/Smad信号通路可阻断TGF-β1诱导的肝癌细胞上皮间质转化[5]。由此可见,TGF-β1/Smad信号通路在肝癌细胞的恶性生物行为学中具有重要作用。本研究探讨羊栖菜多糖是否能通过抑制TGF-β1/Smad信号通路从而发挥抗肝癌作用。
1 材料与方法
1.1 细胞系 人肝癌HepG2细胞株购自中国科学院上海生命科学研究院细胞资源中心。
1.2 试剂和仪器 羊栖菜多糖购自美国Sigma公司;培养基、胎牛血清以及青霉素和链霉素购自美国Gibco公司;CCK-8试剂盒和细胞凋亡检测试剂盒购自上海碧云天生物科技有限公司;Transwell小室和基质胶购自美国Invitrogen公司;B淋巴细胞瘤-2基因(Bcl-2)、Bcl-2相关X蛋白(Bax)、TGF-β1、p-Smad2、Smad2和GAPDH抗体购自美国Abcam公司;倒置显微镜购自日本奥林巴斯公司;多功能酶标仪购自美国Bio-Rad公司;流式细胞仪购自美国BD公司。
1.3 细胞培养与分组 HepG2细胞培养于含10%胎牛血清、1%链霉素和青霉素的培养基中,每2 d更换1次培养基,细胞融合度达到80%以上时进行传代,取第3代对数生长期细胞不同浓度羊栖菜多糖处理细胞(0、15、30和60 mg/L),另设空白孔作为调零孔,每组设置5个复孔,进行后续实验。
1.4 CCK-8检测细胞活力 加入不同浓度羊栖菜多糖处理24 h后,弃掉原有培养基,加入含CCK-8溶液的培养基150 μl,继续在培养箱中培养4 h,酶标仪450 nm处测定隔空吸光度(A值),计算细胞存活率,细胞存活率(%)=(实验孔A值-空白孔A值)/(对照孔A值-空白孔A值)。
1.5 流式细胞仪检测细胞凋亡 收集各组细胞,预冷PBS清洗3次,500 μl结合缓冲液将细胞重悬,再加入5 μl碘化丙啶和5 μl Annexin V-FITC,充分混匀,避光孵育15 min,流式细胞仪检测细胞凋亡情况。
1.6 Transwell实验检测迁移和侵袭细胞数 在上室中铺满基质胶,并加入5×104个细胞,下室中加入500 μl完全培养基,将小室置于培养箱中24 h,无菌湿棉签轻轻擦去上室中多余细胞,经甲醇固定,结晶紫染色后,显微镜下观察并计数。
1.7 蛋白印迹法检测各蛋白表达 弃掉培养基,预冷PBS清洗细胞2次,裂解液裂解,BCA试剂盒测定蛋白浓度,120 V电泳2 h,0.3 A湿转2 h,洗膜,室温封闭1 h,GAPDH、TGF-β1、p-Smad2、Smad2以及Bcl-2和Bax抗体(1∶1 000)4℃孵育过夜,二抗(1∶5 000)室温孵育2 h,洗膜,显色,Image J分析条带灰度值,目的蛋白相对表达量=目的蛋白条带灰度值/GAPDH条带灰度值。

2 结果
2.1 不同浓度羊栖菜多糖处理后细胞存活率及凋亡率比较见表1、图1。
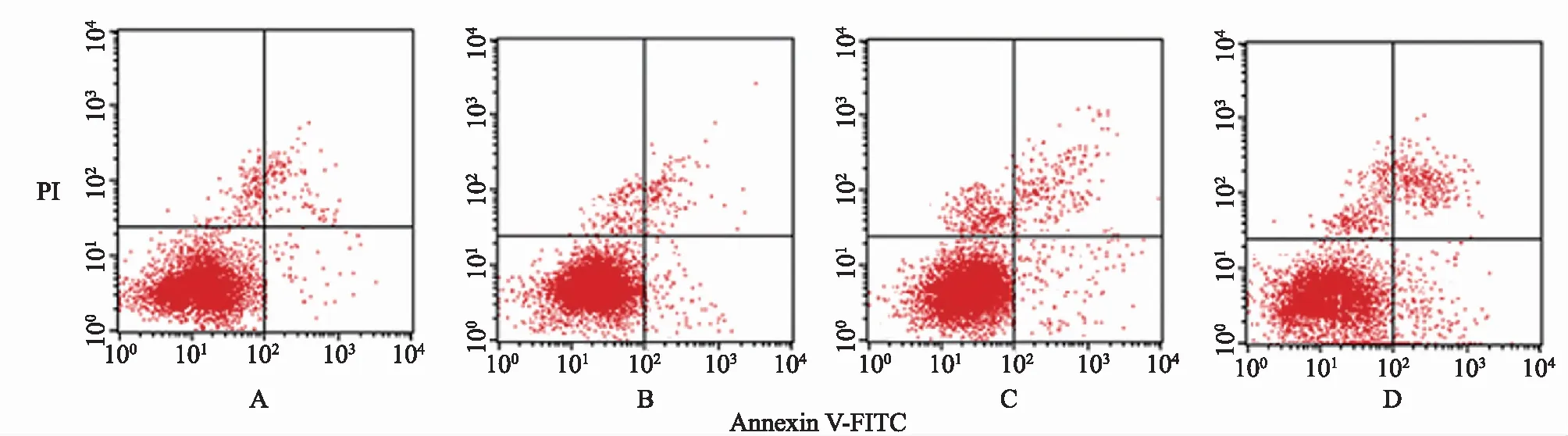
图1 流式细胞仪检测不同浓度羊栖菜多糖处理后细胞凋亡情况 (A:0 mg/L组;B:15 mg/L组;C:30 mg/L组;D:60 mg/L组)

表1 不同浓度羊栖菜多糖处理后细胞存活率及凋亡率比较
2.2 不同浓度羊栖菜多糖处理后侵袭细胞数及迁移细胞数比较 见表2,图2、3。
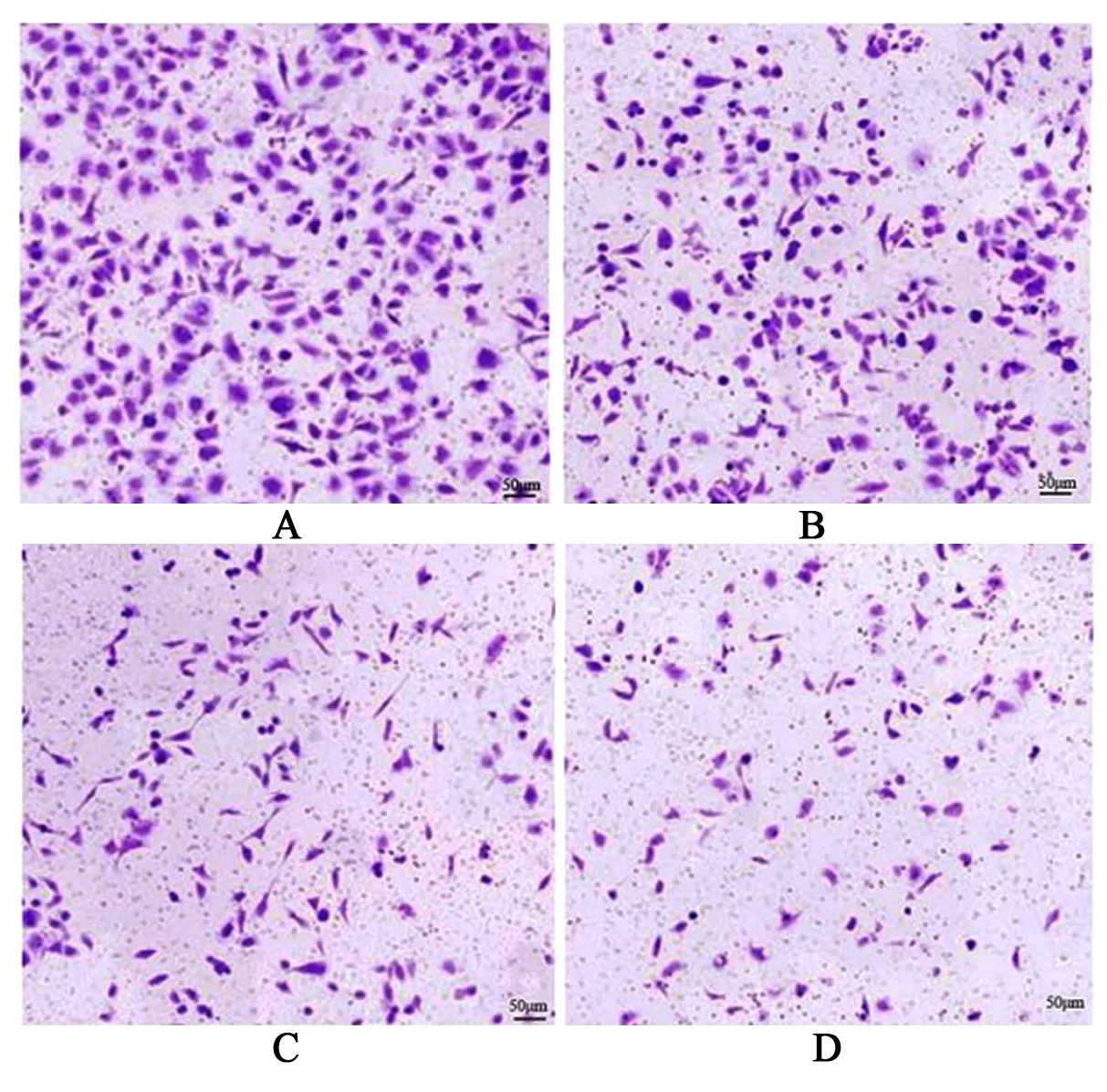
图2 不同浓度羊栖菜多糖处理后侵袭细胞数

图3 不同浓度羊栖菜多糖处理后迁移细胞数
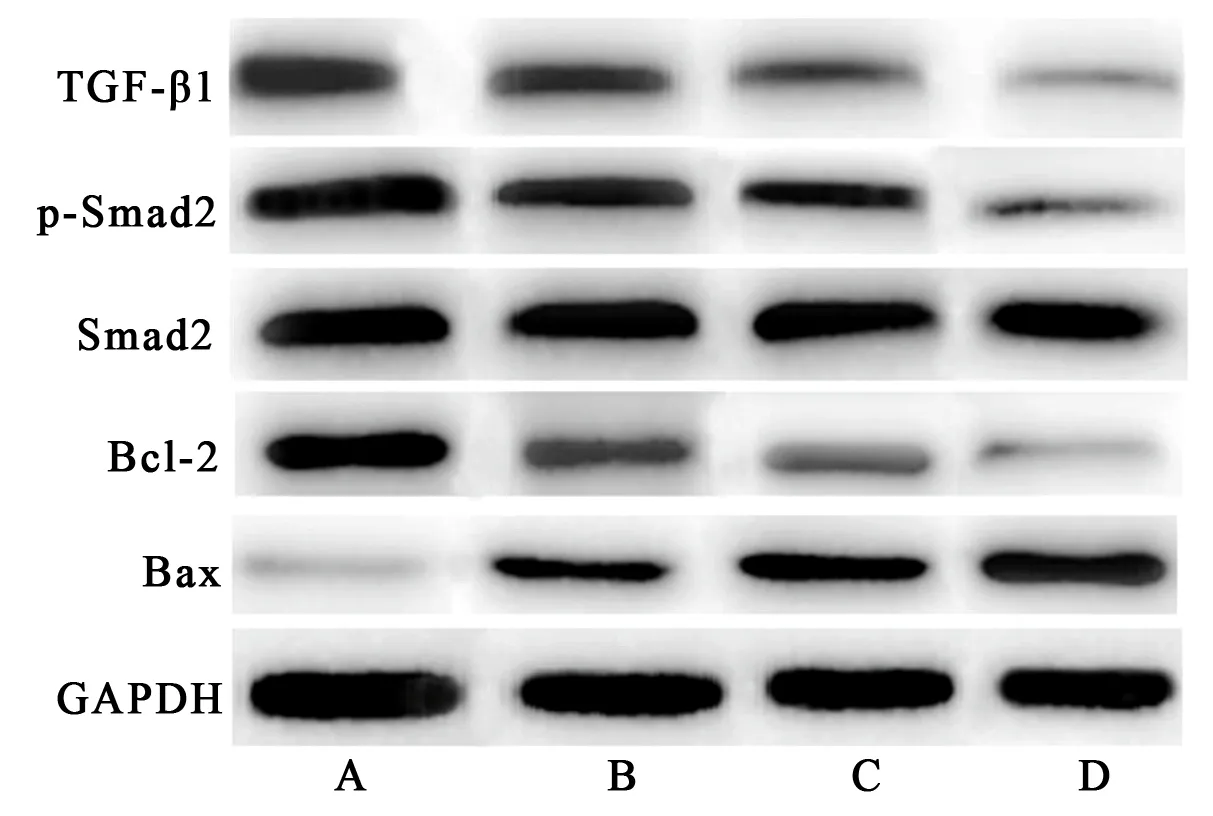
图4 细胞中各蛋白表达情况 (A:0 mg/L;B:15 mg/L;C:30 mg/L;D:60 mg/L)

表2 不同浓度羊栖菜多糖处理后侵袭细胞数和迁移细胞数比较
2.3 蛋白相对表达量 见表4。

表4 不同浓度羊栖菜多糖处理后细胞中TGF-β1、p-Smad2、Smad2、Bcl-2和Bax蛋白相对表达量比较
3 讨论
肝癌是我国第二位癌症杀手,目前肝癌的发病率呈逐年上升趋势,且逐步趋于年轻化。早期肝癌一般采用外科手术切除、射频消融、动脉化疗栓塞等,但是早期无明显症状,因此多数患者错失了最佳治疗手段,对于中晚期肝癌患者常采用综合治疗方案,抗肿瘤药物的应用可延缓肝癌的进展,但是治疗效果并不理想,患者仍出现转移风险高、预后差、5年生存率不足等结果,因此亟待开发治疗肝癌的新型靶向药物。
羊栖菜多糖具有多种药理学活性,Wu等[6]研究发现羊栖菜多糖通过修饰糖尿病小鼠肠道菌群和肠道代谢产物对缓解高糖引起的肝脏和心脏病理损伤具有改善作用。Chen等[7]研究表明羊栖菜多糖通过减轻炎症反应、保护肠道屏障和调节肠道微生物可改善结肠炎。Zhang等[8]研究发现羊栖菜多糖可减轻高脂饮食诱导的肥胖和胰岛素抵抗,从而减轻肝脏氧化应激水平。体内外研究均表明,羊栖菜多糖对肺癌具有抑制作用,主要是通过调节基质金属蛋白酶家族和上皮钙黏蛋白发挥作用[9]。羊栖菜多糖对卵巢上皮癌裸鼠移植瘤具有抑制作用[10]。本研究通过不同浓度羊栖菜多糖处理HepG2细胞,结果显示细胞存活率随着羊栖菜多糖浓度的升高而降低,细胞凋亡率随羊栖菜多糖浓度的升高而升高。由此可见,羊栖菜多糖可诱导肝癌细胞凋亡,抑制肝癌细胞增殖。细胞迁移和侵袭是恶性肿瘤患者死亡的主要原因,因此本研究探讨了羊栖菜多糖对肝癌细胞迁移和侵袭的影响,结果发现,随着羊栖菜多糖浓度的升高,肝癌细胞迁移和侵袭的能力降低。以上结果表明,羊栖菜多糖可抑制肝癌细胞增殖、迁移和侵袭,诱导癌细胞凋亡。
TGF-β信号通路是一条跨膜信号转导途径,在早期胚胎发育过程中起到调控细胞增殖、分化和凋亡的作用,TGF-β超家族信号通路与多种疾病密切相关,包括癌症、器官纤维化以及自身免疫病等[11]。TGF-β家族成员可直接激活下游Smad信号通路,TGF-β激活后可活化下游Smad2,通过与Smad4结合形成复合物,Smads复合物从胞质转移至胞核内,再结合位点进行基因调控,在癌症晚期,TGF-β/Smad信号通路由于主要蛋白出现了基因缺失和突变,导致该通路信号转导异常,从而导致肿瘤生长浸润转移[12]。研究发现,小檗碱可能通过抑制TGF-β/Smad信号通路,干预TGF-β1诱导肝癌HepG2细胞的上皮间质进程,抑制HepG2细胞的迁移和侵袭能力[13]。Li等[14]研究表明KLF2通过降低TGF-β1和Smad的活性可抑制肝癌细胞的干细胞特性。因此本研究检测了细胞中TGFβ-1和Smad2的活性,结果显示随羊栖菜多糖浓度的升高,TGF-β1和p-Smad2蛋白表达降低。说明羊栖菜多糖可抑制TGF-β/Smad信号通路。细胞凋亡是一个复杂的过程,受多种基因的调控,Bax和Bcl-2是调控细胞凋亡的重要基因[15,16]。本研究结果显示,随羊栖菜多糖浓度的升高,Bax蛋白表达升高,Bcl-2蛋白表达降低。由此说明羊栖菜多糖促进肝癌细胞凋亡。
综上所述,羊栖菜多糖可抑制肝癌细胞增殖、迁移和侵袭,诱导癌细胞凋亡,其可能是通过抑制TGF-β/Smad信号通路激活发挥作用,但本研究仍存在不足,首先仅在细胞水平上进行探讨,下一步将通过肝癌移植瘤进一步深入探讨羊栖菜多糖对肝癌的影响。另一方面,本研究通过检测TGF-β/Smad信号通路中主要相关蛋白说明羊栖菜多糖可能是通过调节该信号通路发挥作用,缺乏一定的有力证据,下一步将通过激活该信号通路,探讨羊栖菜多糖对该信号通路的调控作用。
