组蛋白赖氨酸特异性去甲基化酶KDM1家族在肝细胞癌中的作用*
2023-11-23陈玮钰毛德文
王 涵 陈玮钰 付 蕾 王 萌 毛德文 姚 春△
1.广西中医药大学研究生院 (广西 南宁, 530001) 2.广西中医药大学附属瑞康医院 3.广西中医药大学第一附属医院
肝细胞癌(HCC)作为临床最常见的消化系统恶性肿瘤,占所有肝脏恶性肿瘤患者的85%~90%[1]。HCC患者的5年生存率为17%~20%,位居癌症相关死亡原因第4位,目前全球每年约有84万新增HCC病例,且这一趋势仍在进行性上升[2,3]。该病发病隐匿,早期缺乏典型临床症状和特异性检测指标,被发现时通常已处于晚期阶段,并且由于目前治疗手段有限,费用高昂,俨然成为了影响公众健康的社会难题。目前分子靶向免疫治疗在HCC治疗中取得了突破性进展,是肝病领域的研究热点之一,不断深入挖掘HCC进展过程中的调控分子,为新型抗癌药物的研发提供潜在治疗靶点,是今后肝病学科攻坚的重点方向。
了解癌症的发病机制是制定针对性治疗方案的关键环节,其特异性治疗靶标的获取在很大程度上取决于肿瘤基因组的变化,包括基因序列突变和影响基因表达的表观遗传修饰。组蛋白赖氨酸特异性去甲基化酶(KDM)在表观遗传修饰的转录、分化及炎症形成等许多生物学过程中具有广泛影响[4],其中KDM1家族通过介导不同的下游信号通路,对多种肿瘤的发生发展发挥关键调节作用[5]。近年来随着细胞及分子水平技术的不断发展,越来越多的研究表明KDM1家族与HCC的发生发展关系密切。然而,由于该家族功能多样,调控机制复杂,当前对其在HCC中功能机制的研究尚未完善。因此,本文就KDM1家族与表观遗传修饰的关系及不同家族成员的生物学特性进行归纳和探讨,重点聚焦KDM1家族调控HCC的研究进展,以期为该病的临床防治和干预提供新的思路和依据。
1 KDM1家族与表观遗传修饰
表观遗传修饰是指机体受自然环境改变的影响,相同DNA序列的基因表达或细胞表型发生一系列的改变,这一改变具有功能稳定、可遗传、可逆转等特点。表观遗传修饰通过改变原癌基因和肿瘤抑制基因的转录,进而在癌症的发生发展过程中发挥核心作用。DNA甲基化最早被提出作为表观遗传信息的载体,随后大量的研究也证实,组蛋白修饰和非编码RNA在直接或间接影响局部染色质结构重塑的过程中也起着重要作用,其中组蛋白修饰在癌症的表观遗传修饰中最为常见[6]。
组蛋白修饰包括甲基化、乙酰化、磷酸化、泛素化、SUMO化、ADP核糖基化、瓜氨酸化、巴豆酰化、异丁基化等多种类型,通常以组合识别的形式共同调控基因的表达[7]。组蛋白甲基化是在组蛋白甲基化转移酶(HMT)和组蛋白去甲基化酶(HDM)的共同催化下,组蛋白3(H3)或组蛋白4(H4)的N端赖氨酸或者精氨酸残基发生了甲基化修饰(见图1),从而调控遗传印迹影响下游基因的表达。其中,组蛋白赖氨酸残基的HDM可根据序列同源性及其催化机制分为两大类:一类是KDM1家族,该家族由KDM1A(也称LSD1、AOF2、BHC110)和KDM1B(也称LSD2、AOF1)构成,是主要依赖黄素腺嘌呤二核苷酸(FAD)作为辅助因子的单胺氧化酶(MAOS),其功能是去除H3K4和H3K9上的单甲基化(me1)或双甲基化(me2);另一类是含有Jumonji C结构域的赖氨酸脱甲基酶(JmjC KDM)家族,依赖Fe2+和α-酮戊二酸作为辅助因子进行催化,根据其功能的不同可再细分为7个亚家族(KDM 2~8)[5,8]。目前,对JmjC KDM家族在HCC致癌过程中驱动突变的研究少有报道,这一现象的出现可能与该家族成员结构高度相似有关[9]。JmjC KDM抑制剂大多数具有较差的细胞渗透性和强金属螯合属性[8],相似的结构导致了其催化中心表现出非选择性的特点,在临床治疗中难以匹配到合适的酶活性抑制剂。因此,对KDM1家族的研究成为了表观遗传修饰调控HCC作用过程的主要突破口,更是当下KDM抑制药物开发的研究热点。
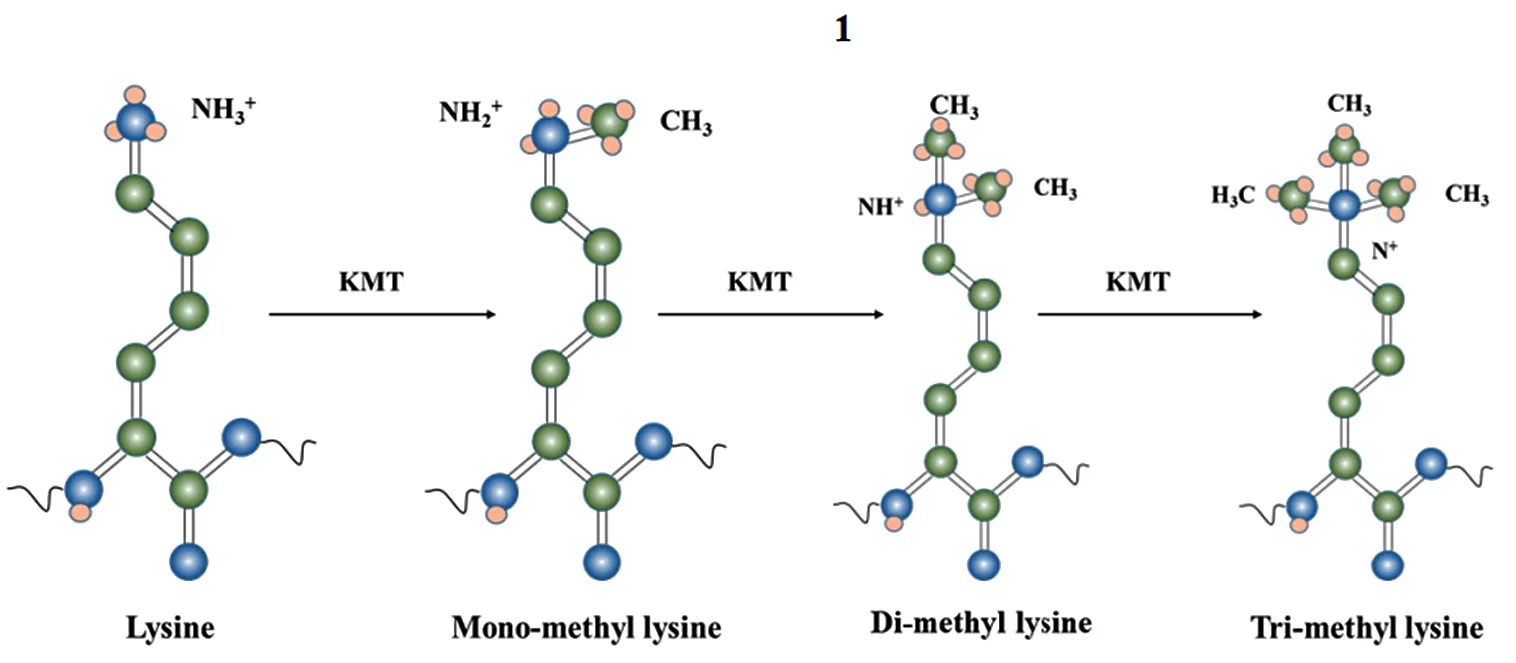
图1 H3赖氨酸甲基化过程
2 KDM1家族成员的结构及其生物学特性
KDM1家族成员KDM1A和KDM1B是人类最早确定的组蛋白去甲基化酶,在许多疾病中均具有调节基因表达和蛋白质代谢的功能[10]。这两种酶在结构上有一定的相似性,都存在一个胺基氧化酶结构域和一个由Swi3p、Rsc8p和Moira组成的SWIRM结构域,后者是染色质相关蛋白所独有的特征。除此以外,KDM1A和KDM1B还表现出不同的结构体系,独特的结构域在酶与不同基因组位点、蛋白质复合体的结合过程中展现出强大的功能多样性。
KDM1A中存在一个特殊的结构,称为柔性N端区,酶核定位的关键过程依赖于该结构的灵活性。KDM1A的催化中心区域位于C-末端的氨基氧化酶样区(AOL),AOL结构域包含两个小叶,一个小叶与SWIRM结构域相连接,另一个小叶作为催化底物的识别部位,二者共同在空腔中表现出脱甲基化活性。与KDM1B相比,KDM1A中的SWIRM结构域不能与DNA结合,但它有助于维持KDM1A的蛋白质稳定性,并作为与其他蛋白质相互作用的停靠位点,其核小体外的DNA通过AOL结构域与核心复合体结合并相互作用[11]。此外,KDM1A的AOL结构域还突出一个α-螺旋结构的Tower区,它与REST辅助抑制因子(CoREST)复合物形成相互作用位点,这一结构对KDM1A的H3K4去甲基化酶活性极其重要[12]。
KDM1A使H3K4me1/2和H3K9me1/2去甲基化具有特异性,其中H3K4me1/2是与活跃转录相关的组蛋白标志,H3K9me1/2是与非活跃转录相关的组蛋白标志。虽然KDM1B与KDM1A的序列有近25%的同源性,但研究表明,内源性的KDM1B对核小体底物具有显著的H3K4去甲基化酶活性,与KDM1A的活性表达有明显区别[13]。KDM1B是一种H3K4me2去甲基化酶,H3K4me2是表观遗传转录激活的关键标志,可通过p53-p21-Rb信号通路特异性调节细胞周期以驱动组蛋白H3K4去甲基化[14]。KDM1B存在于大多数肿瘤细胞中,它同KDM1A一样,保护机体正常细胞,使其不发生癌变[15]。但除此之外,KDM1B可能参与了不同于KDM1A的转录程序,改变了NSD3等关键转录蛋白的甲基化动力学,调节了转录激活基因的相互作用过程[16]。因此,KDM1家族成员的结构和功能既有相同之处又有不同之处(见图2),从KDM1A和KDM1B的结构及其生物学特性出发,方能更好地了解KDM1家族在HCC中发挥作用的分子机制。

图2 KDM1家族的三维结构模型[17-18]
3 KDM1家族在肝细胞癌中的作用机制
随着基因微阵列芯片和高通量测序技术的快速发展,对于KDM1家族在癌症发生发展变化中发挥的作用机制有了进一步的认识。最新研究数据表明,H3K4的甲基化状态紊乱是癌症发生的常见原因,这些变化可能是由于改变甲基化状态的酶位点突变或易位,或者酶的表达水平变化所造成的[19]。KDM1家族中KDM1A和KDM1B这两种酶能从me1和(或)me2的H3K4中去甲基化,而肿瘤抑制因子的去甲基化酶通常是高度突变的[20]。因此,深入研究KDM1家族成员在组蛋白甲基化异常状态下对HCC发病机制的影响,能为寻找抑制癌症进展的分子靶点提供潜在的生物学价值。
3.1 KDM1A与肝细胞癌 根据癌症干细胞(CSCs)模型研究指出,肿瘤生长是由癌细胞中一部分CSCs所驱动的,并且CSCs具有高度致癌性和抗化疗性,在维持肿瘤生长、复发等多方面发挥了尤为重要的作用[21]。HCC中CSCs的恶性功能,不仅表现在对肿瘤发生的激活和对常规疗法的抗性,还参与了上皮-间充质转化(EMT)、免疫调节等多种生物学过程[22]。CSCs的致癌性和参与表观遗传修饰的成员密切相关,其中KDM1A作为染色质修饰因子,主要作用于H3K4和H3K9,这些组蛋白在CSCs的恶性调节和诱发癌症基因组的不稳定性中扮演了重要角色。
Lei等[23]在体内和体外研究中发现,HCC组织中KDM1A的表达水平与肿瘤组织学分级、淋巴结侵袭和Lgr5+表达呈正相关,其中Lgr5+的丰富表达与疾病的进展、生存期的缩短有关。高表达的KDM1A增强了HCC中CSCs的耐药性,其作用机制是通过抑制β-catenin信号通路传导的负调节因子,诱导Lgr5+中Prickle1、APC、Sfrp5等表达水平增加,从而促进HCC的进展并维持CSCs的干性。另一项研究结果表明,KDM1A负责维持HCC中CSCs的自我更新和致癌性,其过表达甚至能够驱动非CSCs的自我更新[24]。癌症相关成纤维细胞(CAF)促进了Notch信号通路介导去乙酰化酶SIRT1的表达,导致CSCs中去乙酰化水平降低和KDM1A激活,此外SIRT1还参与CSCs的干性维持。与此同时,KDM1A的高酶活性与乙酰化程度呈负相关,当CSCs中乙酰化水平受到抑制时,KDM1A也能通过蛋白小体途径增加自身的表达量,驱动肝癌CSCs表现出恶性功能。
Zhao等[25]通过免疫组织化学(IHC)和蛋白质印迹法探讨了人类HCC细胞系中KDM1A的表达及其与临床病理学特征之间的关系,发现KDM1A在肝癌组织中的表达明显高于癌旁非癌组织,并且在HCC细胞系中,KDM1A敲低后,c-Myc和Bcl-2的表达下调,癌细胞增殖减少。此外,与较高的肿瘤分期(T3-T4)和肿瘤分级(G3)相比,较低的肿瘤分期(T1-T2)和肿瘤分级(G1-G2)也显示出KDM1A的低表达。随后,Kim等[26]通过IHC分析303例HCC患者中KDM1A的表达情况,发现有77%的患者显示KDM1A蛋白染色阳性,进一步研究表明KDM1A的高表达可通过视黄酸(RA)途径下调H3K9me1/2和H3K4me1/2水平,加快肿瘤的生长速度,与HCC患者的无病生存率和总生存率降低有关。在深入探索KDM1A利用表观遗传因素控制癌细胞代谢的作用机制时发现,在人类肝癌HepG2细胞中,下调KDM1A的表达可以使H3K4去甲基化直接增强线粒体代谢转变,同时下调葡萄糖摄取和糖酵解活性,降低癌症的代谢和增殖能力[27]。
因此,肝癌组织内的微环境在驱动KDM1A通过β-catenin、Notch、RA等信号通路维持CSCs干性和促进肿瘤增殖中发挥了关键的作用,KDM1A的高表达造成了HCC的恶性发展和不良预后。尽管KDM1A在HCC中的发病机制与其在乳腺癌、前列腺癌等调控途径上具有一定的相似性,但随着近年来表观遗传修饰诱导自噬网络相关基因表达的发现,仍需更全面、更深入的研究以阐明KDM1A作用于HCC的具体效应机制[28,29]。
3.2 KDM1B与HCC KDM1B在多种肿瘤的发生发展过程中起着不可或缺的作用,其在基因沉默、转录因子活性调控、细胞周期调节等方面的作用机制成为了当前研究的一大热点[30],尤其是KDM1B的过表达在预测侵袭性肿瘤的生物学意义和临床不良预后中扮演的角色。越来越多的研究证据表明,KDM1B的功能障碍与异常染色质重塑有关,异常的DNA甲基化导致组蛋白活性失调,进而造成肿瘤抑制基因的沉默和异常基因的表达,促进了肿瘤的发生[31,32]。
国内外学者对于KDM1B的研究着重关注了其与细胞周期调节和肿瘤发生的关系,与此同时也对KDM1B的调节机制进行了严谨的实验验证。Cai等[30]研究发现KDM1B的过表达能够通过p53-p21-Rb调控结直肠癌的细胞周期分布,其作用机制是KDM1B通过直接与p53启动子结合,介导H3K4me2去甲基化以下调p53的表达,促进癌细胞增殖和抑制细胞凋亡。这一结果也与Wang等[33]的研究发现相符,表明敲低KDM1B可通过p53/Smad信号通路传导抑制癌细胞扩增并诱导胰腺癌细胞凋亡。Patel等[34]利用RNA测序技术证实KDM1B的低表达可能导致代谢抑制,而且该机制是独立于KDM1A的特殊基因组所调控的。因此,结合KDM1B与KDM1A在特异性催化底物中的相似性,以及KDM1A在多种癌症发生过程中mRNA表达水平的变化,不难发现KDM1B和KDM1A可能分别与不同的蛋白质结构域相互作用,虽然在调节关键生物学过程中发挥相似的功能,但显示出截然不同的基因组分布图谱。
与KDM1B在其他侵袭性肿瘤中的致癌机制相似,在HCC中KDM1B呈现过表达。根据一项旨在确定涉及HCC细胞表观遗传学改变的潜在治疗靶点的综合研究显示,在HuH7和Hep3B肝癌细胞系的遗传和表达数据中发现KDM1B的高表达,这一表达水平的改变还与HCC患者的临床不良预后相关[35]。然而,目前有关探讨KDM1B在HCC动物模型中的相关研究较少,其真实世界研究更是缺乏。基于计算机算法的生物信息学研究结果表明,KDM1B主要调控与细胞代谢活动相关的基因,通过调控呼吸电子传递链、线粒体ATP合成耦合电子传递、电子载体活性、NADH脱氢酶活性和氧化还原酶活性等生物学过程发挥致癌作用。但这一研究结果仅是进行预测和筛选,其实际价值和意义有待商榷,尚需采用生物学研究加以佐证[34]。
由上可知,KDM1B与许多癌症中重要的生物学过程有关,但尽管在KDM1B结构和功能方面的认识取得了重大进展,而涉及肿瘤的潜在分子机制却尚未能明确阐释,尤其是KDM1B在HCC方面的数据极其匮乏,这是一个未来需要探索的潜在研究课题。
4 KDM1家族在HCC中的治疗作用
由于HCC患者在初始阶段的检测方法有限,结合该病特有的高恶性率和复发性质,患者的预后往往不尽人意。提高癌症预后的重要手段是及时诊断和治疗,然而,HCC对许多肿瘤生物标志物的敏感性和特异性都明显不足,鉴于癌症中组蛋白赖氨酸去甲基化的表观遗传修饰过程可诱导基因突变,可见靶向KDM1家族能够为HCC提供有效的治疗方法和新的预后思路。
KDM1A的过度表达能够促进癌症的发生发展,而沉默KDM1A则会减少癌细胞的增殖、侵袭和迁移,因此抑制KDM1A被认为是治疗肝癌的临床干预措施之一,KDM1A抑制剂也成为了潜在的抗癌药物[36]。迄今为止,HCC患者对抗癌药物的获得性耐药是临床非手术治疗所面临的一个巨大挑战,甚至还可能缩减患者的生存时长,迫切需要进一步的研究来解决该问题。奥沙利铂(OXA)属于第3代铂类化学抗癌药物,是治疗HCC的重要化疗药物之一,但由于个体的耐药性,往往导致治疗失败。Ma等[37]研究发现OXA治疗HCC时获得耐药性的机制之一是通过上调长链非编码RNA(lncRNA)的表达,其中LINC01134被鉴定为抗OXA(OXA-R)细胞中上调最多的lncRNA。LINC01134/SP1/p62轴通过改变细胞的活力和线粒体稳态,促使细胞凋亡,从而激活肝癌组织中的抗氧化应激途径,以调节OXA耐药性,而KDM1A主要负责OXA-R细胞中LINC01134的上调。因此,用特定的抑制剂沉默KDM1A可能是一种抗HCC化疗耐药的新选择,如DCN1抑制剂化合物383、含杂环反苯环丙胺衍生物等新型小分子抑制剂已被设计和运用于靶向KDM1A的癌细胞活性抑制[38,39]。值得注意的是,近期发现具有抑制微管蛋白聚合和抑制KDM1A双重活性的叔磺酰胺衍生物表现出有效的抗HCC活性,是针对性治疗的潜在药物[40]。
索拉非尼是唯一获得FDA批准用于治疗晚期肝癌的药物,但也因其耐药性,只能将生存期延长约2.8个月,远远不能满足患者的需求[41]。Koga等[42]使用MicroRNA-302介导的诱导多能干细胞技术,通过沉默KDM1A的表达诱发c-Myc抑制和H3K4甲基化,进而对HCC细胞进行重编程,实现药物敏感性的提高。在另一项涉及HCC细胞系对索拉非尼耐药的研究中也发现,KDM1A抑制剂可通过减弱Wnt/β-catenin信号通路显著抑制耐药HCC细胞中CSCs的干性,使体内索拉非尼耐药的癌细胞重新获得敏感性[43]。同时该研究还发现在索拉非尼耐药细胞系中KDM1B表达的丰度变化很小,其耗竭并没有造成药物敏感性的变化。
虽然目前KDM1B的特异性抑制剂还未被研发和使用,但随着其在结直肠癌、胰腺癌等恶性肿瘤中异常基因表达模式的深入研究,KDM1B也成为了治疗各种类型癌症的一个很有前景的表观遗传学靶点。此外,KDM1A和KDM1B还可能与其他靶向药物发挥协同作用[44],共同克服癌症治疗过程中出现的耐药性问题,这也为在疾病联合疗法中使用KDM1抑制剂提供了新的治疗思路。
5 总结和展望
KDM1家族参与了正常和疾病状态下转录程序的表观遗传修饰调控,它们的活动对各种细胞功能起着至关重要的作用,尤其是在癌症的增殖和转移过程中通过不同信号通路发挥着相似的促癌作用。KDM1家族作为一种治疗HCC的新型潜在靶点,主要通过表观遗传修饰调节组蛋白去甲基化,维持肝脏CSCs的干性,促进肿瘤细胞扩增。
虽然针对KDM1家族不同成员对HCC的作用已进行了广泛的临床实验研究,同时也取得丰硕的成果,但由于HCC的治疗受到致病因素多样性、发病机制复杂性及治疗方案个体差异性等多方面因素的影响,相关研究仍存在诸多不足:①目前针对KDM1家族在HCC发病机制的研究多集中于KDM1A,KDM1B在HCC中的基础实验和临床研究鲜有报道;②对KDM1家族靶向治疗药物的研究多针对于肝癌细胞,其长期治疗对正常肝细胞是否有影响亟需充分探讨;③在KDM1抑制剂的研发中,应着重在体内和体外实验中深入机制研究,挖掘KDM1家族在癌症中治疗潜力的同时保证其安全性。总而言之,未来深入了解KDM1家族不同成员通过表观遗传修饰调控的下游靶基因和作用通路,确定其在HCC致癌转化中的关键作用,将有助于探索出新的分子靶点,设计出更适合于HCC的治疗策略。
