倾向性评分匹配分析:慢性HBV感染合并NAFLD患者临床特征*
2023-11-23刘慧敏张芸肖吕化杰段海珊孔令军张绪清
刘慧敏 张芸肖 吕化杰 段海珊 孔令军 张绪清 夏 杰△
1.陆军军医大学第一附属医院(西南医院)全军感染病研究所,重庆市感染病研究重点实验室 (重庆, 400038) 2.重庆医科大学附属第三医院感染疾病科
慢性乙型肝炎病毒(HBV)感染是一个重大的公共健康问题,中国的慢性HBV感染人数庞大,约占世界感染人口的1/3[1,2]。近年,随着人们生活水平的提高,日常饮食结构发生改变,非酒精性脂肪性肝病(NAFLD)的患者人数已超过慢性HBV感染者[3]。慢性HBV感染合并NAFLD的患者也随之增长,HBV感染和脂肪变性的双重因素加重肝脏的负担,推动肝脏疾病的进程,导致肝硬化、肝癌的发生[4]。众所周知,既往肝细胞癌(HCC)的发生主要与慢性HBV感染相关[5]。然而,NAFLD相关的HCC正在逐年上升。在亚洲,非肥胖人群中的NAFLD也较常见,但NAFLD诊断常常被忽略[6]。临床上,提高慢性HBV感染合并NAFLD的诊断率,值得被重视。本研究通过收集陆军军医大学第一附属医院(西南医院)感染病科门诊就诊的慢性HBV感染者以及合并NAFLD的患者共706例,运用倾向性评分匹配的方法探究其临床特征。
1 材料与方法
1.1 研究对象 通过西南医院数据信息平台,筛选2015年2月1日至2022年2月1日感染科肝病中心门诊就诊,18~60岁乙型肝炎表面抗原(HBsAg)阳性患者,共27 452例。分别纳入首次诊断慢性HBV感染合并NAFLD者264例和慢性HBV感染者442例。对比分析两组患者的一般资料和临床指标,探索慢性HBV感染合并NAFLD者的临床特征。本回顾性研究及生物样本库均通过西南医院伦理委员会审批,批件号:(B)KY2021086。慢性HBV感染合并NAFLD者264例,年龄23~59(45±8)岁,男241例(91.3%),女23例(8.7%);慢性HBV感染者442例,年龄22~59(44±8)岁,男性343例(77.6%),女性99例(22.4%)(P>0.05)。其中,HBV合并NAFLD组体质指数(BMI)27.09(25.35~28.06)kg/m2;HBV组BMI 22.67(21.46~23.38)kg/m2,(P<0.001)。
1.2 纳入及排除标准 纳入标准:(1)慢性HBV感染者入组标准:①HBsAg和或HBV DNA阳性6个月以上;②未使用抗病毒药物条件下,HBV DNA低于检测值(<20 IU/ml);(2)慢性HBV感染合并NAFLD者纳入标准:①肝脏超声筛查提示脂肪性肝病[7,8];②符合慢性HBV感染者诊断[9];③未使用抗病毒药物条件下,HBV DNA低于检测值(<20 IU/ml)。排除标准:排除其他肝炎病毒、人类免疫缺陷病毒的感染,酒精性肝病、自身免疫性肝病、药物性肝损伤、肝豆状核变性、甲亢伴肝损伤、心源性肝损伤等其他肝损伤的因素,及肝硬化、肝衰竭、肝癌等终末期肝病。
1.3 临床资料 (1)一般资料:年龄、性别、BMI,BMI=体重(kg)/身高(m)2;(2)临床指标(正常范围):①乙型肝炎表面抗原(HBsAg)(0~0.5 IU/ml)、乙型肝炎e抗原(HBeAg)(0~1 COI),采用化学发光法,试剂盒生产厂家:美国雅培;②高精度HBV DNA(<20 IU/ml)采用荧光定量PCR法,试剂生产厂家:美国罗氏;③尿酸(UA)(155~428 μmol/L)、肌酐(Cr)(40~97 μmol/L)、丙氨酸氨基转移酶(ALT)(0~42 U/L)、天门冬氨酸氨基酸转(AST)(0~42 U/L)、谷氨酰转肽酶(GGT)(4~50 U/L)、碱性磷酸酶(ALP)(34~114 U/L)、白蛋白(Alb)(38~51 g/L)、总胆固醇(TC)(0~5.2 mmol/L)、甘油三酯(TG)(0~1.69 mmol/L)、高密度脂蛋白(HDL)(1.03~1.55 mmol/L)、低密度脂蛋白(LDL)(2.07~3.10 mmol/L)、葡萄糖(Glu)(4.1~5.9 mmol/L),以上生化试剂或试剂盒生产厂家为宁波美康;④白细胞计数(WBC)(3.5~9.5)×109/L、血红蛋白(Hb)(130~175 g/L)、血小板计数(PLT)(125~350)×109/L,采用电阻抗法,试剂生产厂家:深圳迈瑞;(3)PHILPS彩超(型号:EPIQ5),FibroTouch肝纤维化瞬时弹性成像仪(脂肪衰减<240 dB/m、硬度<7.3 kPa,无锡海斯凯尔医学技术有限公司的FT-C系列)。
2 结果
2.1 PSM前后两组患者的临床指标 为消除年龄、性别、肝脏炎症、HBV相关免疫因素的影响,将匹配因素设定为性别、年龄、肌酐、HBsAg、HBeAg、HBVDNA、ALT、AST、GGT、ALP、WBC、PLT,经过倾向评分(1∶1)匹配后,有196对患者匹配成功,两组患者PSM前后临床特征见表1。匹配后,两组的年龄、性别、HBsAg、HBeAg、Cr、ALT、AST、GGT、ALP、PLT无统计学差异,P>0.05;HBV合并NAFLD组的BMI、TC、TG、LDL、UA、Alb、WBC、HGB、FibroTouch硬度值、FibroTouch脂肪衰减值显著高于HBV组,P<0.05;HBV合并NAFLD组的Log10 HBVDNA 、Glu、HDL显著低于HBV组,P<0.05。见表1。

表1 慢性HBV组与合并NAFLD组患者PSM(1∶1)评分匹配前后临床指标比较
2.2 慢性HBV感染合并NAFLD者的影响因素 以分组为因变量,分别输入患者的UA、Log10 HBVDNA、Alb、TG、TC、LDL、HDL、Glu、WBC、HGB、FibroTouch脂肪衰减值、FibroTouch硬度值、BMI指标进行单因素Logistic回归分析。其中P<0.1为有意义的指标,包括UA、Alb、TG、Glu、FibroTouch脂肪衰减值、FibroTouch硬度值、BMI,指标再进行“向前:LR”多因素Logistic回归分析。最终,BMI、UA、Alb、TG、Glu、FibroTouch脂肪衰减值留在方程中,见表2。
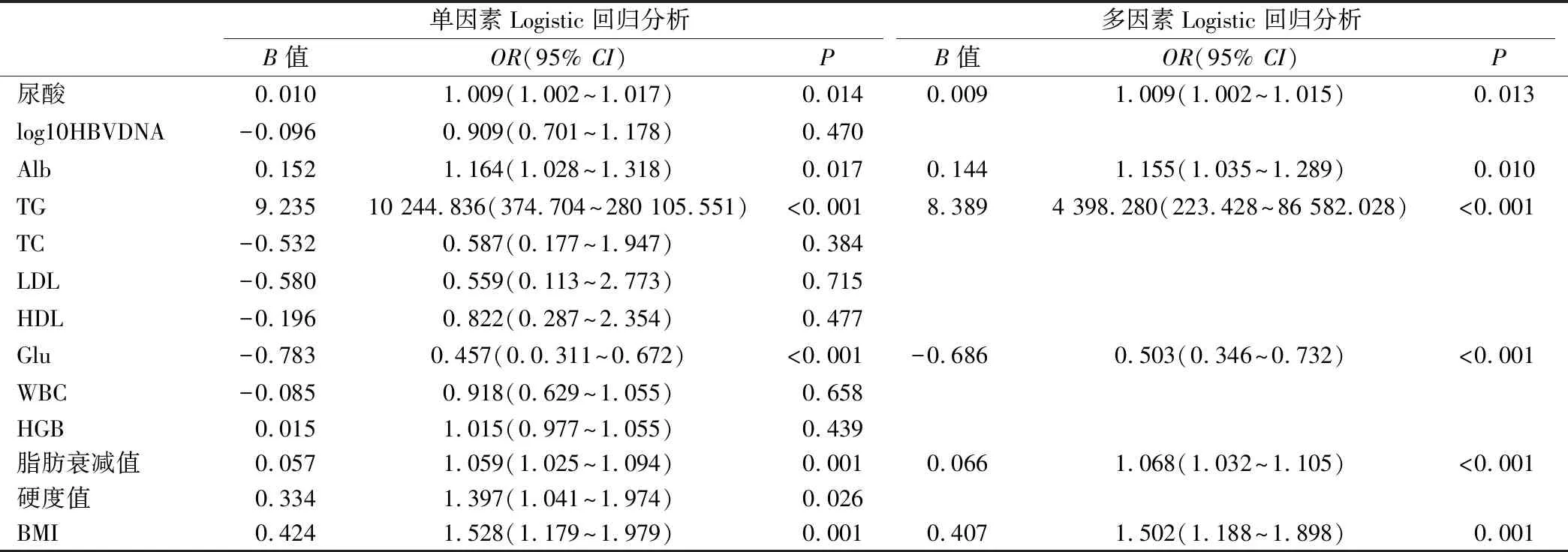
表2 慢性HBV感染合并NAFLD患者相关因素的Logistic回归分析
3 讨论
近年,NAFLD的发病率持续增加,尽管亚裔人群NAFLD的组织学炎症程度不重,但NAFLD相关的肝癌发生率不断增加[10]。在中国,虽病毒性肝炎的流行率下降,但仍有7 300万慢性HBV感染者[9]。慢性HBV感染合并NAFLD的患者越来越常见,值得高度关注。有研究指出,通过抗病毒治疗抑制了慢性乙型病毒肝炎(CHB)患者HBV DNA的复制,但由于合并NAFLD仍增加了此类人群HCC的发生风险[11]。欧美相关大数据研究指出,合并NAFLD是CHB患者发生HCC和死亡的危险因素[12]。NAFLD可加重CHB患者疾病的进展。因此,临床应早期识别,规范化管理。
肝脏病理诊断是识别慢性HBV感染者合并NAFLD的金标准,但肝穿刺活检术是有创性操作,有潜在出血的风险,很难实现应检尽检。应用超声对NAFLD的诊断及程度的评估,虽精确度不如肝组织病理,但应用更普遍,可提高临床的筛查率[13]。但是,仅凭超声诊断脂肪性肝病是不足的,需积极寻找其他相关的临床依据,综合判断可增加慢性HBV感染者合并存在NAFLD诊断的准确性。本研究通过PSM匹配,消除年龄、性别、肝脏炎症、HBV相关免疫因素的影响,观察慢性HBV感染合并NAFLD人群与慢性HBV感染者之间的临床差异。研究结果显示,BMI、UA、Alb、TG、Glu、FibroTouch脂肪衰减值是慢性HBV感染合并NAFLD患者的独立危险因素。其中,BMI值的增高与肥胖密切相关,血糖的增高是诊断糖尿病的标准。报道指出[14],CHB患者合并肥胖、糖尿病,抗病毒治疗后,纤维化的改善程度不明显,考虑与肝脏脂肪样变有关。同样,糖尿病与NAFLD密切相关,也被证明是CHB患者发生HCC的独立危险因素[15]。NAFLD人群中高尿酸血症的发病率为20%~33.4%,显著高于普通人群[16],随着尿酸水平升高,NAFLD患病率逐渐增高。同样,高尿酸人群NAFLD的发病率24.75%,也显著高于非尿酸增高人群的9.54%[17],并且研究发现随着尿酸的增高,NAFLD 的患病率逐渐增高,其病变程度也与血尿酸水平成正相关。与本研究发现相符,慢性HBV感染合并NAFLD患者的血尿酸值显著高于慢性HBV感染者。此外,FibroTouch的脂肪衰减值可结合超声影像学特点,量化NAFLD的严重程度。综上所述,本研究认为,定期监测BMI,筛查尿酸、甘油三酯,血糖、血清白蛋白,以及FibroTouch的脂肪衰减值,综合判断可提高超声诊断NAFLD的准确性,帮助肝病科医生进一步识别慢性HBV感染者是否合并NAFLD。
研究表明,脂质代谢的上调可以促进HBx表达,相反FAS、花生四烯酸等代谢底物的表达可抑制HBV的生命周期[18]。HBV与NAFLD相互影响,反馈调控。目前,临床中对慢性HBV感染合并NAFLD患者的治疗管理暂缺乏统一的标准,先抗HBV治疗,还是先按NAFLD管理,仍存在争议[19]。此外,2020年有国际专家小组提出代谢相关性脂肪肝的命名[20],相比NAFLD能更准确地反映该疾病存在多因素风险的特点,有利于该疾病的分层诊疗和管理。本研究通过分析慢性HBV感染合并NAFLD患者的临床特征,为下一步制订规范化的诊疗管理提供更多依据。由于本研究是回顾性研究,存在一定局限性。PSM匹配尚未控制所有的混杂因素,因此需要更大样本的研究支持。
