超声造影联合常规超声在肝癌微血管侵犯和介入治疗术后早期复发预测中的临床价值
2023-11-23曾晓蓉程晓莉
喻 英 曾晓蓉 程晓莉 毕 慧 欧 亮
乐山市中医医院功能科 (四川 乐山, 614000)
肝癌是威胁人类生存和健康的第六大高发恶性肿瘤,其中超过90%的原发性肝癌为肝细胞癌[1]。本病起病隐匿,早期缺乏典型临床表现,多数患者出现明显的消化道症状时已进展至中晚期,失去手术切除的机会。介入治疗是中晚期肝癌首选应用的治疗方案,临床应用最为广泛,创伤小,疗效肯定[2],但术后存在着较高的复发风险,成为导致患者死亡的重要原因[3]。研究发现,微血管侵犯(MVI)是恶性肿瘤细胞侵袭性的表现,也是肝癌手术治疗后早期复发的影响因素[4]。在介入治疗前如能探索出MVI发生的危险因素,对于指导治疗和预后评估具有重要意义。目前临床常用的TNM分期、CNLC分期等肿瘤分期系统对于治疗方案的制定有一定的指导意义,但对于肿瘤复发的预测方面存在一定不足[5]。近年来提出的各种预测模型在预测术后复发方面具有较高的临床价值,但多数需穿刺活检取得病理学资料[6]。超声造影(CEUS)是近年来应用于临床的超声检查新技术,通过应用特殊的造影剂使肿瘤血管显影,可清晰显示肝癌的肿瘤血管类型和血池形态,在显示肿瘤微循环方面具有明显的优势[7,8]。本研究对168例接受介入治疗的肝癌患者术前进行CEUS和常规超声检查,分析CEUS联合常规超声在肝癌介入术后MVI和早期复发方面的预测价值。
1 资料与方法
1.1 一般资料 选择乐山市中医医院2018年1月至2022年1月收治的实施介入治疗的原发性肝癌患者168例,男135例,女33例;年龄34~78岁,平均(57.4±10.6)岁。纳入标准:①符合原发性肝癌诊断标准,并经病理学证实[9];②首次诊断为本病,未接受相关治疗;③在乐山市中医医院接受经导管肝动脉化疗栓塞术;④术前1周内接受CEUS检查;⑤对本研究知情同意,并签署协议书。排除标准:①复发性肝癌或转移瘤;②曾接受放疗、化疗或射频消融等其他治疗;③远处转移;④对造影剂过敏;⑤有严重内科疾病不能耐受介入治疗;⑥合并血液病或其他部位恶性肿瘤。病理检查时显微镜下观察内皮细胞衬覆的血管腔内见到癌细胞巢团判断为MVI,根据是否发生MVI将168例患者分为MVI组(57例)和nMVI组(111例)。
1.2 方法 168患者均接受常规超声和CEUS检查,仪器应用Philips EPIQ7C型超声诊断仪,配备频率为2.0~5.0 MHz的C251型凸阵探头。超声检查在上午进行,检查前空腹12 h,患者仰卧于诊断床上,重复暴露腹部,常规超声扫查腹部脏器,包括肝脏、脾脏、胆囊、胰腺等,观察并记录肝脏肿瘤的形态、大小、数目、回声情况、周围低回声晕环显示情况,应用彩色多普勒显像对病变进行血流信号分级:无血流信号为0级,1或2个点状或细棒状血流信号为Ⅰ级;3或4个点状血管,或1个较长血管(≥病灶半径)进入病灶为Ⅱ级;≥5个点状血管或2个较长血管为Ⅲ级。之后将模式转换为CEUS,将造影剂SonoVue 2.4 ml溶入5 ml 0.9%氯化钠注射液,抽取2.4 ml以团注法从肘静脉注入,推注时间为2~3 s。同时启动计时器,动态记录肿瘤灌注显影情况,并适时存储静态图像。根据注射造影剂后时间将增强过程分为动脉期(10~30 s)、门脉期(30~120 s)和延迟期(120~360 s),记录肿瘤各期增强情况、瘤周增强情况、肿瘤边缘是否光滑、廓清时相,并记录肿瘤的始增时间、达峰时间和廓清时间。
1.3 随访 治疗后嘱患者定期来院复诊,每3个月进行一次影像学检查和甲胎蛋白检测,随访期间如上述检查支持复发,则进行多学科会诊讨论是否复发。根据术后12个月内是否复发分为早期复发组和无复发组。
1.4 观察指标 比较MVI组和nMVI组之间、早期复发组和无复发组之间常规超声和CEUS影像特点,多因素Logistic回归分析肝癌介入术后发生MVI和早期复发的危险因素,绘制受试者工作特征曲线(ROC),分析常规超声、CEUS以及CEUS联合常规超声对MVI和早期复发的预测价值。

2 结果
2.1 MVI组和nMVI组、早期复发组和无复发组超声影像特征比较 168例接受介入治疗的肝癌患者经病理学证实57例存在MVI(MVI组),111例无MVI(nMVI组),随访截至2022年12月31日,早期复发43例(早期复发组),无复发125例(无复发组)。MVI组和nMVI组肿瘤大小、肿瘤包膜完整情况、微血流分级、肿瘤边缘光滑情况、瘤周强化率、门脉期和延迟期增强情况及廓清时间差异有统计学意义(P<0.05),早期复发组和无复发组上述超声影像特征差异有统计学意义(P<0.05)。其余指标各组差异均无统计学意义(P>0.05),见表1。典型病例见图1,2。

图1 肝癌合并MVI常规超声、CEUS声像图

图2 肝癌不合并MVI常规超声、CEUS声像图

表1 MVI组和nMVI组、早期复发组和无复发组超声影像特征比较 [例(%)]
2.2 MVI和肝癌介入术后早期复发的多因素分析 多因素Logistic回归分析显示:肿瘤大小、肿瘤包膜不完整、微血流分级、瘤周强化、延迟期低增强、肿瘤边缘不光滑是MVI发生的独立影响因素;而微血流分级、瘤周强化、肿瘤边缘不光滑是肝癌患者介入治疗术后早期复发的独立危险因素。见表2,3。

表2 各超声影像特征预测MVI的多因素Logistic分析

表3 肝癌介入术后早期复发的多因素Logistic分析
2.3 常规超声、CEUS对MVI的诊断效能 ROC曲线显示常规超声(肿瘤大小+包膜不完整+微血流分级)诊断MVI的AUC为0.623(95%CI=0.572~0.698),敏感性和特异性分别为68.4%和71.3%(图3);CEUS(瘤周强化+延迟期低增强+肿瘤边缘不光滑)诊断MVI的AUC为0.640(95%CI=0.580~0.701),敏感性和特异性分别为69.4%和73.5%(图4)。常规超声联合CEUS诊断MVI的AUC为0.808(95%CI=0.712~0.897),敏感性和特异性分别为73.0%和85.3%(图5)。常规超声联合CEUS预测MVI的AUC高于二者分别单独应用(P<0.05)。

图3 常规超声预测MVI的ROC曲线

图4 CEUS预测MVI的ROC曲线
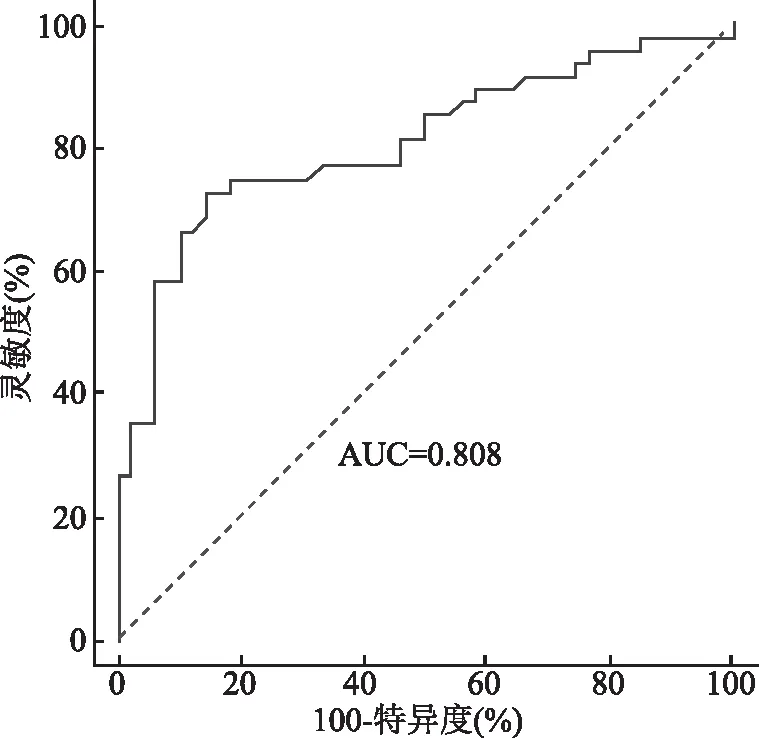
图5 常规超声联合CEU预测MVI的ROC曲线
2.4 常规超声、CEUS对肝癌介入术后早期复发的预测价值ROC曲线显示常规超声(微血流分级)预测早期复发的AUC为0.618(95%CI=0.559~0.674),敏感性和特异性分别为65.1%和71.7%(图6);CEUS(瘤周强化+肿瘤边缘不光滑)预测早期复发的AUC为0.621(95%CI=0.573~0.706),敏感性和特异性分别为66.84%和74.0%(图7)。常规超声联合CEUS预测早期复发的AUC为0.784(95%CI=0.692~0.845),敏感性和特异性分别为70.9%和76.5%(图8)。常规超声联合CEUS预测早期复发的AUC高于二者分别单独应用(P<0.05)。

图6 常规超声预测肝癌介入术后早期复发的ROC曲线
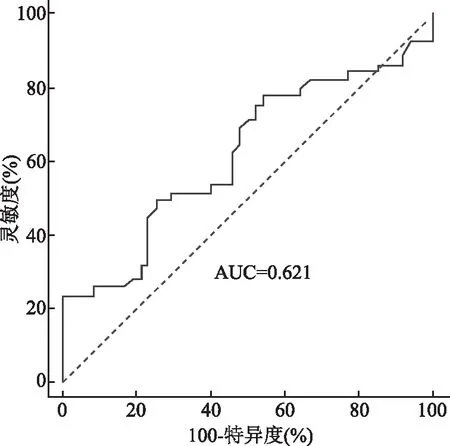
图7 CEUS预测肝癌介入术后早期复发的ROC曲线
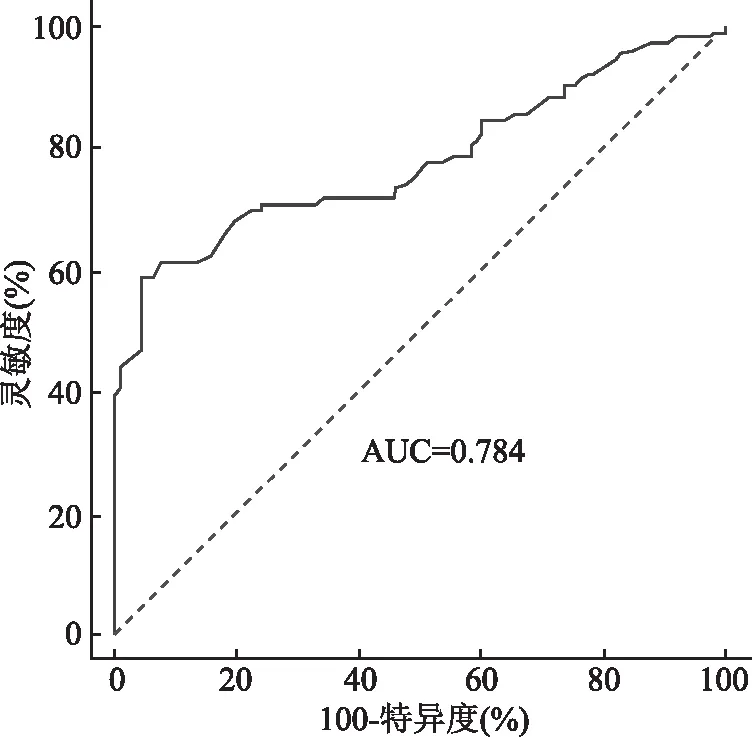
图8 常规超声联合CEUS预测肝癌介入术后早期复发的ROC曲线
3 讨论
MVI是肝癌侵袭性生物学行为的重要指标,发生MVI的患者治疗后复发风险高,远期生存率低,预后较差[10],肝癌介入治疗前准确预测MVI对于方案的制定和预后评估具有重要意义。超声检查是临床应用较为广泛的常规检查项目,在肝脏病变的诊断中具有较高的临床价值,尤其CEUS在肝脏肿瘤的鉴别诊断、术后复发的预测方面具有独特的优势[11]。
本研究结果发现常规超声检查指标肿瘤大小、肿瘤包膜不完整和微血流分级是肝癌患者MVI发生独立影响因素。肿瘤体积越大,与正常肝组织的接触范围也越大,微血管的数量也显著增加,增大了MVI的发生风险。马国杰等[12]研究也发现肝细胞癌患者肿瘤直径>5 cm是发生MVI的独立预测因素,与本研究结果一致;但也有学者得出不同的研究结论[13],可能与样本量存在一定差异有关。肿瘤包膜是包绕于肿瘤表面的薄层纤维囊状结构,其主要作用是阻止肿瘤组织向正常组织侵袭,故肝癌肿块周围包膜不完整或无包膜时,肝癌细胞容易向周围组织扩散,从而形成MVI。有研究发现,肝癌肿瘤血管的分布和数量可在一定程度上影响患者的预后[14]。本研究也发现微血流分级是肝癌患者MVI发生独立影响因素,也是介入治疗后复发的独立危险因素,彩色多普勒显示为血流速度较快的血管,通过彩色多普勒发现肝癌组织内的多条血管主要是肿瘤的供血动脉,供血动脉数量较多说明肝癌组织内部压力较高,肿瘤内部的高压环境可促使癌细胞脱落,并随血液循环至周围血管形成MVI,部分癌细胞还会扩散至肝脏其他位置,成为早期复发的促进因素[15,16]。
CEUS可客观评价肝脏病变的血流动力学变化,可准确反应肝癌的微血管灌注情况。本研究发现瘤周强化是肝癌发生MVI的独立影响因素,也是介入术后早期复发的危险因素。肝癌病灶周围门静脉分支受到肿瘤浸润后,瘤栓的阻塞作用减少了门静脉的灌注,同时肝动脉血液供应明显增加,病灶周围呈现肝动脉高灌注,CEUS表现为瘤周高强化,因此,瘤周强化反应了肿瘤较强的侵袭能力,介入治疗后复发风险大[17]。肝癌组织的血来源与其分化程度有关,高分化肝癌由肝动脉和部分门脉供血,而低分化肝癌主要由肝动脉供血,故CEUS动脉期增强情况更为显著,同时由于低分化肝癌多有动静脉瘘形成,使得造影剂廓清更快,门脉期、延迟期表现为低增强(与肝实质相比),MVI也会在肝癌组织内形成动静脉短路,使造影剂在门脉期、延迟期廓清速度更快,本研究发现延迟期低增强是MVI的独立影响因素,与王斐倩等[18]的研究结果一致。本研究还发现肿瘤边缘不光滑是肝癌发生MVI的独立影响因素和术后早期复发的危险因素,肿瘤边缘不光滑的病理基础是肿瘤突破包膜向周围肝实质延伸,包括单结节外伸、多结节融合和周围浸润,肿瘤边缘不光滑的出现表明该病灶异质性生长更为旺盛,恶性程度更高,介入治疗后复发风险大,另外不管是单结节还是多结节向外侵犯,均会增加肿瘤组织与周围组织的接触面积,有利于肿瘤向周围侵袭,也更容易发生MVI[19]。
本研究发现CEUS和常规超声对于肝癌MVI和介入治疗术后早期复发均有一定的预测价值,但二者联合应用AUC明显升高,因此,CEUS联合常规超声可弥补各因素的不足,提高对MVI和介入术后早期复发的预测价值。本研究也存在一定局限性,首先,由于条件所限,纳入的病例数较少,所得结论尚需扩大样本量进一步验证;其次,病灶位置会对内部血流信号产生一定影响,如肿瘤位置接近膈肌顶部,受到心脏搏动影响,内部的血流信号则难以清晰显示,进而对血流分级判断产生影响;另外常规超声和CEUS均可能受到操作者主观性的影响,从而在一定程度上对研究数据产生影响。进一步的研究中可开展大样本、多中心研究对试验结论进行验证。
综上所述,CEUS联合常规超声对肝癌MVI和介入治疗术后早期复发具有较高的临床价值,在肝癌介入治疗前应重视CEUS和常规超声检查,以利于实施更合理的治疗方案,最大程度改善患者预后。
