NK细胞培养及杀伤前列腺癌细胞效率的研究*
2023-11-22王丙萍刘彩云高艳伟高维实陆相吉
王丙萍 刘彩云 高艳伟 高维实 陆相吉
(1.内蒙古自治区人民医院肿瘤研究所,内蒙古 呼和浩特 010017;2.北京亦科诺生物科技有限公司,北京 100176;3.内蒙古自治区人民医院腹部肿瘤外科,内蒙古 呼和浩特 010017;4.武警内蒙古自治区总队医院普外科,内蒙古 呼和浩特 010010)
前列腺癌(Prostate cancer,PCa)是危害老年男性健康的常见癌症之一,并且在我国呈明显的逐年上升趋势[1-2]。细胞免疫治疗(Cell immunotherapy, CIT)是免疫治疗的一种,开始于20世纪70年代,1997年被美国食品药品监督管理局(Food and drug administration,FDA)批准正式纳入美国药品法规接受监管,CIT原理是将人体内的抗肿瘤免疫细胞采集后,经过体外培养扩增后回输患者,以增强人体免疫系统,从而达到抗肿瘤的目的。NK细胞(Natural killer cell)是机体除T细胞之外的另一抗肿瘤利器,本身具有广谱的肿瘤杀伤能力。NK细胞数量减少或者功能受损与各种类型癌症的进展相关。在应用NK细胞作为过继性免疫治疗的细胞时,NK细胞的主要来源是外周血,但外周血单个核细胞中NK细胞的数量仅占10%~15%,因此NK细胞的体外扩增培养十分重要。本研究建立了一种快捷、方便、高效的NK细胞体外扩增方法,将外周血中占比较少的NK细胞扩增到纯度较高、数量充足,从而为NK细胞的过继性免疫治疗奠定基础。通过NK细胞对3种PCa细胞系LNCaP、DU145、PC3杀伤率的研究,鉴定其用于后期治疗PCa的可行性,为应用NK细胞过继回输治疗PCa的研究奠定基础。
1 材料与方法
1.1 实验材料 PCa细胞株PC3、LNCaP、DU145购自中国科学院上海细胞所;VIVOTM15培养基、DMEM高糖培养基、1640培养基、胎牛血清(Fetal bovine serum, FBS)、胰酶、磷酸盐缓冲液(PBS)(美国Gibco公司);IL-2、IL-7、IL-15、IL-18、IL-21、OKT3(美国R&D公司);抗人CD16单克隆抗体(中国北京同立海源生物科技有限公司);Ficoll淋巴细胞分离液(中国TBDTM公司);荧光标记单克隆抗体:CD3-FITC、CD56-PE、鼠抗人IgG-FITC(美国BD公司);CCK8试剂盒(中国博士德生物公司)。
1.2 实验仪器 二氧化碳培养箱及生物安全柜(Thermo,美国);倒置荧光显微镜(Leica,德国);FACSCalibur流式细胞仪(BD,美国);高速离心机(Eppendorf,德国);超净工作台(苏州泰安空气技术有限责任公司,中国);ELx808吸收光酶标仪(Biotec,美国)。
1.3 方法
1.3.1 PCa细胞株的培养 PCa细胞株PC3的培养液为90% DMEM-F12 +10% FBS;LNCaP的培养液为90% RPMI-1640+10% FBS;DU145的培养液为90% DMEM高糖+10% FBS。从液氮罐取出需要解冻的细胞,立即放入37 ℃水浴锅中,快速摇动,使冻存的细胞尽量在1 min内融化。将冻存管用酒精消毒后迅速移入超净工作台。用移液器将细胞液移入1.5 mL管中,1 500 rpm/min离心5 min,弃液,加入1 mL培养液轻轻悬浮细胞,细胞计数板计数,按细胞数1×106个/瓶的数量接种在T25的培养瓶中,37 ℃,5% CO2培养箱中培养。细胞培养至贴壁90%左右传代培养,0.25%胰蛋白酶消化的时间分别是LNCaP、DU145为1 min,PC3为3 min。
1.3.2 外周血单个核细胞(PBMCs)分离 Ficoll密度梯度离心法分离PBMCs:使用肝素钠采血管抽取静脉血15 mL,Ficoll与血液体积比为1∶2,用移液管缓慢地在Ficoll上层加入血液;在水平转头离心机中离心(22 ℃,800 g,15 min,升速5,降速4);离心结束后,在不扰动白膜层的情况下,用注射器吸出血浆层,转移至1支15 mL离心管,将血浆管置于56 ℃水浴锅内保持30 min,之后置于4 ℃冰箱内10 min进行冷却,离心(1 500 g,5 min,22 ℃,升速9,降速9)后转移上清至1支新的15 mL离心管,保存于4 ℃备用;用巴氏吸管将白膜层仔细移出,移到另1支15 mL离心管,加入PBS至15 mL,吹打清洗,上离心机后(22 ℃,600 g,7 min,升速9,降速7),弃上清液,用2 mL VIVOTM15培养基重悬PBMCs细胞,显微计数,取样进行流式检测。
1.3.3 NK细胞的诱导扩增 ①Day0接种:调整PBMCs细胞密度为1.5 M/mL, 加入自体血清10%,IL-2 1 000 IU/mL,IL-7 10 ng/mL,IL-15 50 ng/mL,IL-18 10 ng/mL,IL-21 50 ng/mL,OKT3 10 ng/mL,Anti-CD16 10 ng/mL,90% VIVOTM15培养基培养细胞,细胞接种密度≤1.5 M/mL,密度过大影响NK生长,放入37 ℃,5% CO2培养箱中培养。②Day3补液:细胞计数,根据细胞数量补充培养液,补液调节细胞的密度为1.0 M/mL;培养基=90% VIVOTM15培养基+自体血浆10%+IL-2 1 000 IU/mL,如果细胞团较小,或者无细胞团,本次不计数,不晃动培养瓶,直接补充原体积1/2培养基继续培养。③Day5补液:细胞计数,调整细胞密度为1.0 M/mL,培养基=90% VIVOTM15培养基+自体血清10%+IL-2 1 000 IU/mL)。④Day7~Day14补液:每次补液调整细胞密度为0.5~1.0 M/mL, 自体血浆10%,加入IL-2 1 000 IU/mL,培养过程中细胞密度不可超过2.0 M/mL。⑤Day14收获:流式细胞仪检测结果,合格后收获细胞。
1.3.4 流式细胞检测 免疫荧光标记法进行流式细胞分析,取NK细胞1 mL,PBS洗涤,1 500 rpm/min离心5 min,弃液,加入50 uL PBS轻轻悬浮细胞20 μL CD3-FITC和20 uL CD56-PE,4 ℃避光保存30 min。PBS洗涤后流式细胞仪分析检测,用异硫氰酸(FITC)标记IgG作为阴性对照,根据流式细胞分析图中 CD3-CD56+的百分比,确定NK细胞所占比例。
1.3.5 CCK-8法检测杀伤效率 以NK细胞为效应细胞,靶细胞分别为PCa细胞株LNCaP、DU145、PC3。将3种靶细胞以5×103个/孔 的数量分别接种于96孔板中,于37 ℃,5% CO2培养箱中培养12 h后,轻轻吸除培养液。按效靶比0.1∶1、0.5∶1、1∶1、2∶1、5∶1、10∶1、15∶1、20∶1的比例分别加入效应细胞,每孔200 μL培养液,同时设置单独靶细胞孔和每种比例的单独效应细胞孔,每个比例3个复孔。共同培养24 h后,加入CCK8试剂20 μL/孔,放于37 ℃,5% CO2培养箱中,孵育3.5 h后用酶标仪测定450 nm波长的OD值,以此方法检测NK细胞的细胞毒活性,公式如下:杀伤率(%)=[1-(实验组OD值-单独效应细胞OD值)/单独靶细胞组OD值]×100%。

2 结果
2.1 NK细胞的培养结果 健康人外周血分离PBMCs后,经细胞因子诱导扩增NK细胞。第0天为散落的颗粒状细胞(图1A),3~4 d后聚集成团,出现细胞集落(图1B),培养10~14 d后,细胞重新分散为单个细胞(图1C)。经流式细胞仪鉴定CD3-CD56+细胞(图1D~F),外周血中占比较少的NK细胞(10.97±3.28)%,扩增到占比(83.20±8.54)%以上,细胞总数扩增倍数为(251.66±19.05)倍,NK细胞扩增倍数为(1 940.17±402.22)倍,见图1G~I。
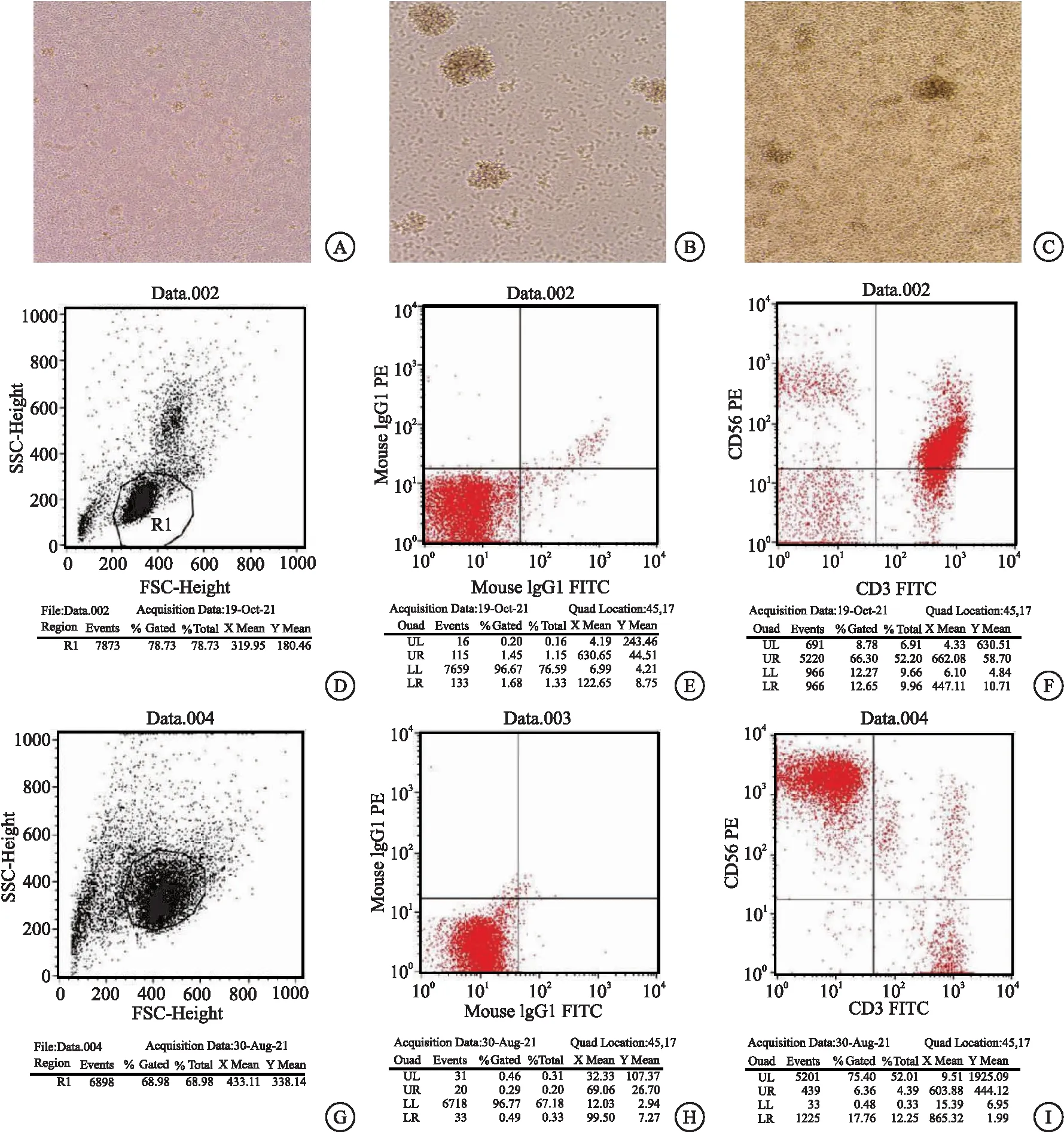
图1 NK细胞的培养结果
2.2 NK细胞毒活性的检测 以NK细胞为效应细胞,靶细胞分别为PCa细胞株LNCaP、DU145、PC3,在不同效靶比的情况下(0.1∶1、0.5∶1、1∶1、2∶1、5∶1、10∶1、15∶1、20∶1),加入CCK8 试剂,孵育3.5 h后,用酶标仪测定450 nm波长OD值的方法检测NK细胞的细胞毒活性(图2)。通过公式分别计算不同效靶比下NK细胞对靶细胞LNCaP、DU145、PC3的杀伤率,结果表明(图3),NK细胞对靶细胞LNCaP在效靶比为1∶1时杀伤率最高(92.03±9.95)%,与效靶比为0.5∶1、2∶1、5∶1、10∶1、15∶1、20∶1的实验组相比,各实验组间差异无统计学意义(P>0.05),但与效靶比0.1∶1实验组相比差异显著(P<0.05)(表1~2);NK细胞对靶细胞DU145在效靶比为10∶1时杀伤率最高(72.40±8.30)%,与效靶比为5∶1的实验组相比差异无统计学意义(P>0.05),但与其它实验组相比差异显著(P<0.05)(表1、3);NK细胞对靶细胞PC3的杀伤率在除了效靶比为0.1∶1、0.5∶1的实验组外,其余各实验组的杀伤率均为负数,并且各实验组间差异显著(P<0.05)(表1、4),说明NK细胞对前列腺癌PC3细胞株没有杀伤效果;并且随着效靶比逐步增高,其负数值越大,说明NK细胞对其有促进生长作用。
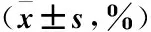
表1 NK细胞对靶细胞LNCaP、DU145、PC3的杀伤率
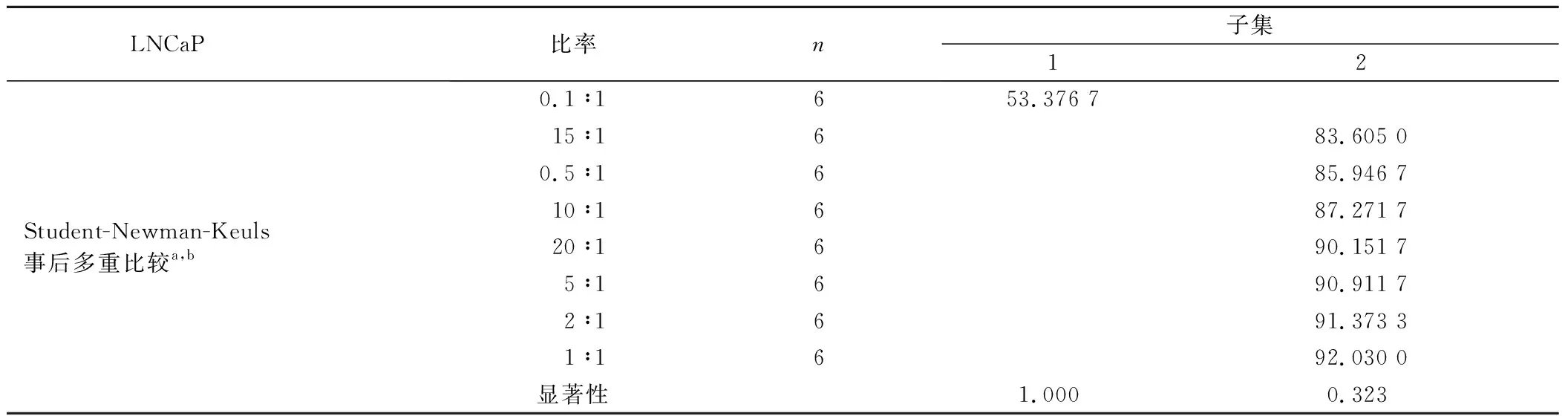
表2 NK细胞在不同效靶比时对LNCaP靶细胞的杀伤率分组
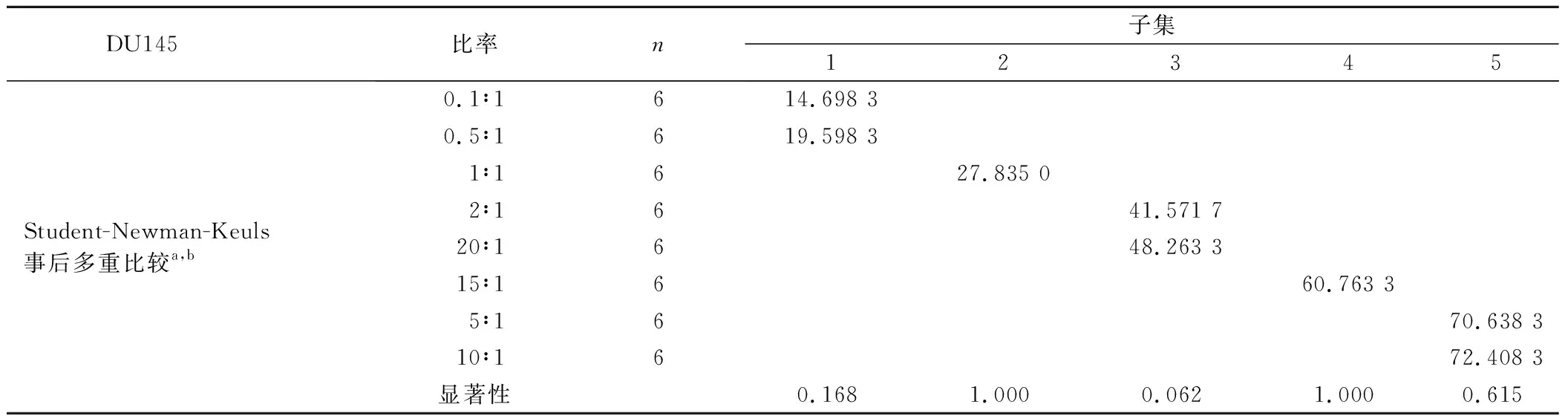
表3 NK细胞在不同效靶比时对DU145靶细胞的杀伤率分组

表4 NK细胞在不同效靶比时对PC3靶细胞的杀伤率分组
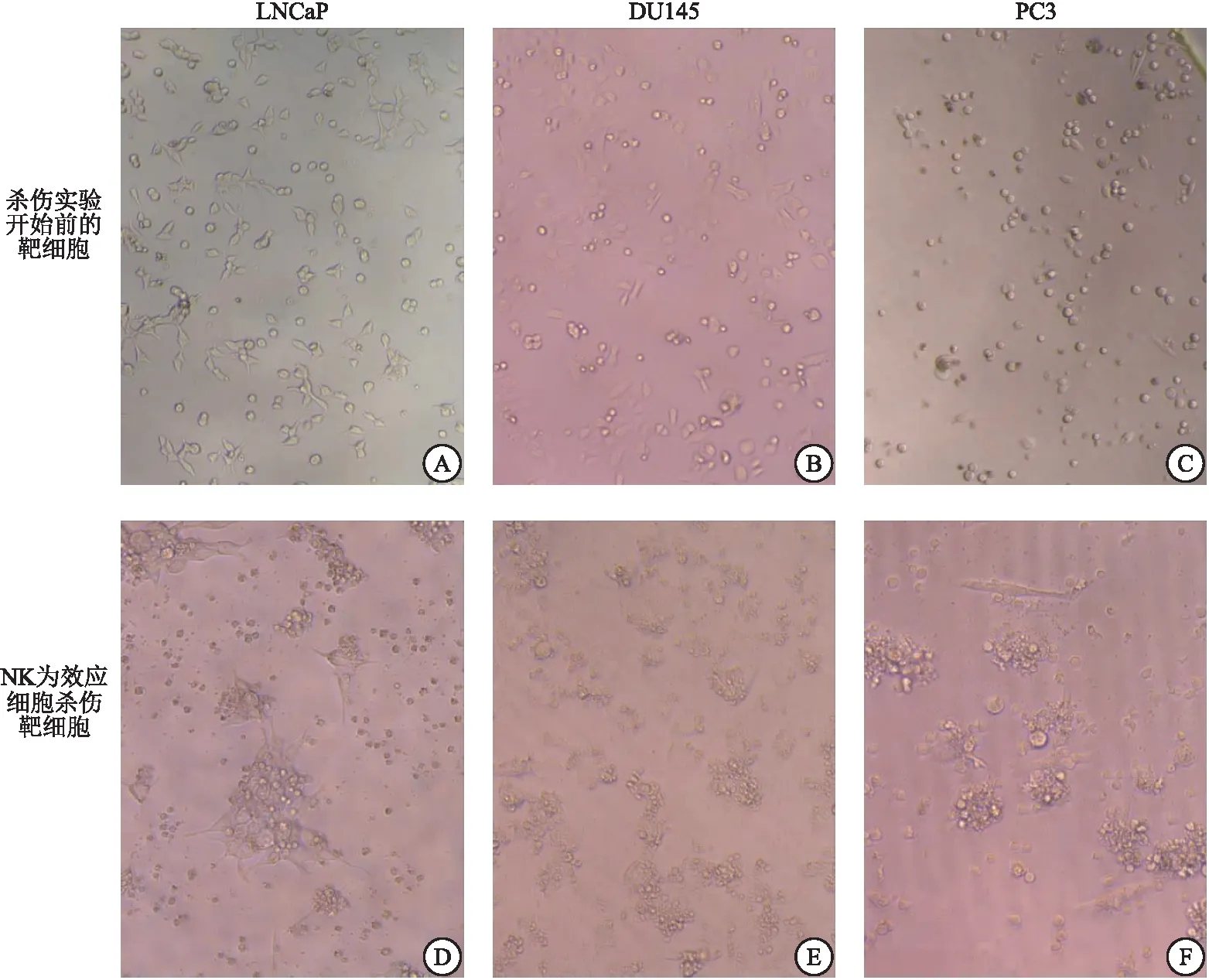
图2 效应细胞NK对靶细胞LNCaP、DU145、PC3在效靶比为10∶1时的杀伤图
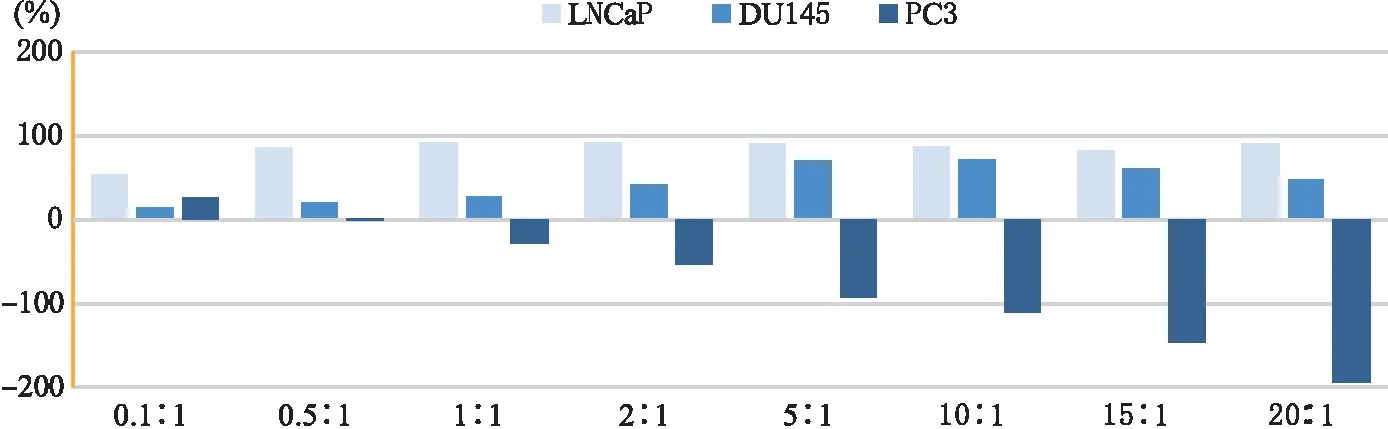
图3 NK细胞对靶细胞LNCaP、DU145、PC3的杀伤率
3 讨论
PCa是目前全世界男性中最常见的恶性肿瘤之一,近年来死亡人数在持续增加[3]。在我国,PCa发病率近年来已出现逐步升高趋势[4],并且PCa发病隐匿,导致大多数人发病时已处于癌症晚期[5-6]。目前对于PCa的治疗手段主要包括手术治疗、内分泌治疗、放疗以及化疗[7-8]。而对于晚期和转移性的PCa患者,雄激素剥夺治疗是其主要治疗手段,但由于其副作用严重、发生概率高,且疾病进展后,患者将失去所有现有治疗手段对生存期的收益。因此,对于这部分PCa患者急需开发出新的治疗手段,以提高其生活质量、延长生存期。
NK细胞是大颗粒淋巴细胞,约占人体外周血淋巴细胞总数的10%左右[9]。NK细胞参与天然免疫和适应性免疫,是先天免疫系统中最具杀伤性的细胞毒性淋巴细胞,能够介导强大的抗病毒和抗肿瘤作用[10]。NK细胞是除T细胞之外的机体抗肿瘤的另一重要利器,其本身具有广谱抗肿瘤的作用,同时还具有强大的间接增强T细胞免疫应答的作用,是T细胞发挥抗肿瘤功能的基础[11]。
有研究表明,NK细胞过继性回输在晚期非小细胞肺癌的治疗中取得了令人满意的效果[12]。免疫检查点抑制剂与NK细胞联合应用,在治疗白血病和非小细胞肺癌患者时是安全、有效且具有生存益处的[13]。与T细胞相比,NK细胞的过继性回输具有耐受性良好,神经毒性、细胞因子释放综合征(Cytokine release syndrome,CRS)和移植物抗宿主病(Graft-versus-host disease GVHD)等严重不良反应的发生率大大降低;同种异体NK细胞的回输还能避免或降低杀伤细胞免疫球蛋白样受体(Killer-cell immunoglobulin-like receptors,KIRs)介导的抑制性信号,从而发挥更好的抗肿瘤作用[14-16]。
本研究建立了一种NK细胞体外诱导扩增的方法,将外周血中占比较少的NK细胞(10.97±3.28)%,扩增到占比(83.20±8.54)%以上,细胞总数扩增倍数为(251.66±19.05)倍,NK细胞扩增倍数为(1 940.17±402.22)倍。高效的NK细胞体外扩增方法的成功建立为NK细胞的过继性免疫治疗的广泛应用奠定了基础。
LNCap细胞系保留了PCa肿瘤细胞学及其早期分化功能的特征,代表着早期雄激素依赖性的PCa的显著特征。LNCap细胞倾向分泌总前列腺特异性抗原(tPSA),而升高的tPSA提示为雄激素依赖性和早期肿瘤[17]。DU145细胞系分化程度低,为雄激素非依赖的PCa细胞,具有强大的转移潜能,缺乏内源性的雄激素受体的表达[18]。DU145以分泌游离前列腺特异性抗原(fPSA)为主,而升高的fPSA应警惕雄激素非依赖性肿瘤的存在[19]。PC3细胞系分化程度低,为雄激素非依赖性PCa细胞,不含有内源性的雄激素受体,具有中等强度的转移潜能,被广泛用于雄激素抵抗型的PCa的研究[20]。本研究结果显示效应细胞NK细胞对3种靶细胞的杀伤率差异极显著(P<0.01),杀伤效率为由高到低分别为LNCaP细胞、DU145细胞、PC3细胞;并且对于PC3细胞,随着效靶比的增高,不但没有杀伤作用,反而促进其生长(杀伤效率为负数)。本研究通过对以往研究资料的梳理,发现在生物学特性方面[18],PC3细胞、DU145细胞是激素抵抗性前列腺癌(Castration resistant Pros-tate Cancer,CRPC),而LNCaP细胞是激素敏感性前列腺癌(Metastatic hormone-sensitive prostate cancerm,mHSPC),为什么NK细胞对LNCaP的杀伤效果好,而对PC3细胞反而无杀伤力?甚至促进其生长?可能的机制是NK细胞对mHSPC杀伤效果好而对于CRPC杀伤效果差甚至起到反作用。PC3与DU145均为低分化、雄激素非依赖的PCa细胞,均具有转移潜能且缺乏内源性的雄激素受体的表达,均同时表达细胞生长因子CK5和CK8/18;而PC3与LN-CaP均表现为上皮细胞特性、高表达E-cadherin、不表达Vimentin。因此,除PC3细胞不表达野生型P53蛋白,而DU145和LNCaP细胞均可表达野生型P53蛋白外,并没有发现PC3细胞系与另外两株PCa细胞系的不同之处。然而,P53基因是人体的抑癌基因之一,其突变会导致原有抑癌功能的丧失,同时获得新的致癌功能;有研究证明表达野生型P53基因的肿瘤细胞对放、化疗的敏感性强于不表达野生型P53基因的肿瘤细胞[21]。这说明本研究中“NK细胞促进PC3细胞系生长”的结果,可能是由PC3细胞系不表达野生型P53蛋白引起的;也可能是由PC3细胞系的特殊性导致的,而这种“特殊性”在目前的研究资料中并没有呈现出来,因此需要后续进行深入研究探索其作用机制。本研究的结果为肿瘤免疫逃逸的研究提供了可作为目标的研究细胞以及研究方向,为应用NK细胞过继性回输治疗前列腺癌的临床应用奠定了基础。
4 结论
采用细胞因子诱导扩增PBMCs的方法能够获得纯度较高、数量足够的NK细胞,为NK细胞的临床应用奠定基础;NK细胞对3种PCa细胞系的杀伤率差异极显著,为后续进行深入研究探索原因及作用机制提供了方向。
