多囊卵巢综合征模型大鼠卵巢中结缔组织生长因子及基质金属蛋白酶-9的表达*
2023-11-22张璐刘明盛杨旭李兰
张璐 刘明盛 杨旭 李兰
(成都市第五人民医院·成都中医药大学附属第五人民医院妇产科,四川 成都 611130)
多囊卵巢综合征作为临床常见的一种内分泌系统疾病,育龄期女性作为该疾病的高发群体,发病几率高达10%,近年来有上升趋势[1]。患者伴随闭经、肥胖、不孕以及双侧卵巢发生多囊性增大等临床症状,患者需面临较为严重的身心健康压力[2]。国内外针对该疾病的研究资料中指出,在卵泡发育、成熟、排卵、三黄体形成退化等一系列过程中,与细胞外基质(ECM)之间存在密切关联性,其中基质金属蛋白酶-9(Matrix metalloproteinase-9,MMP-9)作为特殊的胶原酶,发挥降解IV型胶原的功能[3],胶原又是ECM的主要组成之一。另外研究资料针对结缔组织生长因子(Connective tissue growth factor,CTGF)进行分析发现,该物质对ECM的形成也发挥重要作用[4]。研究表明MMP-9和CTGF均为卵巢局部调节因子,但是目前针对多卵巢综合征与上述两种因子之间的关联性的相关研究并不多见[5]。本研究拟采用Poresky试验法制作多囊卵巢综合征大鼠模型进行对照分析,借助测定并深度对比分析试验对象的促黄体生成激素(Luteinizing hormone,LH)、促卵泡激素(Follicle-stimulating hormone,FSH)、雌二醇(E2)、垂体泌乳素(PRL)、睾丸素性等激素含量及CTGF和MMP-9含量来探讨这两种因子在多囊卵巢综合征中的作用。
1 材料与方法
1.1 实验动物 选择52只6周龄、规律动情周期的健康SPF级SD雌性大鼠。随机分为对照组及模型组,每组26只。进行实验前两组大鼠均放置在温度以及湿度适宜的同等环境内,饮水、饮食等环境一致。实验所有项目均符合动物伦理要求以及对应的实验管理要求(AF/54/2020-02.3)。
1.2 主要实验试剂 LH放免试剂盒(天津中新科炬生物制药公司);FSH放免试剂盒(上海沪宇生物科技有限公司);E2放免试剂盒(上海沪宇生物科技有限公司);PRL放免试剂盒(天津中新科炬生物制药有限公司);睾丸素放免试剂盒(天津中新科炬生物制药有限公司);CTGF一抗(武汉博士德生物工程公司);CTGF二抗/三抗(北京中杉公司);MMP-9一抗/二抗/三抗(北京中杉公司);免疫组化试剂盒(PV-9000)(北京中山金桥生物科技有限公司)。
1.3 造模方法 构建满足实验需求的模型大鼠:对照组与模型组造模应用Poresky法进行;对照组大鼠每日灌胃浓度为1%的羧甲基纤维素,连续灌胃21 d,该段时间内每天进行阴道涂片以明确该组大鼠的动情周期是否存在变化。模型组大鼠先将来曲唑溶解至浓度为1%的羧甲基纤维素后再行灌胃给药操作,该过程需注意给药计量控制为1 mg/kg,精确完成操作,时间为21 d。见图1。

图1 大鼠灌胃示意图
1.4 造模成功的检测标准 模型大鼠制作期间,两组大鼠需同等饲养环境下,自由饮食,灌胃期间需每周周六对其体重、血清LH以及胰岛素情况进行测定。一旦所测定指标出现异常,并且实验个体的空腹血糖水平出现上升趋势(测定参照指标为>6 mM/L时),尿糖量也出现一定波动(>4.7 mM/L),则表明本次实验所需的样本依照相关文献研究标准,满足实验要求[5],即所需要的多囊卵巢综合征大鼠模型制作成功。
1.5 标本采集 当模型组大鼠动情周期发生变化且连续出现间期时,开始标本采集,对照组在其间期采集标本。具体方法如下:①21 d最后1次完成灌胃操作后需对所有实验大鼠进行禁食干预,时间为12 h,随后以缺血法处死实验个体,完成操作后立即采集其5 mL的心脏血液,并2 000 r/min离心操作后取上层血清,在零下40 ℃保存备用。②随后摘取各组实验个体的子宫及卵巢,完成称重操作,做好个体记录后,对卵巢进行剖开操作,操作时需注意沿长径方向,随后以10%福尔马林固定备用。
1.6 观察指标及测量方法
1.6.1 放射免疫法(RIA) 测定LH、FSH、E2、PRL和睾丸素等指标对模型大鼠内分泌改变情况,并对其进行评价。切片制备和组织学观察:修剪卵巢组织并行石蜡包埋处理,以4 μm厚度进行切片并进行HE染色,具体方法如下:①脱蜡:切片放置入烘箱中完成烘干操作,温度调节为60 ℃,时间设定为0.5 h,完成烘干后将样本拿出快速放置在二甲苯溶液中,浸泡15 min后将切片放置在新鲜的二甲苯溶液中完成浸泡处理,时间设定为15 min,脱蜡操作完成。②水化:切片放入无水乙醇Ⅰ后取出放置进入无水乙醇Ⅱ,并以此按照95%、90%、80%、70%的顺序放置进乙醇溶液中,时间为5 min ,浸泡完成后需放入自来水中完成冲洗,冲洗时间设定为3 min。③苏木素染色:苏木素染料浸泡染色,15 min,自来水冲洗3 min。④伊红染色:伊红染料浸泡染色,2 min,自来水冲洗3 min。⑤脱水:依次放在80%乙醇中,30 s,95%(Ⅰ)、95%(Ⅱ)、100%(Ⅰ)、100%(Ⅱ)乙醇各1 min。⑥透明:切片放入二甲苯Ⅰ、Ⅱ中各5 min。⑦封片:脱水后的切片需放置在平整的桌面上,待二甲苯挥发干后,在切片上滴加适量中性树胶进行封片。⑧拍摄:待中性树胶完全干燥后,借助倒置显微镜完成切片的观察以及拍摄操作。
1.6.2 免疫组织化学法 测定卵巢组织中MMP-9和CTGF的表达,明确为阳性的切片划分为阳性对照组,而PBS代替一抗为阴性对照对上述含量表达进行评定,观察到胞浆组织内有棕黄色或者棕褐色的颗粒状物质时判定为阳性,选择合适角度进行拍照处理后,经过Biosens Digital Imaging System分析对其影像学的灰度值进行确定,具体方法如下:①脱蜡:与1.6.1中HE染色中的方法相同。②水化:与1.6.1中HE染色中的方法相同。③内源性酶灭活:切片滴加3% H2O2,室温条件下,避光孵育10 min,去离子水清洗5 min ,重复3次。④抗原修复:切片放在柠檬酸盐冲洗液中浸泡,微波炉加热至沸腾,95 ℃保温10 min,溶液冷却至室温用PBS清洗5 min ,重复3次。⑤封闭:取1x羊血清封闭液滴加于肺组织切片上,随后将切片置于湿盒中,在37 ℃条件下孵育30 min。⑥孵育一抗:弃去封闭液,向组织切片上滴加一抗200 μL,切片组织放置在湿盒中,并将湿盒置于温度为4 ℃的环境下完成孵育过夜。⑦复温清洗:取出切片组织放置在恒温箱中,将温度设定为37 ℃,完成孵育操作,时间约为30 min,使用PBST清洗10 min,重复清洗3次。⑧孵育二抗过程:向组织上滴入荧光二抗,随后将切片组织放置在湿盒中,调节好恒温环境,在37 ℃条件下孵育3 h。⑨清洗:吸弃荧光二抗,使用PBST清洗10 min,重复清洗3次。⑩脱水、透明、封片方法HE染色相同。拍摄:使用显微镜进行切片观察。

2 结果
2.1 造模成功动物数量及过程 本实验共收集52只SD大鼠,根据不同灌胃给药方法分为对照组和实验组,并采用Poresky法进行造模,两组每周6测定大鼠体重变化,持续3周,并评定造模效果。两组大鼠在制作过程中未发生死亡和感染,结果显示,52只大鼠造模成功。
2.2 实验模型的改进 应用Poresky法进行造模,在此基础上给予胃灌药的同时给予皮下注射,将剂量下调,确保了造模成功率和缩短了给药时间,且SD大鼠与人类发育机制相近,已被用于临床各种疾病的造模实验,且Poresky法方法造模稳定性较高。
2.3 两组大鼠内分泌改变情况比较 模型组LH、PRL、睾丸素含量明显高于对照组(P<0.05),FSH、E2明显低于对照组(P<0.05),见表1。
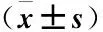
表1 两组大鼠血清性激素分泌情况比较
2.4 两组大鼠卵巢中CTGF的表达情况 统计切片结果显示,CTGF在卵巢中卵泡基底膜、白膜、颗粒细胞和窦前卵泡卵泡膜胞浆中均有表达。但在多囊卵巢综合征模型组卵巢组织中,窦前卵泡卵泡膜、卵泡基底膜中CTGF表达情况均有明显变化,故本文只对两者进行讨论;其中模型组大鼠窦前卵泡卵泡膜胞浆中的CTGF表达量较对照组明显偏高(t=4.260,P<0.05);在卵泡基底膜胞浆以及白膜中,模型组大鼠的CTGF表达量较对照组均有明显升高(t=5.001,P<0.05;t=5.261,P<0.05),见图2。

图2 两组大鼠卵巢组织中CTGF的表达情况
2.5 两组大鼠卵巢组织中MMP-9的表达情况比较 研究发现MMP-9在卵巢颗粒细胞,卵泡基底膜,始基卵泡、白膜、窦前卵泡卵泡膜胞浆等组织液内均有表达,而实验结果也显示,PCOS大鼠模型组中并不是所有的卵巢组织内的MMP-9都会出现表达异常,只有黄体与卵泡基底膜中MMP-9表达情况均有明显变化,故本文只对两者进行讨论;模型组MMP-9在黄体中的表达明显高于对照组(P<0.05);卵泡基底膜内的MMP-9表达情况低于对照组(P<0.05),见表2。
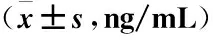
表2 大鼠卵巢组织中MMP-9的表达情况分析
3 讨论
多囊卵巢综合征这一疾病在患者日常工作、生活中具有严重影响,不利于其正常生理活动,患者会伴随不排卵、闭经等一些列生理变化,导致其无法正常受孕,不仅影响其身心健康,还会对其家庭和睦造成不良影响[6-8]。该病涉及广泛病理和生理学改变,如遗传、神经内分泌、物质代谢、卵巢局部调控等变化,因此该疾病的研究成为生殖内分泌研究人员重点关注项目[9-10]。大多数多囊卵巢综合征患者的排卵功能异常,也有极少数患者伴随稀少排卵,但是存在黄体功能异常等现象,因该疾病缺乏深度分析,针对疾病同卵泡发育以及排卵之间的关联性尚处于待研究或研究状态中[11-12]。本次实验的主要目的就是通过构建大鼠多囊卵巢综合征模型,深入研究样本血清性激素水平的变化情况。有文献报道[13-14]指出,CTGF及MMP-9在多囊卵巢综合征中表达异常,可能是由不同分子机制引起的。本研究还深度分析CTGF、MMP-9在卵巢组织中的变化以及对应表达现状,为该病发病机制的后续研究提供一定的参考,也可以为研究两者背后的分子机制提供一个可以参考的实验数据。
目前动物模型因其操作简单、成功率高和重复性好等优点已被广泛应用于临床各项疾病实验中,而使用大鼠和兔动物实验较多[15]。本文选取52只SD雌性大鼠进行实验,因大鼠造模较为稳定,生长速度快及繁殖能力强等优点,广泛使用与生长发育的研究,且本文应用Poresky法有效提高了造模成功率,因此并未发现其他因素对恩赐研究数据以及研究结果的准确性产生的明显影响[16]。研究发现,当多囊卵巢综合症大鼠造模成功后发现血清性激素含量发生较为明显的变化,另外用药期间研究对象体内的性激素水平与未用药之前对比,也发生较为明显的变化,因此分析研究样本体内性激素与该疾病发生、发展存在明显相关性[17-18]。本研究显示模型组中PRL、LH和睾丸素等水平含量明显较对照组升高(P<0.05),说明模型组中的睾丸素在由雄激素转向雌激素时被阻断,从而导致睾丸素蓄积,LH水平升高与睾丸素水平异常表达之间也可能存在一定联系,PRL的升高会造成卵巢局部PRL水平增加,从而导致雄性激素向雌性激素的转换变化。本研究还发现模型组中FSH和E2含量明显较对照组下降,发生这种情况的因素可能与芳香化酶抑制剂造成雌激素合成速率降低有关[19-20]。
研究表明,神经细胞、上皮细胞和血管内皮细胞中均可分泌CTGF,此因子在成纤维细胞增殖变化以及有丝分裂过程中发挥重要的促进作用。有研究发现CTGF参与了ECM形成和多种病理过程,而这一因子的研究中,正常卵巢组织中的表达并未明了[21]。本研究发现,CTGF这一因子在黄体组织、白膜组织以及颗粒细胞组织、窦前卵泡膜等胞浆中均有不同程度的表达,窦前卵泡卵泡膜、卵泡基底膜中CTGF表达情有明显变化,模型组各项表达含量高于对照组,说明CTGF的表达与该疾病发生、发展有联系。且实验发现FSH可抑制CTGF在卵巢组织中的表达,而本实验FSH表达量明显下降,这可能是该疾病大鼠卵巢组织中CTGF高表达的主要原因之一[22-23]。MMP-9属于胶原酶,此指标在破骨细胞中表达量较高。研究发现MMP-9与细胞转移和组织重建有明显相关性,且在雌性动物体内发现MMP-9随着生理周期的波动而变化[24-25]。本研究发现,MMP-9在窦前卵泡卵泡膜胞浆、颗粒细胞、始基卵泡和白膜中均有表达,但MMP-9在黄体和基底膜胞浆中的表达较其他细胞中的表达更加明显,与对照组比较具有统计学意义(P<0.05)。
4 结论
卵巢中CTGF水平变化与该疾病中小卵泡过多表达或者排卵障碍之间存在一定关联性,MMP-9则与多囊卵巢综合征的排卵障碍之间存在关联性。
