不同盐离子对藜麦蛋白凝胶特性及分子间作用力的影响
2023-11-18冯潇武朝升杨玉玲付丽霄陈龙薇汤晓智
冯潇,武朝升,杨玉玲,付丽霄,陈龙薇,汤晓智
不同盐离子对藜麦蛋白凝胶特性及分子间作用力的影响
冯潇,武朝升,杨玉玲,付丽霄,陈龙薇,汤晓智
南京财经大学食品科学与工程学院/江苏省现代粮食流通与安全协同创新中心/江苏高校粮油质量安全控制及深加工重点实验室,南京 210023
【目的】研究添加不同盐离子对藜麦蛋白凝胶特性的影响,探究盐离子影响凝胶特性的分子机理,为藜麦蛋白凝胶加工提供理论依据。【方法】采用碱提酸沉法提取藜麦蛋白。在pH 7.0条件下制备添加50 mmol∙L-1不同盐离子(NaCl、CaCl2、CaSO4、MgCl2)的藜麦蛋白溶液(20%,w/v)。水浴加热后制备凝胶,测定盐离子对凝胶质构、持水力、色差以及水分分布的影响。通过扫描电镜和流变仪研究不同盐离子对藜麦蛋白凝胶微观结构和流变特性的影响,分析分子间相互作用及其二级结构。【结果】中性条件下,盐离子的加入降低了藜麦蛋白凝胶的硬度和持水力(<0.05),增强了凝胶的弹性。添加MgCl2的藜麦蛋白凝胶具有最低的硬度和持水力。NaCl对凝胶的色差没有显著影响。相同浓度下,二价盐离子的加入显著提高了凝胶的亮度和白度,CaCl2的加入使凝胶白度从59.62提高至67.80。添加盐离子促进藜麦蛋白的颗粒聚集,使凝胶的网络结构更加粗糙,加入二价盐离子的蛋白凝胶的微观结构表现出更粗糙和更大的缝隙。同时,相较于空白组和添加NaCl的凝胶,添加二价盐离子显著降低了藜麦蛋白凝胶内的二硫键含量,并削弱了凝胶内的静电相互作用。盐离子的加入使蛋白凝胶的-折叠和-转角含量降低,-螺旋结构和无规则卷曲结构含量增加,降低了二级结构的有序性。【结论】在中性条件下,不同盐离子的加入在不同程度上影响藜麦蛋白的凝胶特性和凝胶的微观结构;相同摩尔浓度下,所有二价盐离子比NaCl制备的凝胶微观结构更粗糙,凝胶硬度和持水力更低,主要是因为添加二价盐离子显著降低了藜麦蛋白凝胶内二硫键的含量,并削弱了凝胶内的静电相互作用。
藜麦分离蛋白;蛋白凝胶;二级结构;水分分布;分子间作用力
0 引言
【研究意义】藜麦()是一种伪谷物[1],营养丰富,联合国粮农组织(FAO)认为藜麦是唯一一种能满足人体基本营养需求的单体植物,被称为丢失的远古“营养黄金”[2]。藜麦种子中的蛋白含量约15%[3-4],且氨基酸组分均衡,包含全部人体必需氨基酸[5]。凝胶性能被认为是植物蛋白重要的功能性质之一,对藜麦蛋白的加工适宜性至关重要[6-7]。蛋白凝胶的性质不仅取决于蛋白本身,还取决于凝胶条件,如加热温度和方式、pH、离子浓度和类型[8-9]。研究不同盐离子对热诱导藜麦蛋白凝胶的影响,对藜麦蛋白凝胶的加工具有重要意义。【前人研究进展】前人已对藜麦蛋白的提取方式、物理改性(微波加热、高压均质)以及酶处理对凝胶特性的影响进行了探究[10-12]。在pH 8或9下提取的蛋白具有较好的凝胶特性,较高pH(10、11)由于碱性环境导致蛋白变性,从而使所提取的蛋白无法形成凝胶[11]。对藜麦蛋白进行适当的酶处理可增强其凝胶特性,采用碱性蛋白酶处理1 min后,可增强藜麦蛋白表面疏水性和凝胶的疏水相互作用[13]。SHEN等[14]研究了不同干燥方式对藜麦分离蛋白流变特性的影响,发现冷冻干燥对蛋白的功能性质影响最小,且具有最高的储能模量。HUANG等[15]研究了微波加热和水浴加热以及加热温度(70、80和90 ℃)对藜麦分离蛋白(QPI)的聚集和凝胶特性的影响。结果表明微波加热方式和更高的温度(90 ℃)可以提高凝胶的强度和持水力。电磁场的存在导致蛋白质内部的分子极化和旋转,使藜麦蛋白分子排列更加有序,增强了凝胶强度。盐离子对藜麦蛋白凝胶特性影响的相关研究较少。YANG等[16]通过流变学和超小角X射线散射和中子散射技术对不同浓度NaCl(0—300 mmol∙L-1)和CaCl2(20、50 mmol∙L-1)影响藜麦分离蛋白的凝胶过程进行了探究,表明盐离子可以降低凝胶温度,使凝胶强度增加;与此同时,加入CaCl2比NaCl使蛋白质的聚集更迅速,从而导致在低温下形成弱的蛋白质网络。但是在Yang等[16]的研究中,由于藜麦蛋白浓度较低(100 mg∙mL-1),并没有形成自支撑凝胶。KASPCHAK等[17]研究了在55 mmol∙L-1CaCl2和MgCl2存在下进行热处理(20—90 ℃)后,浓度为10%的藜麦蛋白凝胶的流变学特征。表明添加CaCl2和MgCl2在酸性条件可以增强凝胶的流变特性,然而在中性条件下降低了凝胶的储能模量。【本研究切入点】目前仅通过流变学对不同盐离子添加的QPI凝胶强度和QPI聚集行为进行了探究,本研究分析不同盐离子对藜麦蛋白热诱导凝胶的凝胶特性影响,进一步研究盐离子影响凝胶特性的机理。【拟解决的关键问题】制备了含有50 mmol∙L-1不同离子(NaCl、CaCl2、CaSO4、MgCl2)的自支撑藜麦蛋白凝胶,通过分析不同盐离子对藜麦蛋白凝胶的水分分布、二级结构、分子间相互作用和微观结构的影响,阐释盐离子对藜麦蛋白凝胶特性的作用机制。
1 材料与方法
试验于2021年6月至2022年6月在南京财经大学粮油质量检测工程技术研究中心进行。
1.1 材料与试剂
藜麦购买自北京金禾绿源商贸有限公司;其基础组分含量为:淀粉58.49%、脂肪6.66%、蛋白质13.55%、粗纤维5.08%、水分9.05%、灰分2.71%。试验所用试剂均为分析纯。
1.2 仪器与设备
Avanti J-26XP高效冷冻离心机,美国Beckman Coulter公司;TA-XT Plus质构仪,英国Stable Micro System公司;NM120-Analyst低场核磁共振仪,上海纽迈电子科技有限公司;CM-5色差仪,日本Konica Minolta公司;MCR 302流变仪,澳大利亚Anton Paar公司;SP2傅立叶变换红外吸收光谱仪,美国PE公司;TM 3000扫描电镜,日本Hitachi公司。
1.3 试验方法
1.3.1 藜麦分离蛋白的制备 参考YANG等[16]的方法从藜麦粉中提取藜麦分离蛋白(QPI),并进行适当的修改。将脱脂藜麦粉以1﹕10的比例悬浮于纯水中,使用1 mol∙L-1的NaOH溶液调节pH至8.5,在25 ℃下搅拌2 h。将悬浮液在4 ℃下以10 000×离心15 min,获得上清液。随后使用1 mol∙L-1HCl溶液将上清液的pH调节至4.5以沉淀蛋白质。将混合物在4 ℃下10 000×离心15 min以回收沉淀的蛋白质。然后将沉淀分散于Milli-Q水中,并在搅拌下用1 mol∙L-1NaOH溶液中和至pH 7.0。将QPI溶液在-80 ℃下冷冻12 h,然后冻干,将冻干粉研磨成粉末。获得的QPI通过凯氏定氮法测得蛋白含量为89.83%,其中脂肪含量≤3.4%,灰分含量≤1.6%。储存在4 ℃冰箱中,以备进一步使用。
1.3.2 藜麦蛋白凝胶的制备 采用冻干粉制备冻干粉含量为20 mg∙mL-1的QPI溶液(pH 7.0),水化3 h。分别加入不同类型的盐离子:NaCl(50 mmol∙L-1)、CaCl2(50 mmol∙L-1)、CaSO4(50 mmol∙L-1)、MgCl2(50 mmol∙L-1)并搅拌均匀。吸取10 mL溶液放入25 mL烧杯中,封口以避免加热时水分蒸发。随后将其放入水浴锅中90 ℃加热30 min,取出冷却至室温。在4 ℃冰箱储存,用于后续的表征。
1.3.3 藜麦分离蛋白凝胶质构测定 参考NIE等[18]方法并修改,对凝胶样品进行质构测定,使用探头型号为P/36,参数设定为:测试前速率为1.0 mm∙s-1,测试速率为1.0 mm∙s-1,测试后速率为1.0 mm∙s-1,探头深入距离为5 mm,触发力为5 g。所有测试在室温下独立重复3次,并表示为平均值±标准差。
1.3.4 持水力测定 参考CHEN等[19]的方法,将5 g凝胶样品中以8 000 r/min在4 ℃下离心10 min,然后将上清液倒出。在离心前、后记录离心管和凝胶的重量。WHC(%)的计算公式如下:

式中,W1:离心管的重量(g),W2:离心前离心管和凝胶的重量(g),W3:离心后离心管和凝胶的重量(g)。
1.3.5 色差分析 QPI凝胶测试参考冯潇等[20]的方法。将储存的凝胶在室温下静置1 h进行白度测定,首先将不同的凝胶样品切成直径2 cm、高1.5 cm的圆柱形凝胶,然后使用色差仪测定凝胶样品的L*、a*和b*值。L*值表示亮度,a*值表示红绿色,b*表示黄蓝色,所有样品独立重复测定3次,结果取平均值。白度(W)计算公式如下:
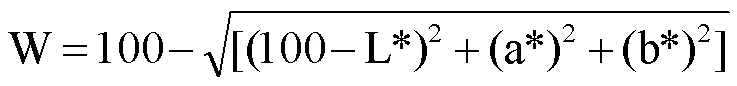
1.3.6 凝胶内分子间作用力 参考LI等[21]和ZHENG等[22]的方法,将凝胶样品(1 g)溶于10 mL不同溶液中:溶液S1(0.6 mol∙L-1NaCl,pH 7.0)、溶液S2(0.6 mol∙L-1NaCl、1.5 mol∙L-1尿素)、溶液S3(0.6 mol∙L-1NaCl、8 mol∙L-1尿素)、溶液S4(0.6 mol∙L-1NaCl、8 mol∙L-1尿素、0.5 mol∙L-1-巯基乙醇)。将混合物搅拌1 h,并在4 ℃下以10 000 r/min离心30 min。使用Bradford法测定上清液中的蛋白质含量,以BSA为标准。测量S1、S2、S3和S4的溶解度,其中S1、(S2-S1)、(S3-S2)、(S4-S3)分别代表静电相互作用、氢键、疏水相互作用和二硫键。
1.3.7 凝胶的水分分布 凝胶的水分分布状态主要通过低场核磁共振的横向弛豫时间T2表示[23],将1 g不同的藜麦蛋白凝胶装入核磁管中,采用低场NMR弛豫测定凝胶样品的横向弛豫时间T2。质子共振频率为19 MHz,温度为(32±0.01)℃,采样频率为100 kHz,重复扫描次数为8,每组样品重复3次,取平均值。采用仪器自带的软件进行反演得到T2图谱。
1.3.8 流变特性分析 参考YANG等[16]的方法并稍加修改,采用配备平行板(直径40 mm、间隙1 mm)的流变仪。分析不同制备方法和不同盐离子浓度的藜麦蛋白凝胶的流变特性。将QPI粉末分散在超纯水中制备QPI溶液(200 mg∙mL-1),并使用1 mol∙L-1HCl或1 mol∙L-1NaOH溶液调节至pH 7.0。25 ℃搅拌2 h后放入4 ℃冰箱过夜,使蛋白质充分水合。按照上述1.3节制备方法,制备出含有不同盐离子的溶液。再用磁力搅拌器搅拌2 h。用塑料滴管将QPI溶液转移到平板上。并在样品边缘滴入硅油以防止蒸发。流变测量采用以下方案进行:通过将样品在5 ℃∙min-1下从20 ℃加热到90 ℃,在90 ℃下保持30 min,并在5 ℃∙min-1下冷却至25 ℃进行温度扫描。在此步骤中,频率和应变幅度分别保持在1 Hz和1%,以监测凝胶形成。
1.3.9 凝胶的微观结构 将不同的凝胶样品切成薄片,将凝胶样品放在磷酸盐缓冲液(0.1 mmol∙L-1)中配制的2.5%戊二醛溶液(pH 6.8)中固定24 h,再用相同浓度的磷酸盐缓冲液漂洗3次,每次漂洗15 min。然后分别使用50%—100%的乙醇溶液进行梯度脱水,每次脱水15 min,再用无水乙醇溶液对凝胶样品脱水3次,每次脱水15 min。将脱水好的凝胶样品放入-80 ℃冰箱预冻,之后冻干、喷金。最后在20 kV电压下使用扫描电镜观察凝胶样品的表面结构状态并进行拍照[24-25]。
1.3.10 凝胶的二级结构 通过傅里叶红外光谱仪(FTIR)测定冻干凝胶的二级结构。将冻干凝胶样品与溴化钾以1﹕100(w/w)的比例完全混合,研磨后压片。光谱采集范围为4 000—400 cm-1,分辨率为4 cm-1,进行64次扫描[26]。
2 结果
2.1 质构分析
从图1可以看出,无离子添加的藜麦蛋白凝胶硬度最高,无论是一价阳离子还是二价阳离子的添加都会使藜麦蛋白凝胶的硬度降低,且二价盐离子对凝胶硬度的降低比一价盐离子更明显。但是,盐离子的加入不同程度地增加了凝胶的弹性。其中NaCl、CaSO4和MgCl2对弹性的增强更为显著。MgCl2显著增强了蛋白凝胶的黏聚性,其他盐离子对黏聚性的影响不显著。除CaSO4外,其他盐离子显著降低了蛋白凝胶的回复性(<0.05)。

不同小写字母表示差异显著(P<0.05)。下同 Different lowercase letters indicate significant difference (P<0.05). The same as below
2.2 持水力
图2显示添加NaCl的凝胶与对照组的持水力没有显著性差异,而二价盐离子的加入,降低了藜麦蛋白凝胶的持水力。添加钙离子(CaSO4、CaCl2)的凝胶与添加NaCl的凝胶持水力无显著差异。在离子添加的凝胶中,添加MgCl2的藜麦蛋白凝胶持水力从空白组的76.77%降低到65.92%。
2.3 水分分布
每个样品的弛豫时间曲线上有3个峰,这表明凝胶中存在3种水,分别是结合水(1—10 ms)、不易流动水(100—200 ms)和自由水(1 000—4 500 ms)。从图3可以看出,NaCl对QPI凝胶的水分分布相比于对照组没有显著影响。添加CaCl2和CaSO4组的凝胶其结合水含量明显增加,添加MgCl2显著降低了凝胶中结合水的含量,添加NaCl、CaCl2和CaSO4的凝胶不易流动水含量无显著性差异,而加入MgCl2显著降低了藜麦蛋白凝胶不易流动水的含量,并增加了自由水的含量。

图2 不同盐离子添加对藜麦蛋白凝胶持水力的影响

图3 添加不同盐离子QPI凝胶的低频-核磁共振图谱(A)及凝胶水分分布(B)
2.4 色差分析
由表1可以看出,NaCl对所制备的藜麦蛋白凝胶颜色相较于对照组没有显著的影响。添加CaCl2、CaSO4和MgCl2显著增加了凝胶的L*(亮度)和a*(红绿值)。不同的盐离子对凝胶的b*(黄蓝值)无显著影响。二价阳离子都不同程度上提高了蛋白凝胶的白度和亮度。CaCl2对凝胶白度的提升最明显。
2.5 分子间作用力
如图4所示,盐离子对凝胶内部的氢键没有显著影响,添加二价盐离子降低了藜麦蛋白凝胶的静电相互作用。不同盐离子显著影响凝胶的二硫键含量,NaCl的加入使凝胶相比于对照组的二硫键含量显著降低。同时,添加二价盐离子(CaCl2、CaSO4、MgCl2)比添加NaCl更为显著地降低了二硫键的含量,其断裂二硫键测得的可溶性蛋白含量从对照组的3.20 mg∙mL-1分别降低到1.91、1.85和1.87 mg∙mL-1。因此,盐离子主要通过影响凝胶内二硫键的交联及氢键作用而影响藜麦蛋白的凝胶特性。

表1 不同盐离子对QPI凝胶色差的影响

图4 添加不同盐离子对QPI凝胶内分子间作用力的影响
2.6 凝胶的外观及微观结构
从图5可以看出,所有制备的凝胶均呈现为不透明的白色凝胶,制备的凝胶均为典型的颗粒状聚集凝胶。微观结构中,未添加盐离子的凝胶结构空隙更小,分布更均匀。加入NaCl后,凝胶的微观结构出现缝隙;加入CaCl2后,盐离子的屏蔽效应促使蛋白聚集,从而使凝胶的微观结构变得更粗糙,比加入NaCl出现更多的孔洞结构。综上,添加二价盐离子使凝胶的微观结构变得更粗糙。
2.7 流变性质
图6显示,在初始低温阶段,未添加盐离子的藜麦蛋白溶液储能模量(G')和损耗模量(G'')均小于有盐离子添加的溶液,对照组和添加NaCl组在初始温度较低时的G''均大于G',在后续加热过程中G'急剧上升。添加二价盐离子组则在初始阶段G''和G'基本一致,加热结束时,G'均大于G'',说明均形成了以弹性为主的凝胶。恒温过程中,所有凝胶的储能模量G'缓慢增加,而在最后的冷却阶段G'再次显著上升。温度扫描结束时,空白组藜麦蛋白凝胶的G'最高,其次为添加NaCl的凝胶。最低的是添加二价盐离子所制备的凝胶,与质构分析结果一致。

图5 不同盐离子对QPI凝胶外观和微观结构的影响
2.8 二级结构
蛋白质二级结构由其酰胺一区(1 600—1 700 cm-1)的特定区域确定,酰胺一区的不同区域被分配到特定的蛋白质二级结构[27]:-折叠(1 615— 1 637 cm-1、1 682—1 700 cm-1),-螺旋(1 646— 1 661 cm-1),-转角(1 664—1 681 cm-1)和无规则卷曲(1 637—1 648 cm-1)。图7为添加不同盐离子藜麦蛋白凝胶的红外图谱,二级结构的量化结果见表2。从表2可以看出,凝胶中-折叠和-转角结构所占的比例较高。随着盐离子的加入,-折叠和-转角含量降低,-螺旋结构和无规则卷曲结构含量增加。

图6 添加不同盐离子的QPI溶液在温度扫描分析中G'和G''的变化

图7 不同QPI凝胶的红外图谱

表2 不同盐离子对QPI凝胶二级结构的影响
3 讨论
3.1 不同盐离子影响藜麦蛋白凝胶的质构、外观、颜色和流变特性
凝胶硬度主要与参与网络结构形成的蛋白数量和形成网络结构的作用力有关。在凝胶制备过程中,适量盐离子的添加能够减弱分子间斥力作用,有利于蛋白分子间的交联,促进凝胶的形成;而当盐离子浓度较高时,蛋白质会因静电屏蔽而发生随机聚集,且蛋白质变性温度会随着盐浓度的增加而提高,使蛋白质在同样加热条件下变性和展开程度降低,从而使部分蛋白未参与凝胶网络的形成,降低凝胶的硬度[28]。
由于藜麦蛋白中主要的蛋白组分是11S球蛋白和2S清蛋白,7S球蛋白在藜麦蛋白中的含量极少(1.73%),11S球蛋白在藜麦蛋白热凝胶中发挥着主要的凝胶作用[29]。不同于大豆分离蛋白,藜麦分离蛋白的变性温度较高,根据基因型不同,开始变性温度(T0)为92 ℃,变性温度(Td)约为98 ℃[29]。在球蛋白的热诱导凝胶中,变性被认为是凝胶的先决条件[30]。90 ℃加热时,QPI部分发生变性,在不添加盐离子时,部分变性的QPI参与凝胶网络结构的形成;而加入盐离子后,QPI的变性温度升高,则在相同加热条件下参与凝胶网络结构的变性QPI减少,因而凝胶硬度随着盐离子的添加而减小。这与KASPCHAK等[17]的研究类似,藜麦蛋白在pH 7.0时,其G′随着NaCl浓度(0—300 mmol∙L-1)的升高而降低。
凝胶的外观被认为是所形成网络类型的良好指标。具有有序结构(纤维状聚集)形成的凝胶是半透明的,而由颗粒聚集形成的凝胶由于颗粒聚集更大且聚集更随机而呈现不透明的状态[31]。这种微观结构特征直接影响凝胶的持水能力,颗粒聚集的凝胶持水力较低。表明高浓度的二价离子诱导了粗糙的颗粒凝胶结构的形成,因此,添加二价盐离子的凝胶持水力较低。
流变可以模拟蛋白加热凝胶过程,在初始升温阶段所有样品的G′都表现出先下降的趋势,这可能与低温下弱蛋白质网络结构有关[15-16]。G′达到1 Pa的温度或G′和G″值相交叉时的温度为蛋白的凝胶形成温度,定义为凝胶温度Tgel[32]。在升温过程中,NaCl的加入使凝胶温度降低,大豆和蚕豆蛋白中也有发现相似的趋势[33-34]。而在降温阶段,所有样品的G′和G″都表现出了上升趋势,这可以归因于冷却阶段氢键的作用。本研究结果表明,未添加盐离子的最终储能模量G′最高,盐离子的加入在不同程度上对凝胶产生了不利的影响。这与YANG等[16]的研究相反,YANG等[16]通过研究NaCl、CaCl2对10%藜麦蛋白溶液流变特性的影响,发现盐离子提高了凝胶的储能模量。可能的原因是在低浓度的蛋白溶液中,盐离子的加入促进蛋白的聚集以及蛋白与蛋白之间的相互作用,导致凝胶强度的增强。而本研究采用的藜麦蛋白浓度为20%,蛋白溶液中的蛋白分子相互接触更加密集,盐离子的加入使溶液中的蛋白过度聚集,从而降低了加热过程中蛋白质的展开,导致蛋白-蛋白的相互作用减弱,反而降低了其凝胶强度。本研究结果与KASPCHAK等[17]的研究一致,在pH 7.0时,加入CaCl2(55 mmol∙L-1)和MgCl2(55 mmol∙L-1)的QPI凝胶强度均小于未添加离子的凝胶。
3.2 不同盐离子影响藜麦蛋白凝胶水分分布、持水力
凝胶的持水力主要与凝胶网络结构以及蛋白与水分子间的作用力有关,未添加盐离子的藜麦蛋白变性温度更低,蛋白内部基团暴露相对更充分,因此凝胶内部网络相互作用更强。添加盐离子使藜麦蛋白变性温度增高,增强了蛋白的热稳定性,使蛋白内部基团暴露相对减少,从而降低了凝胶内部蛋白的相互作用,导致凝胶的持水力较低[35]。添加盐离子使蛋白聚集速度加快,凝胶化温度降低,形成了较不均匀和粗糙的网络结构,导致持水力的降低。PEYRANO等[36]研究了钙离子浓度(0—40 mmol∙L-1)对豇豆蛋白的影响,也表明高浓度钙离子的加入,加速了蛋白聚集,导致形成不均匀结构的颗粒凝胶持水力显著降低。
3.3 不同盐离子影响藜麦蛋白凝胶分子间作用力和二级结构
凝胶的分子间作用力由二硫键占据主导地位,其中二硫键是促进凝胶化的关键分子间作用力[25]。二硫键和疏水相互作用维持凝胶中蛋白-蛋白相互作用,静电相互作用和氢键维持凝胶中蛋白-水之间的相互作用[37]。静电相互作用的降低表明凝胶中蛋白-水之间的相互作用减弱,与持水力的结果一致(图2)。不同盐离子的加入在不同程度上降低了最终凝胶中二硫键的含量,加入二价盐离子使二硫键的降低更为显著,盐离子主要通过影响凝胶中二硫键的含量进而影响QPI的凝胶性能,与质构测定结果一致(图1)。盐离子导致二硫键含量降低的原因可能是盐离子影响QPI在加热过程中的聚集行为,加入盐离子后,静电屏蔽效应导致蛋白的聚集,从而使加热过程中蛋白展开不充分,使凝胶中蛋白-蛋白相互作用减少。与此同时,盐离子的加入使蛋白的变性温度升高,同等加热条件下降低了蛋白质的展开程度,导致巯基的暴露减少,二硫键含量降低。
-折叠对于凝胶网络和蛋白-蛋白之间的相互作用具有重要影响,因为-折叠结构具有相对更大的表面积用于形成有序氢键[38]。随着盐离子的添加,QPI凝胶的-折叠含量出现降低[39]。这与QPI凝胶的硬度(图1)和持水力下降(图2)一致。YAO等[40]研究海藻酸钠对肌原纤维蛋白凝胶的影响也表明了-折叠结构与持水力的正相关关系。无规则卷曲结构属于不规则结构,不利于有序凝胶结构的形成[37]。本研究中盐离子的加入引起QPI凝胶无规则卷曲结构的上升与SEM中凝胶结构更粗糙的结果一致[38]。
4 结论
盐离子通过调控藜麦蛋白的聚集行为及蛋白质的变性温度,影响藜麦蛋白在加热凝胶过程中的展开程度、蛋白间的分子间相互作用及凝胶内的水分分布,从而使凝胶的蛋白质二级结构从有序向无序转变,且凝胶的微观网络结构变得疏松及不均匀,降低了藜麦蛋白凝胶的硬度、回复性及持水力,增强了凝胶的弹性和黏聚性。本研究结果可为藜麦蛋白加工提供理论参考,生产中可根据不同的加工需求选择适合的盐离子。
[1] CEYHUN SEZGIN A, SANLIER N. A new generation plant for the conventional cuisine: Quinoa (Willd.). Trends in Food Science & Technology, 2019, 86: 51-58.
[2] 王龙飞, 王新伟, 赵仁勇. 藜麦蛋白的特点、性质及提取的研究进展. 食品工业, 2017, 38(7): 255-258.
WANG L F, WANG X W, ZHAO R Y. Research progress on characteristics, properties and extraction of quinoa protein. The Food Industry, 2017, 38(7): 255-258. (in Chinese)
[3] STEFFOLANI M E, VILLACORTA P, MORALES-SORIANO E R, REPO-CARRASCO R, LEÓN A E, PÉREZ G T. Physicochemical and functional characterization of protein isolated from different quinoa varieties (Willd.). Cereal Chemistry, 2016, 93(3): 275-281.
[4] NAVARRO-LISBOA R, HERRERA C, ZÚÑIGA R N, ENRIONE J, GUZMÁN F, MATIACEVICH S, ASTUDILLO-CASTRO C. Quinoa proteins (Willd.) fractionated by ultrafiltration using ceramic membranes: The role of pH on physicochemical and conformational properties. Food and Bioproducts Processing, 2017, 102: 20-30.
[5] 吉静筠, 李洪岩, 王静. 藜麦蛋白功能特性研究进展. 中国食品学报, 2021, 21(11): 368-376.
JI J Y, LI H Y, WANG J. Research progress on the functional properties of quinoa protein. Journal of Chinese Institute of Food Science and Technology, 2021, 21(11): 368-376. (in Chinese)
[6] BOHRER B M. An investigation of the formulation and nutritional composition of modern meat analogue products. Food Science and Human Wellness, 2019, 8(4): 320-329.
[7] DAKHILI S, ABDOLALIZADEH L, HOSSEINI S M, SHOJAEE- ALIABADI S, MIRMOGHTADAIE L. Quinoa protein: composition, structure and functional properties. Food Chemistry, 2019, 299: 125161.
[8] TARONE A G, FASOLIN L H, DE ASSIS PERRECHIL F, HUBINGER M D, DA CUNHA R L. Influence of drying conditions on the gelling properties of the 7S and 11S soy protein fractions. Food and Bioproducts Processing, 2013, 91(2): 111-120.
[9] 朱秀清, 邓筱琪, 朱颖, 王喜泉, 李玉玲, 夏晓雨. 大豆蛋白凝胶制备及其影响因素的研究进展. 食品工业科技, 2023, 44(6): 405-414.
ZHU X Q, DENG X Q, ZHU Y, WANG X Q, LI Y L, XIA X Y. Advances in the gel preparation and its affecting factors of soybean protein. Science and Technology of Food Industry, 2023, 44(6): 405-414. (in Chinese)
[10] 苏巧艳. 微波处理对藜麦蛋白功能特性的影响. 食品工程, 2021(2): 33-37.
SU Q Y. Effect of microwave teatment on functional properties of quinoa protein. Food Engineering, 2021(2): 33-37. (in Chinese)
[11] RUIZ G A, XIAO W K, VAN BOEKEL M, MINOR M, STIEGER M. Effect of extraction pH on heat-induced aggregation, gelation and microstructure of protein isolate from quinoa (Willd). Food Chemistry, 2016, 209: 203-210.
[12] LUO L, CHENG L R, ZHANG R J, YANG Z. Impact of high-pressure homogenization on physico-chemical, structural, and rheological properties of quinoa protein isolates. Food Structure, 2022, 32: 100265.
[13] WANG X Y, CHENG L R, WANG H F, YANG Z. Limited Alcalase hydrolysis improves the thermally-induced gelation of quinoa protein isolate (QPI) dispersions. Current Research in Food Science, 2022, 5: 2061-2069.
[14] SHEN Y T, TANG X, LI Y H. Drying methods affect physicochemical and functional properties of quinoa protein isolate. Food Chemistry, 2021, 339: 127823.
[15] HUANG K, SHI J R, LI M Y, SUN R L, GUAN W W, CAO H W, GUAN X, ZHANG Y. Intervention of microwave irradiation on structure and quality characteristics of quinoa protein aggregates. Food Hydrocolloids, 2022, 130: 107677.
[16] YANG Z, DE CAMPO L, GILBERT E P, KNOTT R, CHENG L R, STORER B, LIN X L, LUO L, PATOLE S, HEMAR Y. Effect of NaCl and CaCl2concentration on the rheological and structural characteristics of thermally-induced quinoa protein gels. Food Hydrocolloids, 2022, 124: 107350.
[17] KASPCHAK E, DE OLIVEIRA M A S, SIMAS F F, FRANCO C R C, SILVEIRA J L M, MAFRA M R, IGARASHI-MAFRA L. Determination of heat-set gelation capacity of a quinoa protein isolate () by dynamic oscillatory rheological analysis. Food Chemistry, 2017, 232: 263-271.
[18] NIE Y Q, LIU Y F, JIANG J, XIONG Y L, ZHAO X Z. Rheological, structural, and water-immobilizing properties of mung bean protein-based fermentation-induced gels: Effect of pH-shifting and oil imbedment. Food Hydrocolloids, 2022, 129: 107607.
[19] CHEN Y, WANG T, ZHANG Y F, YANG X R, DU J, YU D Y, XIE F Y. Effect of moderate electric fields on the structural and gelation properties of pea protein isolate. Innovative Food Science & Emerging Technologies, 2022, 77: 102959.
[20] 冯潇, 张帆, 陈颖, 成佳欣, 岑凯悦, 汤晓智. 藜麦蛋白Pickering乳液添加对鱼糜蛋白凝胶冻融稳定性的影响. 中国农业科学, 2022, 55(10): 2038-2046. doi: 10.3864/j.issn.0578-1752.2022.10.013.
FENG X, ZHANG F, CHEN Y, CHENG J X, CEN K Y, TANG X Z. Effects of adding quinoa protein Pickering emulsion on freeze-thaw stability of fish surimi gel. Scientia Agricultura Sinica, 2022, 55(10): 2038-2046. doi: 10.3864/j.issn.0578-1752.2022.10.013. (in Chinese)
[21] LI N N, YANG M, GUO Y H, TONG L T, WANG Y Q, ZHANG S, WANG L L, FAN B, WANG F Z, LIU L Y. Physicochemical properties of different pea proteins in relation to their gelation ability to form lactic acid bacteria induced yogurt gel. LWT-Food Science and Technology, 2022, 161: 113381.
[22] ZHENG L, WANG Z J, KONG Y, MA Z L, WU C L, REGENSTEIN J M, TENG F, LI Y. Different commercial soy protein isolates and the characteristics of Chiba tofu. Food Hydrocolloids, 2021, 110: 106115.
[23] 韩柯颖, 冯潇, 杨玉玲, 李珊珊, 魏苏萌, 陈玉敏. 添加山茶油对肌原纤维蛋白凝胶特性的影响. 中国农业科学, 2021, 54(20): 4446-4455. doi: 10.3864/j.issn.0578-1752.2021.20.017.
HAN K Y, FENG X, YANG Y L, LI S S, WEI S M, CHEN Y M. Effects ofoil on the properties of myofibrillar protein gel. Scientia Agricultura Sinica, 2021, 54(20): 4446-4455. doi: 10.3864/ j.issn.0578-1752.2021.20.017. (in Chinese)
[24] LÜ Y Q, XU L L, SU Y J, CHANG C H, GU L P, YANG Y J, LI J H. Effect of soybean protein isolate and egg white mixture on gelation of chicken myofibrillar proteins under salt /-free conditions. LWT-Food Science and Technology, 2021, 149: 111871.
[25] FENG X C, CHEN L, LEI N, WANG S X, XU X L, ZHOU G H, LI Z X. Emulsifying properties of oxidatively stressed myofibrillar protein emulsion gels prepared with (–)-epigallocatechin-3-gallate and NaCl. Journal of Agricultural and Food Chemistry, 2017, 65(13): 2816-2826.
[26] AI M M, ZHOU Q, GUO S G, LING Z T, ZHOU L D, FAN H, CAO Y Y, JIANG A M. Effects of tea polyphenol and Ca(OH)2on the intermolecular forces and mechanical, rheological, and microstructural characteristics of duck egg white gel. Food Hydrocolloids, 2019, 94: 11-19.
[27] KONG J L, YU S N. Fourier transform infrared spectroscopic analysis of protein secondary structures. Acta Biochimica et Biophysica Sinica, 2007, 39(8): 549-559.
[28] 吴超. 大豆蛋白凝胶结构与非网络蛋白扩散行为或网络蛋白性质关系的研究[D]. 无锡: 江南大学, 2017.
WU C. Study on the relationship between the gel structure of soybean protein and the diffusion behavior of non-network protein or the properties of network protein [D]. Wuxi: Jiangnan University, 2017. (in Chinese)
[29] VAN DE VONDEL J, LAMBRECHT M A, DELCOUR J A. Osborne extractability and chromatographic separation of protein from quinoa (Willd.) wholemeal. LWT-Food Science and Technology, 2020, 126: 109321.
[30] RENKEMA J M S, GRUPPEN H, VAN VLIET T. Influence of pH and ionic strength on heat-induced formation and rheological properties of soy protein gels in relation to denaturation and their protein compositions. Journal of Agricultural and Food Chemistry, 2002, 50(21): 6064-6071.
[31] ZHENG L, TENG F, WANG N, ZHANG X N, REGENSTEIN J, LIU J S, LI Y, WANG Z J. Addition of salt ions before spraying improves heat- and cold-induced gel properties of soy protein isolate (SPI). Applied Sciences, 2019, 9(6): 1076.
[32] RENKEMA J M S, KNABBEN J H M, VAN VLIET T. Gel formation by β-conglycinin and glycinin and their mixtures. Food Hydrocolloids, 2001, 15(4/5/6): 407-414.
[33] CHEN N N, ZHAO M M, CHASSENIEUX C, NICOLAI T. The effect of adding NaCl on thermal aggregation and gelation of soy protein isolate. Food Hydrocolloids, 2017, 70: 88-95.
[34] LANGTON M, EHSANZAMIR S, KARKEHABADI S, FENG X M, JOHANSSON M, JOHANSSON D P. Gelation of faba bean proteins - Effect of extraction method, pH and NaCl. Food Hydrocolloids, 2020, 103: 105622.
[35] ZHANG J H, JIANG L, YANG J, CHEN X X, SHEN M Y, YU Q, CHEN Y, XIE J H. Effect of calcium chloride on heat-inducedpolysaccharide-whey protein isolation gels: Gel properties and interactions. LWT-Food Science and Technology, 2022, 155: 112907.
[36] PEYRANO F, DE LAMBALLERIE M, AVANZA M V, SPERONI F. High hydrostatic pressure- or heat-induced gelation of cowpea proteins at low protein content: Effect of calcium concentration. Food Hydrocolloids, 2022, 124: 107220.
[37] LÜ Y Q, XU L L, TANG T T, LI J H, GU L P, CHANG C H, ZHANG M, YANG Y J, SU Y J. Gel properties of soy protein isolate-potato protein-egg white composite gel: Study on rheological properties, microstructure, and digestibility. Food Hydrocolloids, 2023, 135: 108223.
[38] GUO M H, LIU S C, ISMAIL M, FARID M M, JI H W, MAO W J, GAO J, LI C Y. Changes in the myosin secondary structure and shrimp surimi gel strength induced by dense phase carbon dioxide. Food Chemistry, 2017, 227: 219-226.
[39] PENG Y, KYRIAKOPOULOU K, KEPPLER J K, VENEMA P, VAN DER GOOT A J. Effect of calcium enrichment on the composition, conformation, and functional properties of soy protein. Food Hydrocolloids, 2022, 123: 107191.
[40] YAO J, ZHOU Y, CHEN X, MA F, LI P J, CHEN C G. Effect of sodium alginate with three molecular weight forms on the water holding capacity of chicken breast myosin gel. Food Chemistry, 2018, 239: 1134-1142.
Effects of Different Salt Ions on the Gel Properties and Molecular Interactions of Quinoa Protein
FENG Xiao, WU ChaoSheng, YANG YuLing, FU LiXiao, CHEN LongWei, TANG XiaoZhi
College of Food Science and Engineering, Nanjing University of Finance and Economics/Collaborative Innovation Center for Modern Grain Circulation and Safety/Key Laboratory for Quality Safety Control and Deep Processing of Cereals and Oils, Nanjing 210023
【Objective】This research studied the effects of different salt ions on the gel properties of quinoa protein, and explored its molecular mechanisms, so as to provide a theoretical basis for the processing of quinoa protein gels. 【Method】Quinoa protein was extracted by alkali extraction and acid precipitation. Quinoa protein solution (20%, w/v) was prepared at pH 7.0. NaCl, CaCl2, CaSO4and MgCl2was added in quinoa protein solution till the concentration was 50 mmol∙L-1, and then the solution was heated in a water bath to prepare quinoa protein gels. The effects of salt ions on the texture, water retention, color properties and water distribution of quinoa protein gels were analyzed. Meanwhile, the effects of salt ions on the microstructure and rheological properties of quinoa protein gels were studied by scanning electron microscopy and rheometer. The effects of salt ions on the molecular interactions and secondary structure of protein gels were also analyzed. 【Result】The addition of salt ions significantly decreased the hardness and water holding capacity, while increased the springiness of quinoa protein gels under pH 7.0. Quinoa protein gels with MgCl2showed the lowest hardness and water holding capacity. NaCl addition had no significant influence on the color properties of protein gels. However, the addition of bivalent salt ions significantly improved the lightness and whiteness of quinoa protein gels, and their whiteness increased from 59.62 to 67.80 with the addition of CaCl2. Furthermore, the addition of salt ions promoted granular aggregation of quinoa protein, which made the gel network structure become coarse. Coarse and larger gaps were observed in the microstructure of quinoa protein gels when divalent salt ions were added. Meanwhile, compared with blank gels and gels added with NaCl, the addition of divalent salt ions significantly decreased the content of disulfide bond, and weakened the electrostatic interactions within quinoa protein gels. Furthermore, the addition of salt ions decreased the contents of-sheets and-turns, increased the contents of-helix and random coil, which affected the orderliness of protein secondary structure. 【Conclusion】 Under neutral conditions, the gel properties of quinoa protein and microstructure of gels were affected by the presence of different salt ions to various degrees. Compared with the gel prepared with NaCl, quinoa protein gels with the same concentration of CaCl2, CaSO4, and MgCl2showed rougher microstructure, lower gel hardness and water holding capacity, as divalent salt ions significantly decreased the disulfide bond content and weakened the electrostatic interactions within quinoa protein gels.
quinoa protein isolate; protein gels; secondary structure; water distribution; molecular interaction

2023-02-06;
2023-08-18
国家自然科学基金(32001643,32372380)、江苏省自然科学基金(BK20200831)、江苏高校优势学科建设工程资助项目(PAPD)
冯潇,E-mail:fengxiao@nufe.edu.cn。武朝升,E-mail:wuchaosheng3@163.com。冯潇和武朝升为同等贡献作者。通信作者汤晓智,E-mail:9120111004@nufe.edu.cn
(责任编辑 赵伶俐)
