沙地葡萄茎痘相关病毒在‘阳光玫瑰’葡萄树不同物候期和不同部位的变化规律
2023-11-18李美璇张向昆王莉乔月莲师校欣杜国强
李美璇,张向昆,王莉,乔月莲,师校欣,杜国强
沙地葡萄茎痘相关病毒在‘阳光玫瑰’葡萄树不同物候期和不同部位的变化规律
李美璇,张向昆,王莉,乔月莲,师校欣,杜国强
河北农业大学园艺学院,河北保定 071000
【背景】沙地葡萄茎痘相关病毒(grapevine rupestris stem pitting associated virus,GRSPaV)是皱木复合病中最常见的一种病毒,主要通过无性繁殖传播,灵敏的检测技术和培育无病毒植株是预防GRSPaV危害的关键。【目的】建立GRSPaV检测体系,确定适宜样品采集时期及部位,为病毒检测和无病毒材料培育及样品采集提供参考。【方法】建立基于AugeGreen染料法和外壳蛋白(coat protein,CP)基因区域设计引物的RT-qPCR检测方法,对携带GRSPaV的‘阳光玫瑰’葡萄树地上部不同物候期、不同部位的样品进行GRSPaV检出率及基因表达量分析。【结果】以GRS q CP1为引物的GRSPaV RT-qPCR检测方法灵敏度较RT-PCR高10倍。GRSPaV在萌芽期、新梢生长期和花期的检出率均为100%,果实膨大期为91.7%;成熟卷须为94.4%,成龄叶片、成龄叶柄和幼嫩枝条均为100%。检测为阴性的样品均为幼嫩部位。GRSPaV CP基因表达量在花期幼嫩卷须中最高,其次为花期成龄叶片;成龄叶中表达量在果实膨大期至成熟期均为同物候期内表达量最高部位;当年冬芽的萌芽期及二次枝的新梢生长期表达量均较低。【结论】‘阳光玫瑰’葡萄GRSPaV检出率和GRSPaV CP基因表达量随物候期进程表现差异,检出率在萌芽期至花期最高,果实成熟期最低;GRSPaV CP基因表达量在花期最高。综合检出率及表达量因素,花期成龄叶适合作为GRSPaV病毒检测样品;果实膨大期至成熟期当年冬芽及萌发的二次枝适合作为脱除病毒材料。
‘阳光玫瑰’葡萄;沙地葡萄茎痘相关病毒;实时荧光定量PCR;病毒检出率;基因表达量
0 引言
【研究意义】中国是世界上最大的鲜食葡萄生产和消费国[1]。据国家统计局统计,截至2019年,中国葡萄栽培总面积达到72.62万公顷,葡萄总产量1 419.54万吨;2021年葡萄总产量达到1 499.80万吨[2]。栽培上,由于葡萄以无性繁殖(嫁接和扦插)为主,造成病毒积累和重复感染,导致病毒病的发生愈发严重[3]。‘阳光玫瑰’葡萄自2007年引入中国后,因其优良的品质,栽培面积快速增加,逐渐形成规模[4]。然而因其亲本‘白南’极易感染病毒,导致该品种也易被病毒侵染[5],植株感病后易表现出叶片畸形、变小、褪绿斑驳等症状,严重影响光合作用,降低葡萄产量和品质[6]。因此,培育无病毒感染植株是预防危害的关键。通过病毒检测技术,了解树体地上部不同部位病毒动态分布变化可为培育无病毒感染植株提供材料。【前人研究进展】据报道,‘阳光玫瑰’葡萄受到11种病毒危害,其中,沙地葡萄茎痘相关病毒(grapevine rupestris stem pitting associated virus,GRSPaV)寄主范围仅限于葡萄,是在皱木复合病(rugose wood disease,RW)中最常见的一种病毒[7]。该病毒于1961年首次在意大利报道[8],在中国新疆于2004年首次由Ribeiro等[9]检出。葡萄树感染GRSPaV几年后,比健康的葡萄树矮小,严重时影响果实产量[8],有些受感染植株出现树势衰退现象,重者甚至死亡[10]。该病毒引起的主要症状是在茎上出现纵向凹槽和纹孔[10],但因为带毒植株的症状难以觉察,加上实际生产中嫁接技术的普遍应用,以及不同地区之间广泛交换繁殖材料,使GRSPaV传播范围更加广泛。GRSPaV主要通过无性繁殖传播,目前没有生物媒介传毒的报道[11],且感病植株无法使用化学药剂治愈[12],分生组织培养或热处理脱毒也难以从繁殖材料中脱除GRSPaV[13]。目前对于GRSPaV检测的研究主要集中于血清学和分子生物学方法,分子生物学方法精度高、灵敏度高,更适合实验室病毒检测[14-15]。通过分子生物学检测GRSPaV的方法主要有逆转录-聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)和实时荧光定量PCR(RT- qPCR)。Zhang等[8]建立了针对GRSPaV的RT-PCR特异性检测方法。Osman等[16]建立了TaqMan探针RT-qPCR(TaqMan®RT-PCR)检测RW的方法,并验证TaqMan®RT-PCR比RT-PCR更灵敏。Greig等[17]采用一步直接实时定量逆转录定量聚合酶链式反应(DRT-qPCR)方法对葡萄GRSPaV检测进行了优化,利用更节省时间与成本的直接植物提取缓冲液(DiPEB)系统进行总核酸提取,取代了商业试剂盒。Greig等[17]发现同一新梢上叶龄3—6周叶和>6周叶的Ct值始终较低,幼叶具有较高的Ct值,并且通常检测为阴性;同一片叶左、右半叶间Ct值无显著差异;新鲜和冷冻感染叶片的Ct值也没有显著差异;感染GRSPaV的葡萄树同一时期枝条刮取的形成层组织与叶片材料两组间Ct值无显著差异。Hu等[11]利用RT-qPCR检测技术发现对于感染GRSPaV的3个品种葡萄试管苗样品,基因表达量根部最高,其次为植株上部。Stewart等[18]利用RT-PCR检测技术发现除夏季在幼嫩新梢上采集的嫩芽外,在受感染植物的所有组织中均可检测到GRSPaV。【本研究切入点】RT-qPCR相较于RT-PCR、巢式PCR、RT-LAMP等一些检测方法更灵敏且稳定[19-21],应用DNA染料法进行RT-qPCR检测,以SYBR Green Ⅰ染料应用最广泛[22],而饱和染料AugeGreen荧光值高于SYBR Green Ⅰ染料,且性能佳、安全性好,同时相对TaqMan探针价格较低,便于在实验室操作[22],目前国内外未见针对GRSPaV建立的基于AugeGreen染料的检测方法报道。【拟解决的关键问题】采用AugeGreen染料法,建立一种针对GRSPaV的RT-qPCR检测方法,并利用该法对‘阳光玫瑰’葡萄树地上部不同部位、不同物候期GRSPaV基因表达量进行研究,为GRSPaV病毒检测及培育无病毒植株提供参考。
1 材料与方法
试验于2021—2022年在河北农业大学校内实验基地进行。
1.1 供试材料
以4年生自根‘阳光玫瑰’葡萄为试材,株行距3.0 m×3.0 m,南北行向,水平双臂龙干形整枝。
1.2 试验方法
1.2.1 GRSPaV RT-qPCR检测技术建立
1.2.1.1 总RNA提取及反转录 取携带GRSPaV的‘阳光玫瑰’葡萄树不同部位样品,总RNA提取使用全能型植物RNA提取试剂盒(DNase I)(CWBIO,Beijing,China)。使用EasyScript® One-Step gDNA Removal and cDNA Synthesis SuperMix反转录试剂盒(TRAN,Beijing,China)合成cDNA。合成产物于-20 ℃保存。
1.2.1.2 引物设计与合成 根据GenBank登录号AF026278的GRSPaV基因组序列,设计5对GRSPaV RT-qPCR引物(表1)。
通过RT-PCR及RT-qPCR对引物进行检出率、扩增效率比较与特异性检测。最终引物的PCR产物进行测序,在NCBI BLAST进行比对验证引物特异性。

表1 GRSPaV RT-qPCR引物序列
1.2.1.3 检测体系优化及验证 以阳性样品cDNA作为模板,设置退火温度范围为54.0—64.0 ℃,通过观察Ct值大小与荧光信号强度筛选出最适退火温度。在此退火温度下,设置引物浓度梯度为50、100、200、300、400和500 nmol·L-1,筛选引物最佳浓度。
将cDNA模板进行100—10-4的梯度稀释,分别进行RT-PCR和RT-qPCR检测,比较两种方法的灵敏度。
1.2.2 GRSPaV CP基因表达量的动态检测 选择携带GRSPaV长势相近的3株‘阳光玫瑰’葡萄树作为生物学重复,于休眠期、萌芽期、新梢生长期、花期、果实膨大期、果实转色期、果实成熟期以及落叶期采样。选择健壮新梢重截处理促使当年形成的冬芽萌发,于此类冬芽萌芽期、新梢生长期采样。
按时期采集休眠枝条、嫩芽、嫩叶片、嫩叶柄、成龄叶片、成龄叶柄、幼嫩卷须、成熟卷须、1—2片叶副梢、3—5片叶副梢、幼嫩新梢、木质化枝条。采样选取植株北、中、南部位,每样品6个重复并进行混样,共147个样品。其中成龄叶选取基部1—2片叶,嫩叶选取顶端3—5片叶,休眠期休眠枝条、落叶期幼嫩新梢和木质化新梢均取用韧皮部,1—2片叶副梢取用第1节位,3—5片叶副梢取用第2—3节位即1—2片叶副梢第1节位的生长后期。液氮速冻后于-80 ℃冰箱保存。
以水作为无模板对照,以Actin基因(NC_012010)作为相对GRSPaV定量的内参基因,进行RT-qPCR检测,3次重复。
1.3 数据处理
用2-ΔΔCT法计算病毒基因相对表达量,用Excel 2019进行数据整理,SigmaPlot制图,SPSS软件进行显著性分析。GRSPaV检出率(%)=阳性样品数/总样品数×100。
2 结果
2.1 GRSPaV RT-qPCR检测方法建立
2.1.1 引物筛选 提取9个感染GRSPaV的‘阳光玫瑰’葡萄树样品RNA,使用5对引物对样品进行RT-PCR检测,以水作为无模板对照。引物GRS q CP1与GRS q RdRp1扩增效果较好,9个阳性样品均检出目标条带,GRS q CP2和GRS q TGB两对引物检出率低,且条带不清晰。引物GRS q RdRp2无法扩增出目标条带。所有无模板对照均未产生条带(图1)。

M:DL2000;CK:无模板对照;1—9:携带GRSPaV的葡萄样品 CK: No template control; 1-9: Grape samples infected GRSPaV
将阳性样品的cDNA模板进行100—10-4的梯度稀释,使用引物GRS q CP1和GRS q RdRp1进行RT-qPCR扩增并构建标准曲线,结果表明两对引物扩增效率均较高,分别为102.7%和110.7%。GRS q RdRp1引物溶解曲线存在非特异性扩增,因此选择GRS q CP1作为检测引物。
对GRSPaV CP1扩增产物进行测序,获得的序列使用NCBI BLAST进行比对,结果均为GRSPaV的病毒分离物,且相似性最高达98.35%,证明扩增片段为GRSPaV的部分序列。
2.1.2 RT-qPCR反应体系优化及验证
2.1.2.1 退火温度及引物浓度筛选 将退火温度区间设置为54.0—64.0 ℃时,RT-qPCR扩增结果Ct值在22.72—30.02。当退火温度为54.0、54.7、56.0和57.9 ℃时,Ct值较低,范围在22.72—24.11。其中当温度为57.9 ℃时,曲线的相对荧光强度达到最高,因此,选择57.9 ℃作为GRS q CP1的最终退火温度(图2)。
退火温度57.9 ℃时,随着引物浓度降低,曲线Ct值逐渐增加。当引物浓度为400和500 nmol·L-1时,Ct值分别为23.83和23.37,均较低且差异小,相对荧光强度均较强,为避免高引物浓度产生非特异性扩增,选择扩增效果较好、引物浓度较低的400 nmol·L-1作为本试验最终引物浓度(图3)。
使用经过优化的RT-qPCR反应检测体系构建标准曲线,结果表明100—10-4倍样品稀释的扩增曲线呈梯度分布,决定系数较高(2=0.985),扩增效率较好(E=102.7%)(图4)。
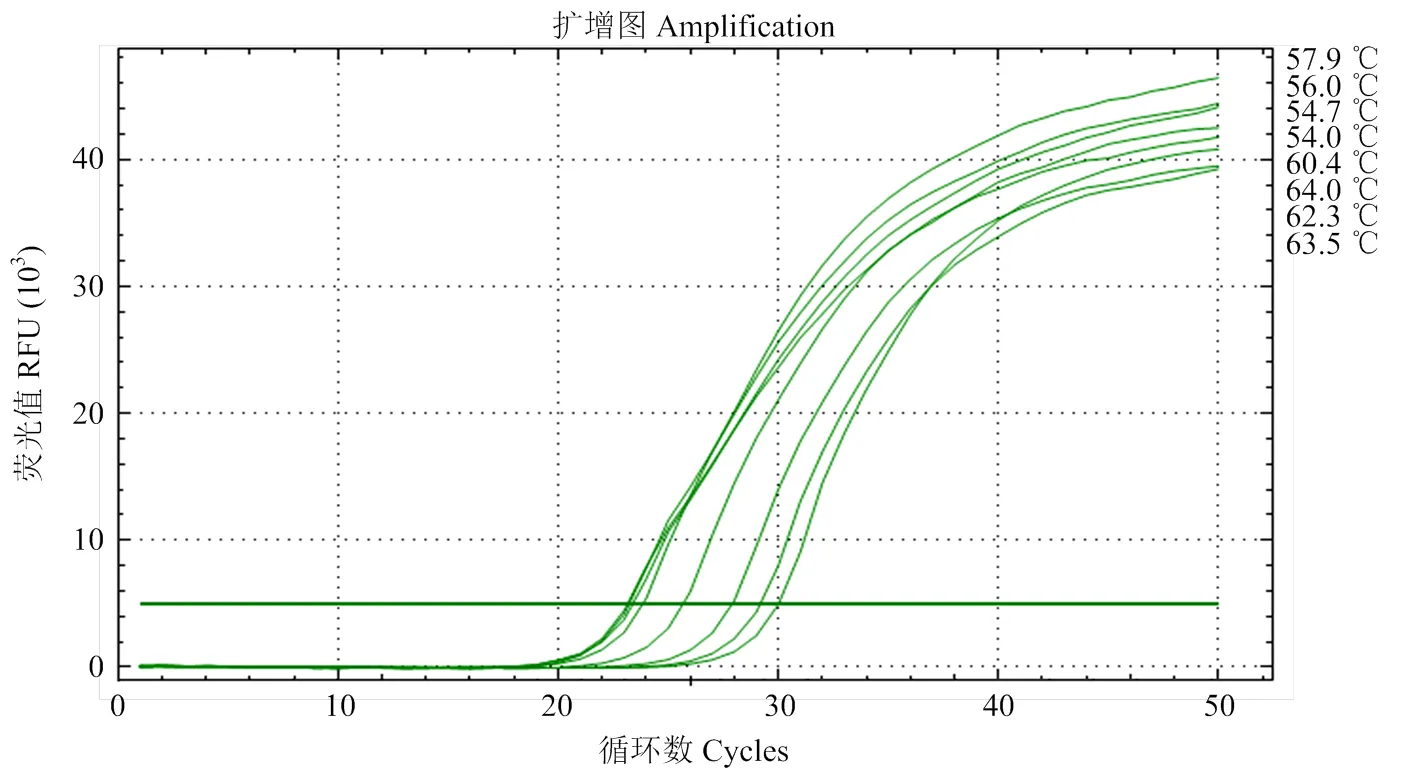
图2 不同退火温度下GRSPaV的RT-qPCR扩增结果

图4 GRSPaV引物GRS q CP1的标准曲线
2.1.2.2 灵敏度比较 梯度稀释的样品cDNA分别进行RT-PCR和RT-qPCR扩增,RT-qPCR可稳定检测到稀释10-3倍的GRSPaV阳性样品,RT-PCR只能检测到10-2倍,表明RT-qPCR检测灵敏度比RT-PCR检测提高了10倍(图5)。
2.2 ‘阳光玫瑰’葡萄树地上部GRSPaV分布的动态变化规律
2.2.1 不同时期和不同部位GRSPaV的检出率 选择3株经前期检测携带GRSPaV的‘阳光玫瑰’葡萄树,分别在8个物候期,采集12个不同部位共147个样品进行RT-qPCR检测,以Ct值>32为阴性。如表2所示,GRSPaV在‘阳光玫瑰’葡萄树新梢中的检出率由高到低依次为:萌芽期(100%)=新梢生长期(100%)=花期(100%)>果实膨大期(91.7%)=落叶期(91.7%)>休眠期(66.7%)>果实转色期(50%)>果实成熟期(41.7%)。重截促使萌发的当年冬芽萌芽期及二次枝的新梢生长期检出率均低于新梢的同一物候期。
检测为阴性的样品共38个,3次检测为阴性的样品分别是果实转色期1—2片叶副梢,果实成熟期嫩叶片、嫩叶柄、幼嫩卷须和3—5片叶副梢,二次枝新梢生长期1—2片叶副梢,所有样品均为幼嫩部位。
对GRSPaV在不同部位中的检出率进行分析。不同部位检出率由高到低次序为:成龄叶片(100%)=成龄叶柄(100%)=幼嫩新梢(100%)>成熟卷须(94.4%)>嫩芽(83.3%)>嫩叶柄(72.2%)=幼嫩卷须(72.2%)>木质化枝条(66.7%)=休眠枝条(66.7%)>3—5片叶副梢(53.3%)>嫩叶片(50%)>1—2片叶副梢(46.7%)。成龄叶片及成龄叶柄从花期到落叶期所有样品均检出病毒。仅采自于落叶期的幼嫩新梢检出率比同期的木质化新梢和休眠期采集的休眠枝条检出率高。成熟卷须采自新梢生长期至成熟期和二次枝新梢生长期,检出率仅次于成龄叶片、成龄叶柄和幼嫩新梢,是幼嫩卷须检出率的1.3倍。

表2 不同物候期不同部位‘阳光玫瑰’葡萄树样品GRSPaV检出结果
GRSPaV阳性样本/该时期该部位样本总数;空格表示没有测试过的样本
GRSPaV positive samples / the total number of samples in this period; Blanks denote samples that have not been tested

图5 阳性葡萄样品不同稀释梯度RT-PCR(左)和RT-qPCR(右)检测方法灵敏度比较
所有部位中检出率最低的部位是1—2片叶副梢,成熟度较高的3—5片叶副梢检出率略高于1—2片叶副梢。检出率较低的部位是嫩叶片,嫩叶柄检出率是嫩叶片的1.4倍。新梢的嫩叶片和嫩叶柄在新梢生长期和花期检出率均为100%,果实膨大期检出率开始降低,至成熟期时检测为阴性。幼嫩卷须在新梢生长期至果实膨大期检出率均为100%,果实转色期检出率降低,成熟期检测为阴性。两种副梢在新梢生长期和果实膨大期检出率为100%,果实转色期至成熟期检出率降低或检测为阴性。
2.2.2 不同时期及不同部位GRSPaV CP基因表达量变化 通过RT-qPCR技术对不同物候期中芽、叶、卷须、副梢、新梢及休眠枝条韧皮部样品的GRSPaV进行检测,并计算病毒CP基因的相对表达量。由图6可知,GRSPaV在花期幼嫩卷须中基因表达量最高,其次为花期成龄叶片。不同物候期中GRSPaV CP基因表达量呈现先升高再下降的趋势,在花期最高,果实膨大期其次,在新梢生长期、果实转色期和果实成熟期表达水平一致,其余时期中表达量均较低。
成龄叶片中基因表达量呈现不断降低的趋势,在果实膨大期至成熟期均为同物候期内表达量最高部位;成龄叶柄则表现出先降低再升高至成熟期达到最高,再降低的趋势;幼嫩卷须中基因表达量呈现出先升高再降低的趋势,新梢生长期升高至花期达到最高,其余时期均保持最低水平;成熟卷须中表达量呈现逐渐降低的趋势,在新梢生长期中与幼嫩卷须同为基因表达量最高的部位;嫩叶片、嫩叶柄及两种副梢中基因表达量在所有物候期中均较低且无显著性差异。
在生长周期中,GRSPaV在花期的幼嫩卷须和成龄叶片中的含量最高。新梢生长期至果实膨大期的GRSPaV分布范围较广泛,在卷须、成龄叶片、成龄叶柄中均有存在,从果实转色期至落叶期病毒集中于成龄叶片及成龄叶柄,其余部位的病毒基因表达量均保持较低水平。重截新梢萌芽期及新梢生长期的所有样品病毒基因表达量均处于最低水平。
3 讨论
3.1 GRSPaV RT-qPCR检测体系应用
‘阳光玫瑰’葡萄作为易被病毒侵染的葡萄品种之一,其无病毒繁殖材料的使用是减少病害发生和危害的重要策略。通过建立一种快速、高灵敏度且可靠的检测方法来确认葡萄材料中是否存在病毒十分重要[11]。目前已报道建立了葡萄卷叶病毒3[23]、葡萄病毒A[20]、葡萄病毒B[24]和葡萄蚕豆萎蔫病毒[19]的RT-qPCR检测体系,分别比相应的RT-PCR法灵敏度高10倍、100倍和1 000倍。本研究建立了针对GRSPaV的RT-qPCR检测方法,也比RT-PCR灵敏度高10倍,能够检测出基因表达量较低的阳性样品。

图6 ‘阳光玫瑰’葡萄树不同物候期不同部位GRSPaV CP基因表达量
不同种类病毒检测时需要对病毒不同基因区域设计的引物进行筛选。周俊等[21]对葡萄扇叶病毒的归巢蛋白、移动蛋白和CP基因区域设计引物研究,以归巢蛋白基因区域的引物扩增效果最好。任芳等[25]对葡萄卷叶病毒2的多聚蛋白、DNA解旋酶、区域设计的引物研究,其中区域的引物扩增效果最好。本研究以GRSPaV的、和区域设计的引物进行扩增,结果表明区域的引物检出率高,特异性好。CP包裹核酸,保护病毒中的遗传物质,并参与病毒的复制、扩增和传播等重要过程,具有高度序列保守性[26]。
3.2 不同物候期及不同部位GRSPaV检出率存在差异
病毒在植物组织中并非均匀分布,且在一些特殊情况下,组织显症可能会有所延迟[27],给病毒检测工作增加难度。因此,筛选病毒检出率高的植物部位与关键物候期可以为适宜病毒检测样品的采集提供参考。本研究根据不同物候期的检出率发现萌芽期、新梢生长期、花期和果实膨大期的GRSPaV检出率较高,而果实转色期和果实成熟期检出率较低。尚佑芬等[28]研究表明5—6月(即本研究花期至果实膨大期)采集的叶片阳性率高,9—10月(即本研究成熟期)采集的叶片阳性率低,与本研究结果一致。
Hu等[11]通过RT-PCR法研究葡萄各部位病毒检出率,新梢韧皮部检出率为89.3%,叶柄检出率为50.0%。本研究中幼嫩新梢韧皮部与成龄叶的叶片、叶柄检出率均为100%,这可能与两种方法灵敏度不同有关。Stewart等[18]认为休眠芽最适宜作为检测材料,但因其研究只针对芽、茎尖、种子和枝条部位的样品进行检测,未包含本研究检出率最高的成龄叶,与本研究结果不矛盾。由于提取核酸时必须先将新梢韧皮部制成削片,耗时费工[18],而成龄叶样品制备相对更简单,因此认为成龄叶更适合作为GRSPaV检测材料。
3.3 不同物候期及不同部位中GRSPaV CP基因表达量存在差异
本研究在对‘阳光玫瑰’葡萄树不同物候期及不同部位的GRSPaV定量分析中,CP基因在果实膨大期、果实转色期、果实成熟期、落叶期中成龄叶片或成龄叶柄中Ct值始终较低。这一结果与Greig等[17]发现同一枝条上叶龄3周以上的叶片Ct值始终较低结果一致。此外,据Xiao等[29]报道,6—9月,‘品丽珠’‘霞多丽’‘雷司令’‘佳美’和‘琼瑶浆’葡萄上成龄叶和枝条韧皮部中GRSPaV的基因表达量没有差异,这与本研究落叶期的结果一致。
Monis等[30]报道病毒在葡萄体内分布不均匀可能是由于病毒在韧皮部组织中的运动和复制效率低造成,且位于葡萄新梢基部的样品中检测到较高的病毒滴度。本研究结果表明,GRSPaV主要集中在成熟度较高的部位,幼嫩部位中病毒含量较低。因此,根据GRSPaV CP基因表达量在不同物候期及成龄叶中的变化规律,认为花期的成龄叶更适宜作为GRSPaV病毒检测样品。
本研究通过重截促使冬芽当年萌发形成的当年冬芽和二次枝,重截新梢的萌芽期及新梢生长期均处于果实膨大期及果实转色期,此时GRSPaV已经在成熟部位中积累,而当年冬芽和二次枝的所有样品此时比较幼嫩,病毒向幼嫩组织中移动较慢[30],GRSPaV在当年冬芽和二次枝的所有部位中CP基因表达量一直维持在低水平。因此,认为果实膨大期至成熟期冬芽及萌发的二次枝可作为脱除病毒材料的采集样品。
4 结论
本研究首次建立了基于AugeGreen染料法的RT-qPCR GRSPaV病毒检测体系,灵敏度较RT-PCR高10倍。不同物候期病毒检出率在春季萌芽期至花期较高,花后开始降低,果实成熟期达到最低值,落叶期开始回升。不同部位病毒检出率由高到低依次为:成龄叶片=成龄叶柄=幼嫩新梢>成熟卷须>嫩芽>嫩叶柄=幼嫩卷须>木质化枝条=休眠枝条>3—5片叶副梢>嫩叶片>1—2片叶副梢。GRSPaV CP基因表达量整体呈先升高再下降的趋势,以花期最高。综合GRSPaV检出率及CP基因表达量等因素,进行GRSPaV病毒检测时宜采集花期成龄叶;用于脱除病毒材料时宜采集果实膨大期至成熟期冬芽及萌发的二次枝。
[1] http://journal.crnews.net/ncpsczk/2021n/d18q/dcyj/944624_20220216 034915. html. [2022-02-16].
[2] https://data.stats.gov.cn/easyquery.htm?cn=C01&zb=A0D0K&sj=. [2021].
[3] 胡国君, 董雅凤, 张尊平, 范旭东, 任芳, 朱红娟. 葡萄病毒脱除技术研究进展. 果树学报, 2013, 30(2): 304-310.
HU G J, DONG Y F, ZHANG Z P, FAN X D, REN F, ZHU H J. Research progress on virus elimination techniques of grapevine. Journal of Fruit Science, 2013, 30(2): 304-310. (in Chinese)
[4] 王令宇, 杨毓贤, 叶东东, 葛孟清, 诸葛雅贤, 王霏, 张晓雯, 肖鑫, 余文斌, 刘畅, 房经贵, 上官凌飞. 我国阳光玫瑰葡萄果实品质性状调查分析. 山西农业科学, 2022, 50(7): 1009-1015.
WANG L Y, YANG Y X, YE D D, GE M Q, ZHUGE Y X, WANG F, ZHANG X W, XIAO X, YU W B, LIU C, FANG J G, SHANGGUAN L F. Investigation and analysis of fruit quality traits of shine Muscat grape in China. Journal of Shanxi Agricultural Sciences, 2022, 50(7): 1009-1015. (in Chinese)
[5] 刘文林. ‘阳光玫瑰’葡萄病毒病调查及脱除病毒体系建立[D]. 保定: 河北农业大学, 2021.
LIU W L. Investigation of ‘Shine Muscat’ grape virus disease and establishment of virus elimination system [D]. Baoding: Hebei Agricultural University, 2021. (in Chinese)
[6] 范旭东, 董雅凤, 张尊平, 张梦妍, 任芳, 胡国君. ‘阳光玫瑰’葡萄病毒小RNA测序鉴定及RT-PCR检测. 植物病理学报, 2019, 49(6): 749-755.
FAN X D, DONG Y F, ZHANG Z P, ZHANG M Y, REN F, HU G J. Small RNA sequencing and RT-PCR detection of viruses infecting ‘Shine Muscat’ grapevines. Acta Phytopathologica Sinica, 2019, 49(6): 749-755. (in Chinese)
[7] MENG B, PANG S Z, FORSLINE P L, MCFERSON J R, GONSALVES D. Nucleotide sequence and genome structure of grapevine rupestris stem pitting associated virus-1 reveal similarities to apple stem pitting virus. Journal of General Virology, 1998, 79(8): 2059-2069.
[8] ZHANG Y P, UYEMOTO J K, GOLINO D A, ROWHANI A. Nucleotide sequence and RT-PCR detection of a virus associated with grapevine rupestris stem-pitting disease. Phytopathology, 1998, 88(11): 1231-1237.
[9] RIBEIRO G P, SALDARELLI P, HONG N, XIANG B, ZHANG X L, WANG G, MARTELLI G. First record of three grapevine viruses in the Chinese Province of Sinkiang. Journal of Plant Pathology, 2004, 86(3): 264.
[10] 朱红娟. 沙地葡萄茎痘相关病毒PCR检测及外壳蛋白基因变异分析[D]. 北京: 中国农业科学院, 2014.
ZHU H J. PCR detection of grape stem pox associated virus in sandy land and variation analysis of coat protein gene [D]. Beijing: Chinese Academy of Agricultural Sciences, 2014. (in Chinese)
[11] HU G J, DONG Y F, ZHU H J, ZHANG Z P, FAN X D, REN F. Detection and distribution ofin grapevine. Scientia Horticulturae, 2018, 239: 64-69.
[12] WANG Y, OSTENDORF B, GAUTAM D, HABILI N, PAGAY V. Plant viral disease detection: From molecular diagnosis to optical sensing technology - A multidisciplinary review. Remote Sensing, 2022, 14(7): 1542.
[13] HU G J, DONG Y F, ZHANG Z P, FAN X D, REN F, LI Z N, ZHANG S N. Elimination offrom‘Kyoho’ by an antiviral agent combined with shoot tip culture. Scientia Horticulturae, 2018, 229: 99-106.
[14] 陶源, 吴兴泉. 植物病毒检测方法的研究进展. 分子植物育种, 2017, 15(7): 2901-2906.
TAO Y, WU X Q. Research progress of plant virus detection methods. Molecular Plant Breeding, 2017, 15(7): 2901-2906. (in Chinese)
[15] 范旭东, 董雅凤, 张尊平, 任芳, 胡国君, 朱红娟. 葡萄病毒分子检测技术研究进展. 园艺学报, 2014, 41(5): 1009-1019.
FAN X D, DONG Y F, ZHANG Z P, REN F, HU G J, ZHU H J. Progress on molecular detection of grapevine viruses. Acta Horticulturae Sinica, 2014, 41(5): 1009-1019. (in Chinese)
[16] OSMAN F, ROWHANI A. Real-time RT-PCR (TaqMan®) assays for the detection of viruses associated with Rugose wood complex of grapevine. Journal of Virological Methods, 2008, 154(1/2): 69-75.
[17] GREIG N, LUONG J, HOOKER J, STOBBS L W, MENG B. Optimization of a direct real-time quantitative reverse transcription polymerase reaction (DRT-qPCR) assay for the detection of grapevine rupestris stem-pitting associated viruses (GRSPaV) in grapevine. Canadian Journal of Plant Pathology, 2020, 42(2): 292-303.
[18] STEWART S, NASSUTH A. RT-PCR based detection ofwithin field-grown grapevines throughout the year. Plant Disease, 2001, 85(6): 617-620.
[19] 张梦妍, 张尊平, 任芳, 胡国君, 范旭东, 董雅凤. 葡萄蚕豆萎蔫病毒实时荧光定量RT-PCR检测方法及应用. 园艺学报, 2020, 47(1): 187-194.
ZHANG M Y, ZHANG Z P, REN F, HU G J, FAN X D, DONG Y F. Establishment and application of a real-time fluorescent quantitative RT-PCR for detection of grapevine fabavirus. Acta Horticulturae Sinica, 2020, 47(1): 187-194. (in Chinese)
[20] 任芳, 董雅凤, 张尊平, 范旭东, 胡国君. 葡萄病毒A实时荧光定量RT-PCR检测技术的建立及应用. 园艺学报, 2018, 45(11): 2243-2253.
REN F, DONG Y F, ZHANG Z P, FAN X D, HU G J. Development and application of a quantitative RT-PCR approach for detection of grapevine virus A. Acta Horticulturae Sinica, 2018, 45(11): 2243-2253. (in Chinese)
[21] 周俊, 范旭东, 董雅凤, 张尊平, 胡国君, 任芳, 李正男. 葡萄扇叶病毒实时荧光定量RT-PCR检测方法的建立及应用. 园艺学报, 2016, 43(3): 538-548.
ZHOU J, FAN X D, DONG Y F, ZHANG Z P, HU G J, REN F, LI Z N. Development and application of a quantitative RT-PCR approach for quantification of grapevine fanleaf virus. Acta Horticulturae Sinica, 2016, 43(3): 538-548. (in Chinese)
[22] 王玉倩, 薛秀花. 实时荧光定量PCR技术研究进展及其应用. 生物学通报, 2016, 51(2): 1-6.
WANG Y Q, XUE X H. Research progress and application of real-time fluorescence quantitative PCR technology. Bulletin of Biology, 2016, 51(2): 1-6. (in Chinese)
[23] 乾义柯, 张娜, 魏霜, 陆平, 张祥林. 基于DPO引物的SYBR Green Ⅰ实时荧光RT-PCR检测葡萄卷叶伴随病毒3号. 植物保护学报, 2017, 44(2): 343-344.
QIAN Y K, ZHANG N, WEI S, LU P, ZHANG X L. Using SYBR Green Ⅰ RT-PCR based on DPO primers to detection Grapevine leafroll-associated virus 3. Journal of Plant Protection, 2017, 44(2): 343-344. (in Chinese)
[24] 任芳, 张尊平, 范旭东, 胡国君, 张梦妍, 董雅凤. 应用实时荧光定量RT-PCR高效检测葡萄病毒B. 植物病理学报, 2019, 49(4): 569-576.
REN F, ZHANG Z P, FAN X D, HU G J, ZHANG M Y, DONG Y F. Effective detection of Grapevine virus B by real-time fluorescent quantitative RT-PCR. Acta Phytopathologica Sinica, 2019, 49(4): 569-576. (in Chinese)
[25] 任芳, 张尊平, 范旭东, 胡国君, 张梦妍, 董雅凤. 葡萄卷叶伴随病毒2实时荧光定量RT-PCR技术的检测应用. 植物保护, 2020, 46(3): 180-187.
REN F, ZHANG Z P, FAN X D, HU G J, ZHANG M Y, DONG Y F. Application of a real-time quantitative RT-PCR for detection of Grapevine leafroll-associated virus 2. Plant Protection, 2020, 46(3): 180-187. (in Chinese)
[26] 苗艳梅, 赵敏. 马铃薯Y病毒属病毒外壳蛋白功能. 黑龙江农业科学, 2019(3): 165-168.
MIAO Y M, ZHAO M. Functional characterization of potyvirus- encoded coat protein. Heilongjiang Agricultural Sciences, 2019(3): 165-168. (in Chinese)
[27] BODIN M, GLASA M, VERGER D, COSTES E, DOSBA F. Distribution of the sour cherry isolate of plum pox virus in infectedrootstocks. Journal of Phytopathology, 2003, 151(11/12): 625-630.
[28] 尚佑芬, 王升吉, 赵玖华, 张家魁, 吕志华, 路兴波, 孙红炜, 杨崇良. 山东省沙地葡萄茎痘相关病毒的检测. 果树学报, 2009, 26(2): 158-162.
SHANG Y F, WANG S J, ZHAO J H, ZHANG J K, LÜ Z H, LU X B, SUN H W, YANG C L. Detection of grapevine rupestris stem pitting associated virus occurred in Shandong Province. Journal of Fruit Science, 2009, 26(2): 158-162. (in Chinese)
[29] XIAO H G, KIM W S, MENG B Z. A highly effective and versatile technology for the isolation of RNAs from grapevines and other woody perennials for use in virus diagnostics.Virology Journal, 2015, 12(1): 1-15.
[30] MONIS J, BESTWICK R K. Detection and localization of grapevine leafroll associated closteroviruses in greenhouse and tissue culture grown plants. American Journal of Enology and Viticulture, 1996, 47(2): 199-205.
The Variation of GRSPaV in Different Parts of Shine Muscat Grapevines During Their Phenological Periods
LI MeiXuan, ZHANG XiangKun, WANG Li, QIAO YueLian, SHI XiaoXin, DU GuoQiang
College of Horticulture, Hebei Agricultural University, Baoding 071000, Hebei
【Background】Grapevine rupestris stem pitting associated virus (GRSPaV) is the most common virus causing rugose wood disease. It is mainly transmitted via asexual reproduction. Sensitive detection technology and cultivation of virus-free plants are essential for preventing GRSPaV. 【Objective】The purpose of this study was to establish a GRSPaV detection system, and to determine the appropriate periods and sites of sample collection for virus detection, so as to provide a reference for virus detection and obtaining virus-free materials. 【Method】An RT-qPCR detection method was established using the AugeGreen dye method and primers according to the coat protein gene () region. The detection rate and gene expression of GRSPaV in samples from different parts of Shine Muscat grapevines during various phenological stages were examined. 【Result】The RT-qPCR detection method for GRSPaV using GRS q CP1 as primer showed 10 times higher sensitivity than that of RT-PCR method. The detection rates of GRSPaV were 100% during the budbreak, shoot growing period, and florescence, 91.7% during the fruit enlargement stage, 94.4% for mature tendrils, and 100% for mature leaves, mature petioles, and tender shoots. Samples showing negative results were all from the young parts of the plants. The young tendrils at florescence showed the highest level of GRSPaVgene expression, followed by the mature leaves at florescence. The expression level in mature leaves was the highest among the parts in the same phenological period from berry expansion to maturity. The expression levels in secondary winter buds at the budbreak stage and the secondary laterals at the shoot growing period were both relatively low. 【Conclusion】 The detection rate of GRSPaV and the GRSPaVgene expression level of Shine Muscat grape varied with the progression of phenological periods. The detection rate was the highest from budbreak to florescence, while which was the lowest at berry maturity period. The GRSPaVgene expression level was the highest at florescence. Based on both the detection rate and the expression level factors, it could be concluded that the mature leaves at florescence were suitable as samples for GRSPaV virus detection, and the winter buds from the berry expansion to maturity period and the lateral shoots germinated from these buds was appropriate for obtaining virus-free materials.
Shine Muscat grapevines; grapevine rupestris stem pitting associated virus; real-time fluorescence quantitative PCR; detection rate of viruses; gene expression level

2023-06-21;
2023-08-21
河北省现代农业产业技术体系葡萄创新团队(HBCT2023150201)、热杂果现代种业科技创新团队(葡萄-6)(21326310D)
李美璇,E-mail:lmx970130@163.com。张向昆,E-mail:1169806059@qq.com。李美璇和张向昆为同等贡献作者。通信作者杜国强,E-mail:gdu@hebau.edu.cn
(责任编辑 赵伶俐)
