IL-15 转染人CIK 细胞对HT-29 的杀瘤效果探究
2023-11-18王柏涛梁宇堃王丙萍杨超旗高艳伟b
王柏涛,梁宇堃,王丙萍,杨超旗,高艳伟b
作为较为多见的消化系统恶性肿瘤, 结肠癌(colorectal cancer,CRC)的致死率已跃居癌症死亡率前列[1],中国新近CRC 发病人数显现迅速上涨态势。当前虽已对CRC 的发生发展及其浸润、 转移机制有了一定认知,但由于早期症状多不典型,大多发现时已属晚期[2]。 手术、化学治疗和放射治疗为CRC 主要治疗方式,但此类疗法复发率及病死率较高,且预后差。 作为肿瘤治疗的第4 种模式,免疫治疗现已成为多数恶性肿瘤的标准疗法[3],且过继性细胞免疫疗法已在治疗某些血液系统疾病中获得较好疗效[4]。
具备自然杀伤T 细胞表型特性,同时多细胞因子参与调控所致的细胞因子诱导杀伤(cytokine-induced killer,CIK)细胞,多数学者基于其增殖速度、抗瘤杀瘤等方面的优越性[5],CIK 疗法已然变成肿瘤免疫学研究的关键所在。 白细胞介素(interleukin,IL)15(IL-15)已被证实可显著增强CIK 细胞的体外细胞毒性[6]。笔者实验对IL-15 基因(IL-15)转染人CIK 细胞治疗CRC 进行初步探究,评估其对人CRC 细胞株HT-29细胞的杀伤效果。
1 材料与方法
1.1 实验材料
1.1.1 实验病毒、细胞与血液样本
携带IL-15的慢病毒上清液(GeneChem Company,中国上海)。
人CRC 株HT-29 由内蒙古自治区肿瘤研究所供给。
静脉采集健康成年人血液标本15 mL。 取得患者知情同意并签署知情同意书(编号:20220709)。
1.1.2 主要试剂
达氏修正依氏培养液 (Dulbecco’s modified Eagle’s medium,DMEM)、胎牛血清(fetal bovine serum,FBS)(Gibco, 美国); 异硫氰酸荧光素(fluorescein isothiocyanate isomer,FITC)-白细胞分化抗原(cluster of differentiation,CD)3、藻红蛋白(phycoerythrin,PE)-CD56、 鼠抗人FITC-IgG (BD, 美国);GT-551(TaKaRa, 日本);KBM-551 培养液 (康宁生命,中国);CD3 单抗(苏州VANVO,中国);干扰素γ(interferon γ,IFN-γ)、IL-1α、IL-2(R & D,美国); CCK-8(北京沃比森,中国);细胞因子IL-15、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、IFN-γ 酶联免疫吸附分析 (enzyme-linked immunosorbent assay,ELISA)试剂盒(BD,美国)。
1.1.3 仪器与设备
离心管、细胞培养皿(Costar,美国);FACSCalibur流式细胞仪(BD,美国) ;CO2培养箱(赛默飞,美国);超净台(AIRTECH,中国);荧光显微镜(徕卡,德国);恒温水浴锅(RADOBIO,中国);电子天平(METTLER TOLEDO,中国);多量程移液器(Brand,德国);-80 ℃超低温冰箱(REVCO, 美国); 酶标仪 (北京PERLONG,中国)。
1.2 方法
1.2.1 CIK 细胞培养
将血液标本15 mL 用0.9%氯化钠溶液(NaCl 溶液)稀释至30 mL,与淋巴细胞分离液混合(混合比=1 ∶2.5)离心后制备成功外周血单个核细胞(peripheral blood mononuclear cell,PBMC)。 培养液设为GT-551,浓度调至2 × 106/mL,依培养进程,将IFN-γ、IL-1α、IL-2 等细胞因子及CD3 单抗加入后染色,观察细胞形态。
1.2.2IL-15转染CIK 细胞
取出购买含IL-15的病毒上清液。将PBMC 制备的CIK 细胞培养5 d,细胞浓度更换为1×106/mL 后预备转染。 CIK 细胞与含IL-15的慢病毒各1 mL 混合后重新悬浮。 在37 ℃、体积分数5%CO2培养箱中连续孵育2 h。 之后按25 r/s 离心300 s。 后将上清液弃置,用KBM-551 重悬沉淀物。间隔1 d 用上述病毒的上清液,再次进行转染。依据之前的步骤,将上清液按以往转速再次离心300 s。 收集上清液置于-80 ℃冰箱备再次实验用。
1.2.3 流式细胞检测
(1)CIK 细胞鉴定:培养3 ~4 d 后,CIK 细胞聚集成团且集落形成;经清洗、染色等步骤后,上机鉴定。
(2)CIK 细胞感染效率鉴定:转基因细胞培养2 d后,在光学显微镜下详细观察CIK 的感染效率。
1.2.4 酶联免疫吸附分析
分别提取IL-15-CIK 细胞及CIK 细胞培养7、11、14 d 的上清液1 mL, 用ELISA 法检测IL-15、IFN-γ 和TNF-α 的表达水平。 以未转染的CIK 所培育出的上清液作参照。实验前将所有细胞的上清液冰上融化至液态,同时将检测试剂盒平衡至室温,按照ELISA 细胞因子检测试剂盒的说明进行检测操作。
1.2.5 结肠癌细胞培养
将人CRC 细胞株HT-29 培养、传代于DMEM 中(内含10% FBS、100 μg/mL 青/链霉素)。
1.2.6 CCK-8 法检测IL-15-CIK 细胞对结肠癌细胞的杀瘤效果
取培养24 h 的CRC 细胞作为靶细胞,取制备好的CIK 和IL-15-CIK 细胞用作测定实验中的效应细胞。效应细胞分为两组,调整靶细胞浓度为5×103/孔,按效靶比(E∶T)5∶1、10∶1、20∶1、25∶1 混合后经培养箱孵育1 d,每孔各添加15 μL 的CCK-8,酶标仪测量出光密度(optical density,OD),并测算杀伤率。
杀伤率(%)=[1-(研究组OD -效应细胞OD)/靶细胞OD]×100%。
1.2.7 杀瘤前后HT-29 细胞中细胞因子含量测定
选连续培育14 d 效应细胞。 收集E∶T 为25∶1时IL-15-CIK 及CIK 细胞对HT-29 细胞株作用前后的上清液各0.5 mL, 用ELISA 法检测上清液内IL-15、IFN-γ、TNF-α 含量变化。以未转染的CIK 所培育出的上清液作参照。实验前将所有细胞的上清液冰上融化至液态, 同时将检测试剂盒平衡至室温, 按照ELISA 法细胞因子(IL-15、IFN-γ、TNF-α)检测试剂盒的说明进行检测操作。
1.3 统计学方法
数据分析处理均选用SPSS 22.0 版本。 计数、计量资料分别以百分率(%)、均数± 标准差表示;组间比较依情况可选用F检验、t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 CIK 及转基因CIK 细胞的鉴定
取连续培养5 d 的CIK 细胞,在光学显微镜下仔细观察可见细胞增殖明显,数目增多,胞体增大,形态渐趋饱满,成团簇状分布,且形成集落(图1);以鼠抗人IgG 为同型对照, 经流式细胞仪鉴定为CIK 细胞(图2);将培养5 d 的CIK 细胞,用含IL-15的慢病毒感染48 h 后, 倒置荧光显微镜镜下观察其明场图和荧光图,说明转基因细胞模型构建成功(图3)。

图1 培养第5 天CIK 细胞(200× )Fig.1 Image of CIK cells cultured for 5-day(200×)
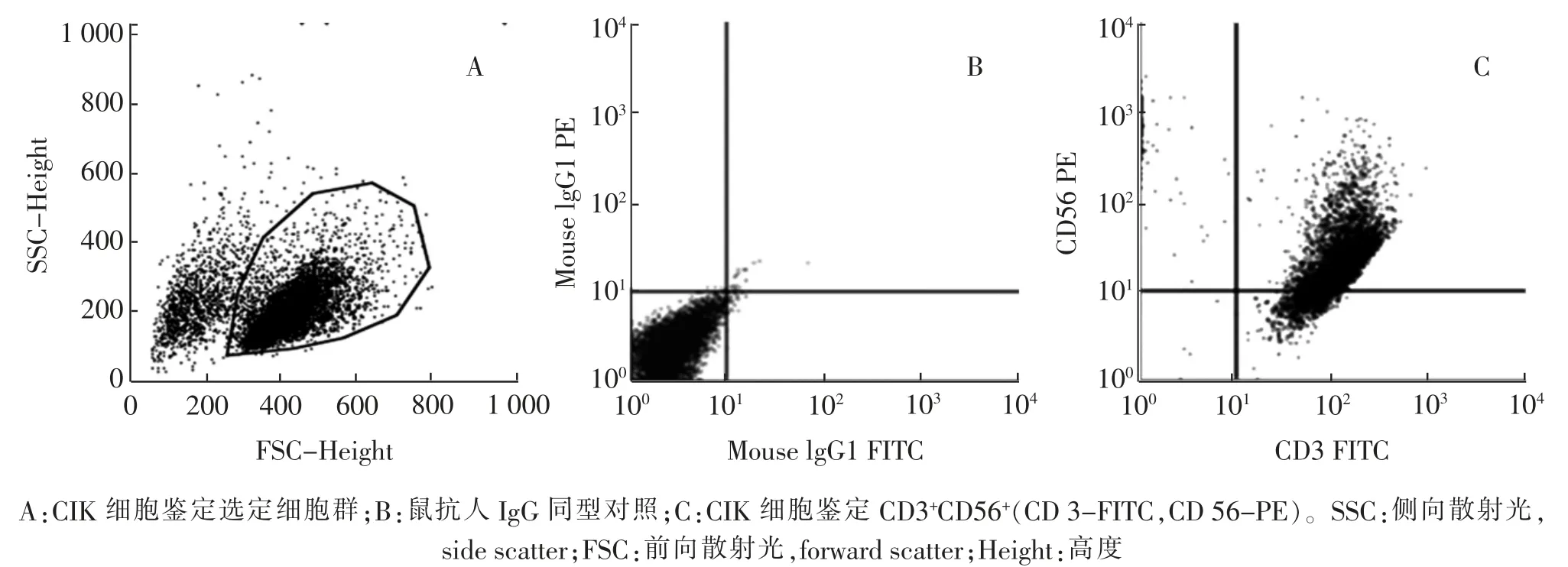
图2 CIK 细胞鉴定流式图Fig.2 Flow cytometry diagrams of CIK cell identification
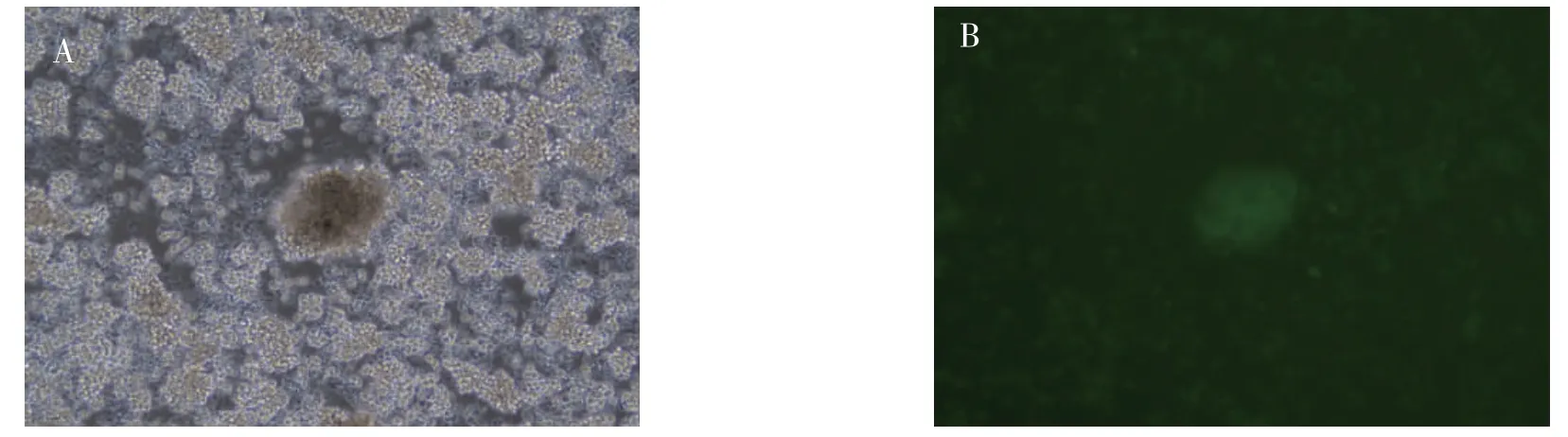
图3 IL-15-CIK 细胞的明场图(A)和荧光图(B)(50×)Fig.3 Bright field diagram(A)and fluorescence image(B)of IL-15-CIK cells(50×)
2.2 两种效应细胞对结肠癌细胞的作用比较
CCK-8 法检测结果显示,E ∶T 为10 ∶1 时,IL-15-CIK 细胞与CIK 细胞对CRC 靶细胞具有杀伤能力, 但杀伤活性相比较, 差异无统计学意义 (P>0.05)。随着E ∶T 增加,杀伤活性逐渐增强,CRC 细胞被IL-15-CIK 细胞及细胞CIK 细胞有效裂解。当E ∶T 达到25 ∶1,IL-15-CIK 细胞与CIK 细胞对CRC 细胞的杀伤作用相比,差异有统计学意义(P<0.05)。见表1。 光学显微镜下对比观察发现,当HT-29 被杀伤前,细胞呈良好贴壁状态(图4A);IL-15-CIK 细胞杀伤HT-29 细胞后,细胞贴壁状态逐渐转为半贴壁,大量细胞死亡(图4 B);CIK 细胞杀伤HT-29 细胞时,细胞死亡数量明显少于IL-15-CIK 细胞杀伤后 (图4C)。 由此说明,IL-15-CIK 细胞对CRC 靶细胞的杀伤能力强于CIK 细胞。

表1 不同E ∶T 下CRC 细胞的杀伤率比较Tab.1 Comparison of killing rate of CRC cells at different E ∶T
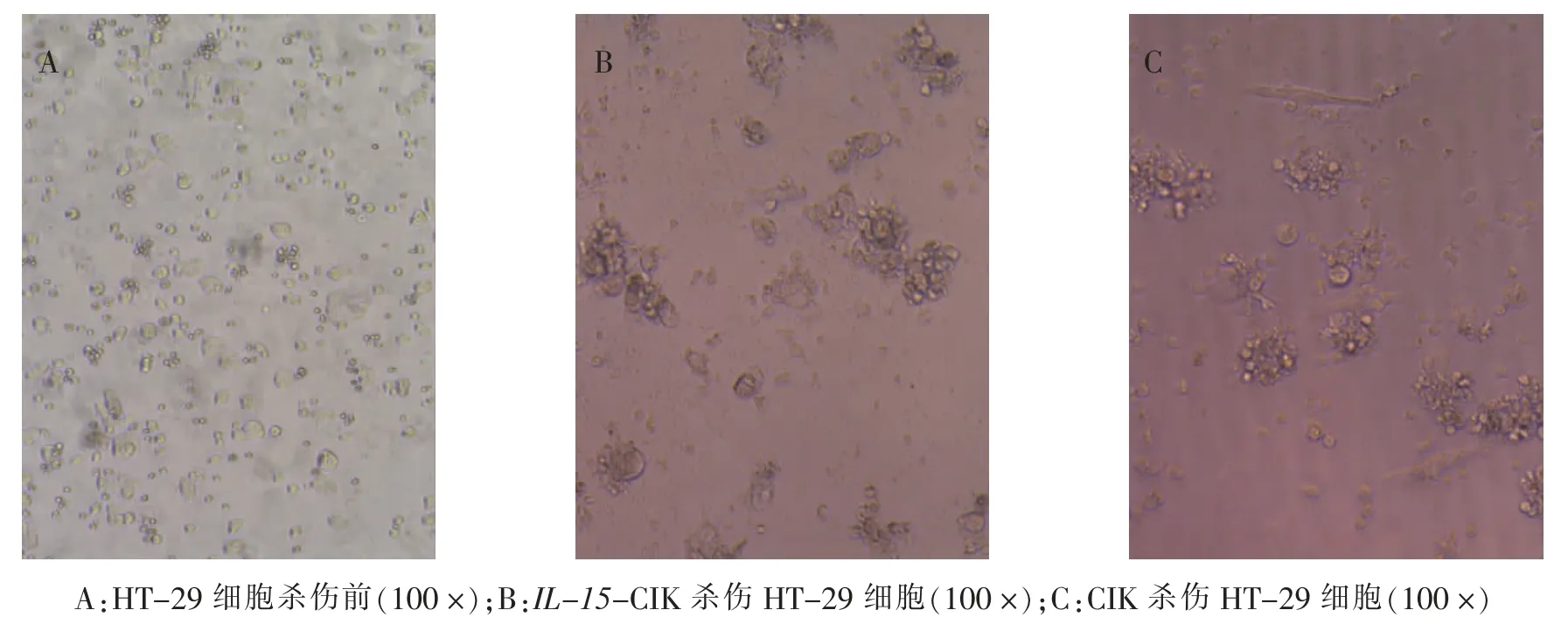
图4 HT-29 细胞杀瘤前后效果对比光学显微镜图Fig.4 Image of optical microscopy of HT-29 cells before and after tumor-killing
2.3 两种细胞中细胞因子的分泌及其对HT-29 细胞株杀瘤时影响
2.3.1 不同培养时间两种细胞的细胞因子含量比较
在IL-15-CIK 细胞及CIK 细胞培养7 d、11 d、14 d中, 两种细胞上清液中IL-15、IFN-γ 及TNF-α 的含量均随着时间的增长而升高,并且可以观察到转染后细胞的3 种细胞因子含量显著高于未转染细胞,两种细胞间差异明显,两种细胞间不同时间比较,差异有统计学意义(P<0.05)。 但在IL-15-CIK 细胞中观察到,TNF-α含量在11 d 与14 d 内差异无统计学意义(P>0.05),其余时间相比,差异均有统计学意义(P<0.05)。 见表2。
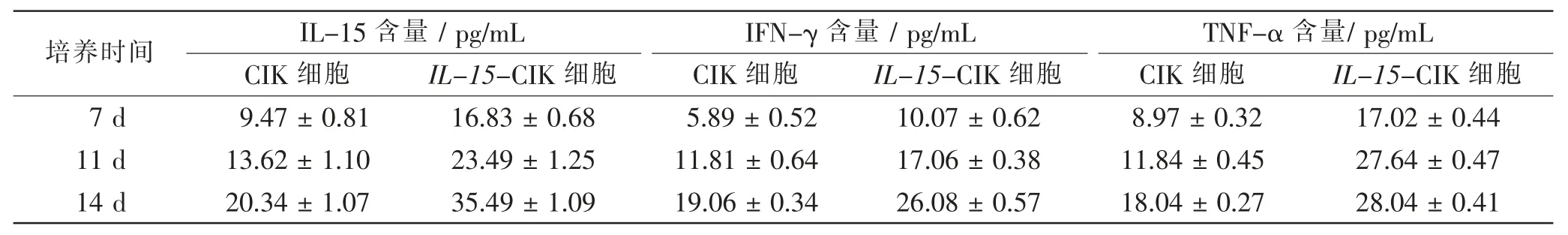
表2 两种细胞不同培养时间IL-15、IFN-γ、TNF-α 含量比较Tab.2 Comparison of IL-15,IFN-γ and TNF-α content at different culture time between 2 cell lines
2.3.2 培养14 d 两种细胞杀瘤前后细胞因子含量比较
选体外培养14 d 的IL-15-CIK 细胞及CIK 细胞以E ∶T=25 ∶1 对HT-29 细胞株作用后,检测到两种上清液中IL-15、IFN-γ、TNF-α 的含量较杀瘤前有所变化。在CIK 细胞中,IFN-γ 含量显著变高,较杀瘤前差异有统计学意义(P<0.05),但IL-15、TNF-α 的含量虽有所增加, 但这种变化差异无统计学意义(P>0.05)。 在IL-15-CIK 细胞中,IL-15、IFN-γ、TNF-α含量均较杀瘤前明显升高, 差异有统计学意义(P<0.05)。 通过对比发现,IL-15-CIK 细胞3 种细胞因子的含量与CIK 细胞相比,明显升高,差异有统计学意义(P<0.05)。 见表3。
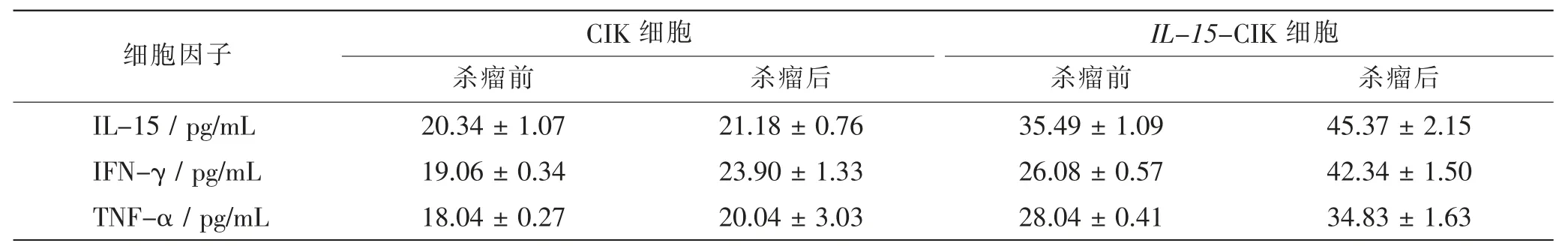
表3 两种细胞杀瘤前后细胞因子含量比较Tab.3 Comparison of cytokine content before and after tumor-killing between 2 cell line
3 讨论
免疫治疗是目前除传统手术切除、放化疗及靶向药物外,最具发展潜力的肿瘤新兴疗法[7]。而从机体自身或其他机体提取出的免疫细胞,通过扩增、基因工程改造等方式,重新返回机体,以期激发免疫应答反应,进而发挥抗瘤作用的诊疗思路,意即过继性细胞疗法(adoptive cell therapy,ACT)。 此种疗法已在临床部分肿瘤中得到广泛应用[8]。 近年来发现CIK 细胞在增殖速度、抗瘤效果方面具备一定优势,通过与相关细胞因子共同作用,从而提升其生物学属性[9]。细胞因子参与调控免疫反应,扮演重要角色,对肿瘤的新兴疗法方面有远大前景。 IL 作为一组白细胞重点表达的细胞因子, 多数IL 家族因子关于抗瘤治疗上凸显关键[4]。 而经基因工程改造的T 淋巴细胞,以IL-2 为节点。 近年来,因IL-15 对参与先天免疫和适应性免疫的细胞具有广泛的活性,被认为是免疫基因治疗的强有力的候选者[10]。 不仅与IL-2 的功能相似,且可抑制活化诱导的细胞死亡 (activation-induced cell death,AICD),减少细胞凋亡并增加T 细胞持久性,且毒性较小[11]。
既往已证实, 成功制备14 d 左右的CIK 细胞抗瘤效果达到顶峰。 该实验中, 笔者选用CIK 细胞和IL-15-CIK 细胞对CRC 细胞进行杀伤活性检测,结果显示当效靶比为10 ∶1,IL-15-CIK 细胞及CIK 细胞对CRC 细胞均具有杀伤能力, 表明IL-15-CIK 细胞及CIK 细胞对CRC 均有一定的抑制能力。 但随着E ∶T 比值的逐渐升高,转染后细胞对CRC 的杀伤强度显著强于未转染的细胞, 同时也证明IL-15-CIK细胞拥有极为明显的针对CRC 细胞株的杀伤特性。
该实验同时表明,TNF-α 等多种细胞因子可被效应细胞自分泌生成。并且当IL-15-CIK 细胞及CIK细胞以E ∶T=25 ∶1 为限对HT-29 细胞进行杀瘤实验后, 发现细胞因子IL-15、IFN-γ、TNF-α 较前均有所增加, 其中IL-15-CIK 细胞较CIK 细胞的细胞因子含量增加更明显。 以上结果表示,当CIK 细胞显著增多后,不仅提升免疫属性,更可分泌具备多种生物效能的细胞因子, 且IL-15-CIK 细胞较CIK 细胞在同等时间条件下的杀瘤作用更强。同时细胞因子参与抗瘤后各自发挥其功能。 而由CD4+、 CD8+生成的IFN-γ 可对同种生物进行广泛调节。它能使细胞建立抗病毒状态的生物活性,调节细胞生长分化和对免疫系统的调节作用[12]。 作为细胞免疫的关键参与者,主要通过抑制肿瘤细胞的分裂、增殖,从而发挥抗瘤作用[13]。 多数通过调节引起相关细胞死亡的TNF-α[14],主要源于巨噬细胞。 可直接作用于肿瘤细胞,阻抑肿瘤的形成[15]。
4 结论
综上所述, 应用转基因CIK 细胞在体外展现了较好的肿瘤杀伤活性,然而其在动物体内或是肿瘤患者体内是否能够真正发挥出良好的抗肿瘤特性,有待动物和临床试验的再论证。
