携单抗载增效剂超声纳米微泡制备实验的探索与研究
2023-11-18王婧茹张惠卿王占忠梁丹艳
王婧茹,红 华,张惠卿,王占忠,梁丹艳,刘 倩,孙 冉
超声微泡造影剂已从微米级进入纳米级(直径约40 ~350 nm)领域,具有稳定性更高、血液循环时间更长的优势。纳米载体技术已可实现对特异性配体或抗体进行修饰, 通过组织外渗透定向到达宿主目标微环境,利用纳米粒自身属性携带药物或基因并保持活性[1],发挥分子探针的作用,与超声造影技术结合后在精准成像的同时实现靶向给药治疗[2],为临床的诊疗工作提供有效的医学手段。属于第一代光敏剂的血卟啉单甲醚 (hematoporphyrinmono-methyl ether,HMME)基于其光敏和声敏的双重特点[3,4]可作为一种增效剂被包裹在超声造影剂壳膜内,以期在增强超声显像和治疗效果方面起到作用。 笔者拟从制备材料的选择、纳米微泡与抗体的连接方式、反应条件及合成后的验证方式等几方面探索研究,制备得到携单抗载增效剂超声纳米微泡。
1 材料与方法
1.1 实验材料
1.1.1 主要试剂
聚乳酸羟基乙酸[poly(lactic-co-glycolic acid),PLGA](聚合比50 ∶50)(美国Acros);(+)-生物素-N-羟基琥珀酰亚胺酯 (N-hydroxysuccinimide,NHS)98 %(ALFA,美国);帕博利珠(pembrolizumab)单抗(MCE 试剂公司,美国);HMME (上海笛柏化学品技术有限公司, 中国); 链霉亲和素 (Streptavidin and Conjugates,SA)(上海阿拉丁生化科技股份有限公司,中国);全氟戊烷(perfluoropentane,PFP)(TCI 公司,日本);链霉亲和素-荧光素异硫氰酸酯偶联物(Streptavidin fluorescein isothiocyanate conjugate,Streptavidin-FITC)(Sigma-Aldrich 公司,德国);六氟化硫(博莱科公司,意大利)。
1.1.2 主要仪器
超声细胞粉碎仪(苏州纳森超声科技有限公司,中国);恒温孵育摇床(郑州宏朗仪器设备有限公司,中国);高速离心机(Eppendorf 公司,德国);透射电子显微镜、扫描电子显微镜(HITACHI,日本),动态激光散射仪(PSS 粒度仪公司,美国);紫外可见分光光度仪(Merinton,美国);扫描隧道显微镜(Nanosurf,瑞士);激光共聚焦显微镜(Zeiss,德国);超声诊断仪(飞利浦公司,荷兰);恒温水浴锅(上海精宏实验设备有限公司,中国)。
1.2 方法
1.2.1 携单抗载增效剂超声纳米微泡的制备
1.2.1.1 载增效剂纳米微泡的制备 将5 mL CHCl3加入50 mg PLGA 与4 mg HMME 的混合液中, 磁力搅拌至混匀溶解并置于冰水浴,后与16 mL 4% 聚乙稀醇(polyvinylalcohol,PVA)及400μLPFP 充分混合溶解,置于超声细胞粉碎仪内工作20 min(功率90 W,间隔5 s),再加入20 mL 2%异丙醇,磁力搅拌10 h,多次离心洗涤,得到载有HMME 超声纳米微泡。
1.2.1.2 链霉亲和素修饰纳米微泡 将2 mg SA 加入上述纳米微泡, 先后经过pH 6、pH 7.4 MES Buffer 及1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐[1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride,EDC]、NHS 混合后冰水浴摇床孵育且多次离心(9 000 r/min,5 min), 洗涤后得到的混合溶液中再次孵育离心洗涤,得到SA 化的载增效剂超声纳米微泡。
1.2.1.3 PD-1 单抗生物素化 将5 mg PD-1 单抗和5 mL pH 7.4 MES Buffer 的混合溶液与20 mg 生物素酯溶于1 mL 超纯水的混合溶液中, 使PD-1 单抗与生物素酯的比例保持在1 mg ∶10 μL, 在PD-1 单抗溶液中加入生物素酯溶液后混合, 室温摇床孵育1.5 h,4 ℃条件下在pH 7.4 MES Buffer 中透析72 h 后去除游离生物素酯。
1.2.1.4 携PD-1 单抗载增效剂超声纳米微泡的制备上述步骤所得溶液中加入2 mg FITC-SA, 常温摇床孵育2 h 后在pH 7.4 MES Buffer 中透析72 h,去除游离FITC-SA,与连接SA 之前制备所得纳米微泡按比例相混合后再摇床孵育2 h, 多次离心洗涤, 制得携PD-1 单抗载增效剂超声纳米微泡。
1.2.2 纳米微泡的基本性质检测和实验表征分析
1.2.2.1 纳米微泡物理性质及其表征 采用扫描电子显微镜观察纳米微泡大小形态、表面结构及分布特征,得到表面立体三维图像。 透射电子显微镜观察观察纳米微泡内部精细结构, 获得表面和内部结构信息。动态激光散射仪分析其粒径、稳定性、聚合物分散指数,测定表面Zeta 电位。 紫外分光光度计测量计算HMME 的包封率。 超声诊断仪灰阶及造影模式下观察纳米微泡体外超声显像效果。
1.2.2.2 PD-1 单抗生物素化制备及结合验证 在激光共聚焦显微镜下验证PD-1 单抗生物素化及FITC-SA 与生物素化单抗结合,观察并分析载增效剂及携带单抗纳米微泡制备情况。
1.2.3 纳米微泡相变及超声显像效果体外初步验证
称取纳米微泡、六氟化硫、超纯水3 组液体各5 mL,在室温下进行超声图像对比观察。 将装有纳米微泡溶液的乳胶手套分别放入29 ℃、37 ℃、40 ℃、45 ℃和50 ℃几组不同温度状态下的水浴锅内, 超声诊断仪在灰阶及造影模式下观察几组溶液的声像图变化。
1.3 统计学方法
计量数据符合正态分布, 统计描述采用均数±标准差。 采用线性回归方程对HMME 浓度与光密度的标准曲线进行绘制。 决定系数R2用来描述方程拟合优度, 回归方程拟合实际情况的真实度与R2接近1 的程度呈正相关。
2 结果
2.1 纳米微泡制备、物理性质表征及结合验证
2.1.1 纳米微泡制备结果
运用乳化法成功制备出以PLGA 为载体、内部加载HMME 及PFP,且用PD-1 单抗修饰其表面的携单抗载增效剂超声纳米微泡。透射电子显微镜下表现为内部黑色的类球形结构, 表明PFP 及HMME 被包裹于纳米微泡内核中心而非壳层内(图1)。

图1 透射电子显微镜下携单抗前后纳米微泡为内部黑色的类球形结构Fig.1 Images of spherical structures with black interior of nanobubbles before and after carrying monoclonal antibody under transmission electron microscope
2.1.2 稳定性观察
复溶后分散均匀,颜色随稀释浓度不同表现差异(图2),短期内4 ℃条件下可以稳定保存。

图2 不同稀释倍数下的纳米粒乳液外观Fig.2 Image of appearance of nanobubbles emulsions at different dilution ratios
2.1.3 纳米微泡载药前后大小分布与Zeta 电位
扫描电子显微镜下纳米微泡呈表面光整的类球形结构,大小较匀称(图3),局部可见小范围粘连聚集现象。 动态激光散射仪测得纳米微泡携PD-1 单抗前后平均粒径分别为(322.29±83.56)nm 和(330.17±75.28)nm。 表明PD-1 单抗对微球粒径无明显影响(图4), 静置数天后复测粒径分布未见明显变化;纳米微泡Zeta 电位是(- 2.41 ± 1.75) mV;聚合物分散指数约为0.287(图5)。

图4 动态激光散射仪测得纳米微泡携单抗前(A)、后(B)粒径分布图Fig.4 Diagrams of particle size distribution of nanobubbles carrying monoclonal antibody before(A)and after(B)by dynamic laser scattering
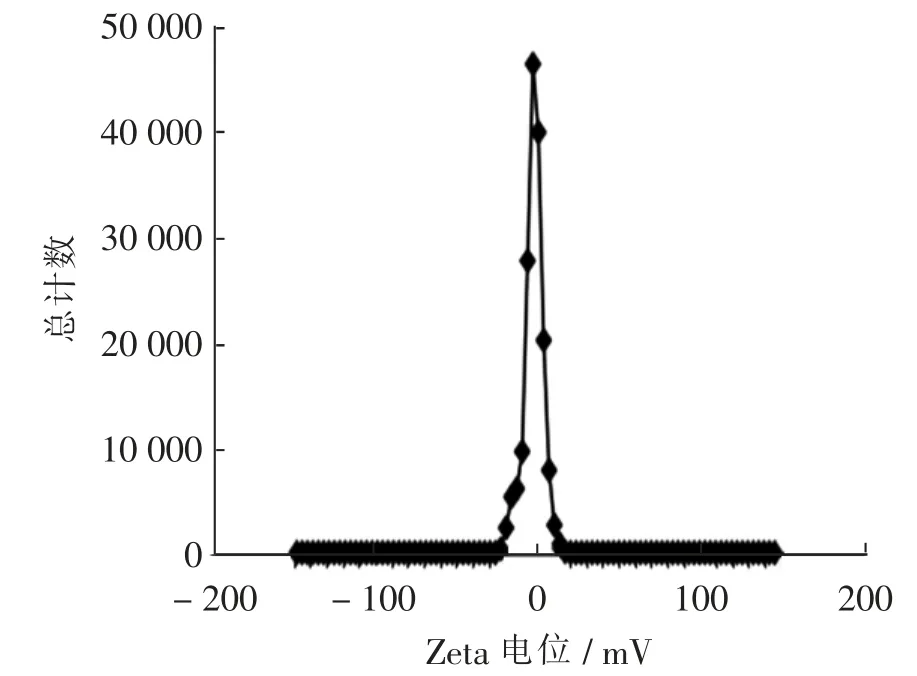
图5 动态激光散射仪测得纳米微泡Zeta 电位图Fig. 5 Zeta potential diagram of nanobubbles by dynamic laser scattering
2.1.4 包封率与影响因素
HMME 投入较少时,部分微球内核中空;投入较多时, 有部分游离状态的HMME 存在, 当其调节为PLGA 的0.04 倍时实验效果最佳。依据紫外分光光度计测量不同浓度HMME 与二甲基亚砜(dimethyl sulfoxide,DMSO) 配置溶液中最大吸收波长处相对应的光密度值绘制质量浓度-光密度标准曲线,由包封率计算公式(纳米微球中HMME 的含量/放入HMME 总量)×100%得到纳米微泡中HMME 的包封率为40.4%(图6)。 纳米微球在偏碱性环境中对HMME 包封状态不佳,在酸性环境中与SA 结合效率较低,当调节pH=7.4 时, 可较好包封HMME 的同时高效率结合SA。 相应激发波长下纳米微泡在激光共聚焦显微镜下表现为红色荧光(图7A、B),SA 修饰后的生物素化单抗为绿色荧光(图7C、D),两色叠加融合间接表明二者结合成功,携PD-1 单抗载增效剂纳米粒呈黄色荧光(图7E、F)。

图6 紫外分光光度计测量后绘制HMME 浓度-光密度标准曲线图Fig.6 Standard curve of HMME concentration-optical density after measurement by ultraviolet spectrophotometer
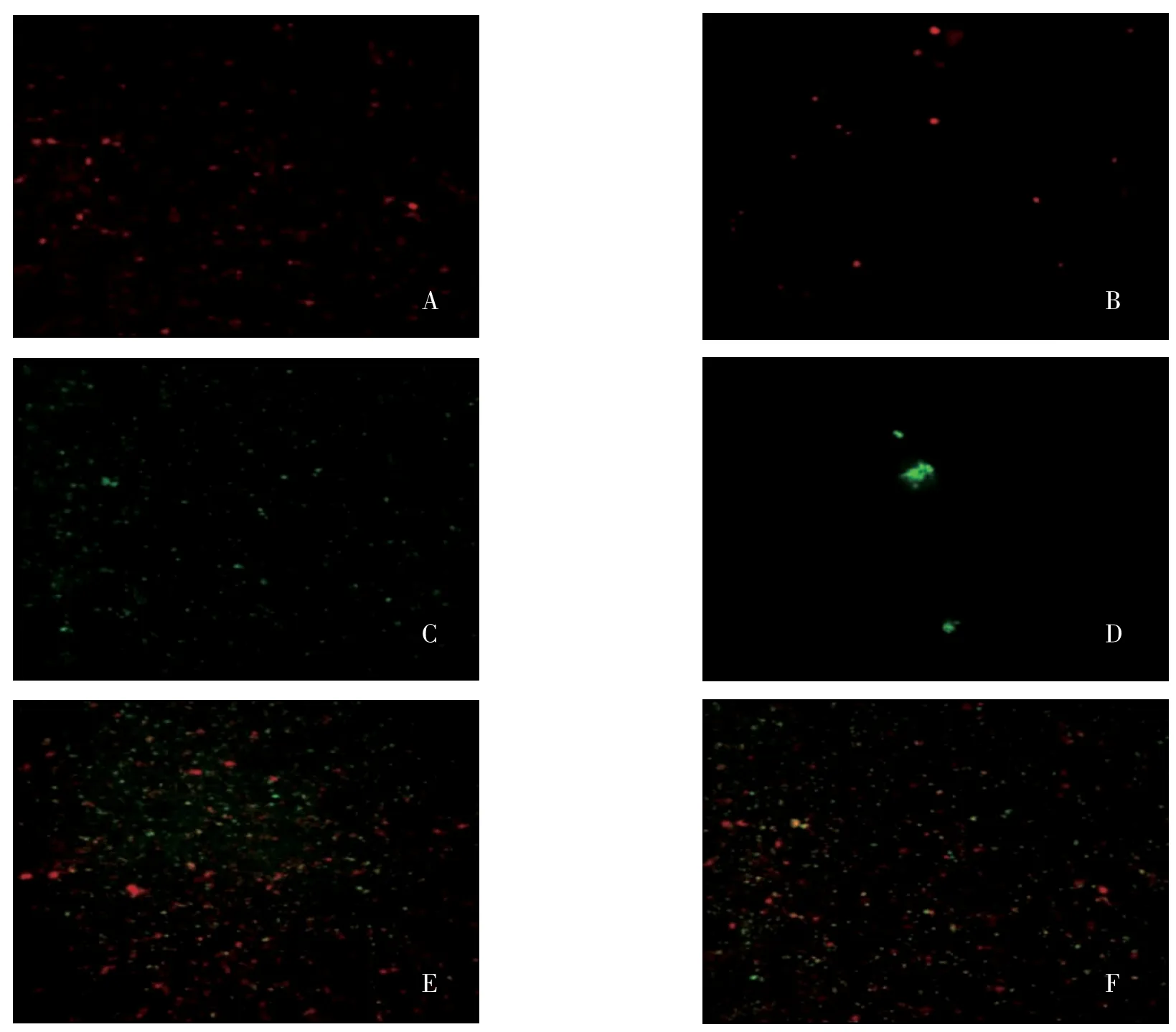
图7 携单抗前后纳米微泡激光共聚焦扫描图Fig.7 Laser confocal scanning images of nanobubbles before and after carrying monoclonal antibody
2.2 纳米微泡体外相变及声像图表现
2.2.1 纳米微泡体外相变
实验制备纳米微泡一定温度下体外超声显像均匀度不及六氟化硫微泡,但回声更强(图8)。 超声灰阶模式中随温度升高的过程中纳米微泡由少许点状等回声逐渐转变为较多的气泡样强回声,最后回声再次降低;造影模式下有相同的声像图改变过程,由少量增强至范围明显扩大,到最后减少消失。 整个变化过程中回声由低到高、增强明显由少到多的分界点在40 ℃左右(图9)。
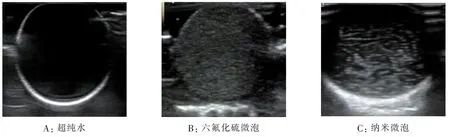
图8 室温恒温状态体外超声灰阶模式下纳米微泡、六氟化硫微泡及超纯水声像图对比Fig.8 Comparison of ultrasound images of nanobubbles,sulfur hexafluoride microbubbles and ultrapure water in vitro at room temperature by ultrasonic gray-scale mode

图9 温度升高过程中纳米微泡声像图变化过程Fig.9 Ultrasonographic changes of nanobubbles during temperature rising
2.2.2 体外超声显像效果
纳米微泡随温度升高发生相变形成直径更大的微泡,增强了超声显像效果;温度继续升高达一定界值(50 ℃左右),微泡破裂融合后,超声增强强度随之下降。3 组液体中纳米微球回声更强但分散性欠佳的可能原因之一是因为Zeta 电位受pH 值影响,且电位绝对值的高低与纳米微泡胶态分散的稳定性呈正相关。 当纳米微泡整体带有电荷量少,Zeta 电位绝对值越低时,纳米微泡越倾向于凝结或凝聚[5];其次HMME 的疏水性也可能导致团聚的出现。 由此可见在纳米微泡制备过程中关于材料的选择和比例调控、溶液酸碱度的调试、反应时间的控制等各个环节都至关重要。
3 讨论
超声纳米微泡造影剂基于其粒径小、穿透力强等优势,结合修饰靶向配体或抗体等载体技术,易通过组织间隙被动富集于目标靶区域,实现较好显像效果同时携带药物和基因达到载药治疗的目的。笔者通过利用生物素-亲和素复合系统稳固和反应高度专一的特性,将PD-1 单抗与超声纳米微泡进行连接,制备出携单抗超声纳米微泡。
蛋白质作为纳米微泡外壳材料进入体内后可能会发生相应的免疫反应,脂质壳膜亦会存在体循环稳定性差、半衰期短、载药能力不足等问题,笔者选高分子聚合物PLGA 作为微球壳膜,其成膜性、生物相容性好且无毒,以及可进行生物降解等特点,使微泡能保持较好的稳定性,同时在通过调节聚合物比例间接调整微泡降解速率方面占据一定优势。基于其安全高效的特性,可作为生物材料在超声造影领域及临床发挥作用。
笔者实验HMME 被包裹于PLGA 壳膜内表现为透射电子显微镜下的黑色类球形结构。 HMME 投入比例略低时,只被包载于部分PLGA 壳膜内,还可见内核中空的微球;HMME 投入比例较高时,无法全部被包裹入壳膜内,激光共聚焦显微镜视野内的红色荧光可能有部分游离状态的HMME 存在。 多次调试二者比例保持在1:25 左右时有较好的饱和状态,测得HMME 的包封率约为40.4%。
笔者实验对纳米微泡进行SA 化修饰的过程选用碳二亚胺法,利用EDC/NHS 作为交联剂可提高壳膜柔韧性[6]的特点,同时将二者作为PLGA 末端羧基的活化剂参与酰胺的合成过程,与SA 上的氨基共同结合后形成稳定的酯键。
实验过程中发现当纳米微泡分散于MES Buffer pH 8 的偏碱性环境中,溶液的颜色状态,以及激光共聚焦显微镜下的观察和包封率检测提示微泡中HMME 包封情况欠佳, 可能原因之一是含有PLGA末端羧基的壳膜在碱性环境中对HMME 的包封能力受到影响;当MES Buffer 呈酸性时,SA 上氨基的部分结合位点会被占用,从而降低与微泡中PLGA 末端羧基的结合效率。 重新调试MES Buffer 的酸碱度发现,当pH 值为7.4 时可以较好地平衡HMME 的包封状态及SA 的结合效率。
抗体与纳米微泡的连接常采用直接法和间接法,前者通过化学键桥接或电荷吸附,稳定性欠佳;后者主要利用生物素-亲和素复合系统。生物素上有与SA连接的结合位点咪唑酮环,SA 有4 个可与生物素分子结合的亚基色氨酸残基, 二者依靠高于抗原抗体54 100 万倍的结合力以4 ∶1 的比例发生共价反应,亲和力极强。 笔者实验被生物素化的PD-1 抗与SA化的PLGA 纳米微泡基于此方式连接形成以不易受酸碱等理化因素干扰为优势的稳固的PD-1 单抗-生物素-亲和素系统[7]。
HMME 在激光共聚焦显微镜相应激发波长下显现红色荧光,被荧光素异硫氰酸酯FITC 标记的链霉亲和素(FITC-SA)呈现绿色荧光。 选用有不同截留相对分子质量的半透膜透析袋过滤掉PD-1 单抗生物素化过程中多余未反应的生物素酯,再加入FITC-SA参与反应并过滤掉多余的FITC-SA,生物素与SA 的成功结合表现为激光共聚焦显微镜下的绿色单荧光,同时间接说明PD-1 单抗已被生物素化。 SA 上的氨基与载HMME 纳米粒中PLGA 的末端羧基结后合形成稳定的酯键, 双色叠加融合最终表现为黄色荧光,间接表明携PD-1 单抗载HMME 纳米粒成功制备。笔者研究中FITC-SA 可同时作为实验及验证材料参与制备和检验过程,通过生物素亲和素间稳定专一的连接方式,在完成对PD-1 单抗生物素化初步验证的同时完成携PD-1 单抗载增效剂纳米微泡的制备过程。
液态氟碳作为超声纳米造影剂内核时具有较好的稳定性是基于其生物学惰性[2,8],只有达到触发条件时可进行液气相转变,空化效应产生的大量微气泡增大与周围组织的声阻抗差,达到较好的显像效果。 全氟己烷(perfluorohexane,PFH)属于液态氟碳常见分类之一,由于其本身具有较高的沸点,达到微球相变所需更高温度及能量时易造成周围组织的损伤和凝固性732 坏死。而全氟戊烷(Perfluoropentane,PFP)沸点及相变温度均较低, 笔者实验中40 ℃左右开始实现高效率显像。
PFP 微球相变温度高于其沸点受拉普拉斯压力及液态氟碳微球外壳界面的表面张力等因素的影响;且由于泊松压力的存在,相变触发温度的高低与微球直径的大小呈反相关[9],同时由于液体黏度的存在,相变发生需要满足的前提条件之一是PFP 微球初始直径达到某一界值[10]。笔者实验中PFP 微球在室温条件下保持相对稳定的状态,当达到阈值温度发生相变后原尺寸会增大至5 ~6 倍[11],微泡数量增加达峰值,超声图像上的灰度也到达峰值,一定范围内随温度升高进行增大、聚集、融合、破裂的系列过程,随后回声强度逐渐减弱,造影模式有着同样的变化趋势,直至相变过程完成。 此外纳米微泡的组成物质及构成比例[12~15],以及超声辐照装置在声致相变时关于系统、图像及探头等技术参数如超声波频率、声强的选择均可影响相变过程。
对HMME 进行靶向修饰可使其在目标微环境中保持较高浓度,被相应光、声源激发后,通过产生的光毒性或单线态氧等活性氧自由基带来的细胞毒性[16],在增强超声显像效果的同时起到靶向杀伤作用。由于HMME 本身疏水性而发生团聚对超声显像效果的负面影响,还需进一步探究调整纳米微球各构成成分与HMME 之间的混合比例及方式,在实现HMME 作为增效剂的优势被运用的同时,改善不均匀增强的现象。
综上所述,笔者通过实验初步对携单抗载增效剂超声纳米微泡制备的实验条件及验证方式进行了探索与研究,利用生物素-亲和素复合系统高稳定性的前提下可以保持所连接分子生物活性的优势,依靠单抗在体内特异性结合相应的靶点抗原,促使靶向性的超声纳米粒到达目标微环境发挥作用,以期为靶向超声造影剂的制备提供新思路,为后续体内实验及治疗研究做铺垫。
(利益冲突声明: 所有作者均声明不存在利益冲突)
