L-抗坏血酸促进人胚胎干细胞向心肌细胞分化的研究
2023-11-18张海鹏李慧丽张梦珍李晓红
陈 景,邱 敏,张海鹏,李慧丽,张梦珍,李晓红
心肌梗死引起大量的心肌细胞死亡而导致的充血性心力衰竭是心血管疾病的主要死因。日新月异的临床治疗方案尚未能从根本上彻底解决心肌损伤后不能再生的难题。大量研究[1~3]表明,多种类型的干细胞均有心肌分化的潜力。干细胞向心肌分化取得了一定的成果, 但目前常用的分化试剂价格非常高昂,成分复杂,在一定限度上制约了心肌分化研究的临床转化。L-抗坏血酸(L-ascorbic acid,VitC)是一种价格便宜且容易获得的维生素, 笔者通过探讨VitC 在人胚胎干细胞(human embryonic stem cell,hESC)心肌分化中的作用,明确其达到最大分化效率时的最佳浓度,得到成分明确且高效心肌分化试剂, 以利于将来大规模临床推广运用。
1 材料与方法
1.1 实验材料
1.1.1 实验细胞
hESC 来源于北京赛贝公司。
1.1.2 主要试剂
人干细胞复苏培养液、人干细胞培养液(E8)、消化液乙二胺四乙酸 (ethylenedinitrilotetraacetic acid,EDTA)(北京赛贝公司,中国)。
VitC、6-((2-((4-(2,4-二氯苯基)-5-(5-甲基-1H-咪唑-2-基)嘧啶-2-基)氨基)乙基)氨基)烟腈三盐酸盐(6-((2-((4-(2,4-Dichlorophenyl)-5-(5-methyl-1Himidazol-2-yl)pyrimidin-2-yl)amino)ethyl)amino)nicotinonitrile trihydrochloride,Chir99021)、 二甲基亚砜(dimethyl sulphoxide,DMSO)、含4,6-二氨基-2-苯基吲哚 (4,6-diamino-2-phenyl indole,DAPI) 封片剂(Sigma, 美国);N-(6-甲基苯并[d] 噻唑-2-基)-2-((4-氧代-3-苯基-3,4,6,7-四氢噻吩并[3,2-d]嘧啶-2-基)硫基)乙酰胺(N-(6-methyl-1,3-benzothiazol-2-yl)-2-((4-oxo-3-phenyl-6,7-dihydrothieno[3,2 -d]pyrimidin -2 -yl)sulfanyl)acetamide,IWP -2)(Selleck,美国);磷酸盐缓冲溶液(phosphate buffered saline,PBS)、RPMI 1640 培养液、B27(Gibco,美国);低生长因子 (growth factor reduced,GFR) 基质胶(Corning, 美国);RNA 提取试剂Trizol、Alexa Fluro 488 标记的山羊抗兔和Alexa Fluro 594 标记的山羊抗鼠荧光二抗(Invertogen,美国);一抗Nanog、心肌肌钙蛋白(cardiac troponin T,cTnT)和心脏特异性同源盒转录因子 (Nk2 homeobox 5,Nkx2.5)(1 ∶50) 抗体(Abcam, 美国);PrimeScriptTMRT reagent Kit(Perfect Real Time) 试剂与TB Green®Premix Ex TaqTMII(Tli RNaseH Plus)试剂(Takara,中国)。 引物合成由英潍捷基公司完成(序列见实验方法)。
1.1.3 仪器设备
二氧化碳培养箱(Thermo forma 3111,美国);超净工作台(SW-CJ-1FD,中国);倒置相差显微镜(Leica DMil,美国);正置荧光显微镜(Nikon 88i,德国);小型冷冻台式离心机(Eppenddorf,德国);实时荧光定量聚合酶链式反应 (real-time quantitative polymerase chain reaction,RT-qPCR)仪(AppliedB-biosystems ViVA7,美国);梯度PCR 仪(LIFE SimpliAmp,新加坡);普通冰箱(海尔,中国);超低温冰箱(Thermo forma,美国);液氮罐(Thermo Electron,美国);多功能酶标仪(Multiskan GO,美国);电子分析天平(电子JA 1003,中国);制冰机(SIM-F104AY65,日本);漩涡振荡器(Thermo fisher Maxi MIX II,美国);风热式电热干燥箱(GNP-9080,中国);高压蒸汽灭菌锅(MLS-3780 SANYO,日本);电动移液枪(Brand,德国);手持移液器(Eppenddorf,德国)
1.2 方法
1.2.1 干细胞培养
从液氮罐中取出1 支冻存的hESC,在37 ℃水浴锅内左右摇晃使其迅速融化; 加入到含有3 mL 人干细胞复苏培养液的离心管中, 于200 g 条件下离心5 min,吸去上清液;加入5 mL 复苏培养液,重悬后加到预先用GFR(1 ∶100)包被好的培养瓶中,48 h 后换E8 培养液进行培养,待细胞密度为70%~80%时用EDTA 消化后以团块传代。
1.2.2 诱导与分化
待hESC 培养至90 %汇合度后, 分别在RPMI 1640 中加入0、10、20、30、40、50、60、70 μmol/L VitC的基础培养液,用带有联合Chir99021(6 μmol/L)进行诱导分化,2 d 后将Chir99021 替换成Wnt 信号抑制剂IWP-2(5 μmol/L),与不同浓度的VitC 联合进行诱导分化,2 d 后再更换为2 % B27 与不同浓度VitC 联合诱导,并隔天换液维持。
1.2.3 光学显微镜观察
hESC 加入诱导分化培养液后, 每天在光学显微镜下观察细胞的分化状态, 观察不同浓度VitC 对分化效果的影响,并记录下自发跳动心肌细胞出现的最早时间,对出现跳动的区域进行显微录像。
1.2.4 实时荧光定量聚合酶链式反应检测各基因的表达
分别收集诱导分化后第0 天、第2 天、第4 天、第6 天、第8 天和第10 天的心肌细胞,用Trizol 裂解法提取总RNA。 用PrimeScriptTMRT reagent Kit 进行反转录, 得到cDNA 模板。 使用TB Green®Premix Ex TaqTMⅡ试剂盒在实时荧光定量PCR 仪ABI VIVA7进行,扩增基因:同源盒转录因子基因(homeobox protein gene,Nanog), 性别决定因子同源盒2 基因(sex determining region Y-box2 gene,Sox2),心肌肌钙蛋白T 基因(cardiac troponin T gene,cTnT),心脏特异性同源盒转录因子基因(Nk2 homeobox 5 jene,Nkx2.5),甘油醛-3-磷酸脱氢酶基因 (glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参。
相关基因引物序列:Nanog正向5′-CAATGGTGTGACGCAGAAGG-3′, 反向5′-GAAGGTTCCCAGT -CGGGTTC-3′;SOX2正向5′-AGAGAAAACCTGG -GAGGGT-3′,反向5′-GCAAAGCTCCTACCGTACCA-3′;cTnT正向5′-GACAGAGCGGAAAAGTGGGA-3′,反向5′-CTCCTTGGCCTTCTCCCTCA-3′;Nkx2.5正向5′-CAAGTGTGCGTCTGCCTTTC-3′, 反向5′-CG CACAGCTCTTTCTTTTCGG-3′;GAPDH正向5′-GGAGCGAGATCCCTCCAAAAT-3′,反向5′-GGCTGTTGTCATACTTCTCATGG-3′。
1.2.5 免疫荧光
在铺有盖玻片的24 孔板中接种hESC,待其长至80%进行诱导分化。 在诱导分化后第0 天、第2 天、第4 天、第6 天、第8 天和第10 天收集细胞,用新鲜配制的4%多聚甲醛溶液固定细胞20 min,1 X PBS洗3 遍,每次5 min。 用0.2 % Triton X-100(PBS 配制)对细胞通透化处理20 min,1 X PBS 洗3 遍,每次5 min。 4%牛血清白蛋白(albumin from bovine serum,BSA) 封闭45 min。 加入一抗Nanog、cTnT 和Nkx2.5(1 ∶50),4 ℃条件下孵育过夜,PBS 洗3 遍,每次5 min。加入Alexa Fluro 488 标记的山羊抗兔和Alexa Fluro 594 标记的山羊抗鼠荧光二抗,室温避光孵育1 h,用PBS 洗3 遍,每次5 min。 加入含DAPI 封片剂,在激光共聚焦扫描显微镜下观察拍照。
1.3 统计学方法
计量资料以均数± 标准差表示, 采用SPSS 16.0统计软件进行处理。多样本均数间比较采用单因素方差分析(One way ANOVA), 组间比较采用Dunnettt或LSD 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 人胚胎干细胞的细胞形态及鉴定
hESC 呈克隆样生长,团块边缘整齐,胞核大,细胞间排列紧密,细胞间界限不清(图1A)。免疫荧光染色鉴定干细胞标志物Nanog 为强阳性(图1B。绿色为Nanog,蓝色为细胞核)。

图1 hESC 的形态和标志蛋白Nanog 的检测Fig.1 Images of hESC morphology and marker protein Nanog dection
2.2 人胚胎干细胞在不同浓度VitC 诱导下的观察
hESC 分化第3 天,在没有VitC 的培养液中开始发生大面积的脱落死亡(图2A);随着VitC 浓度的逐渐增加, 细胞贴壁的数量越来越多 (图2B、2C),到VitC 浓度为30 μmol/L 时,细胞已可维持正常生长并开始出现小规模克隆团块 (图2D); 这种现象随着VitC 浓度的增加而增多(图2E、F),并逐渐演变为大面积的克隆样生长团块(图2G、H)。
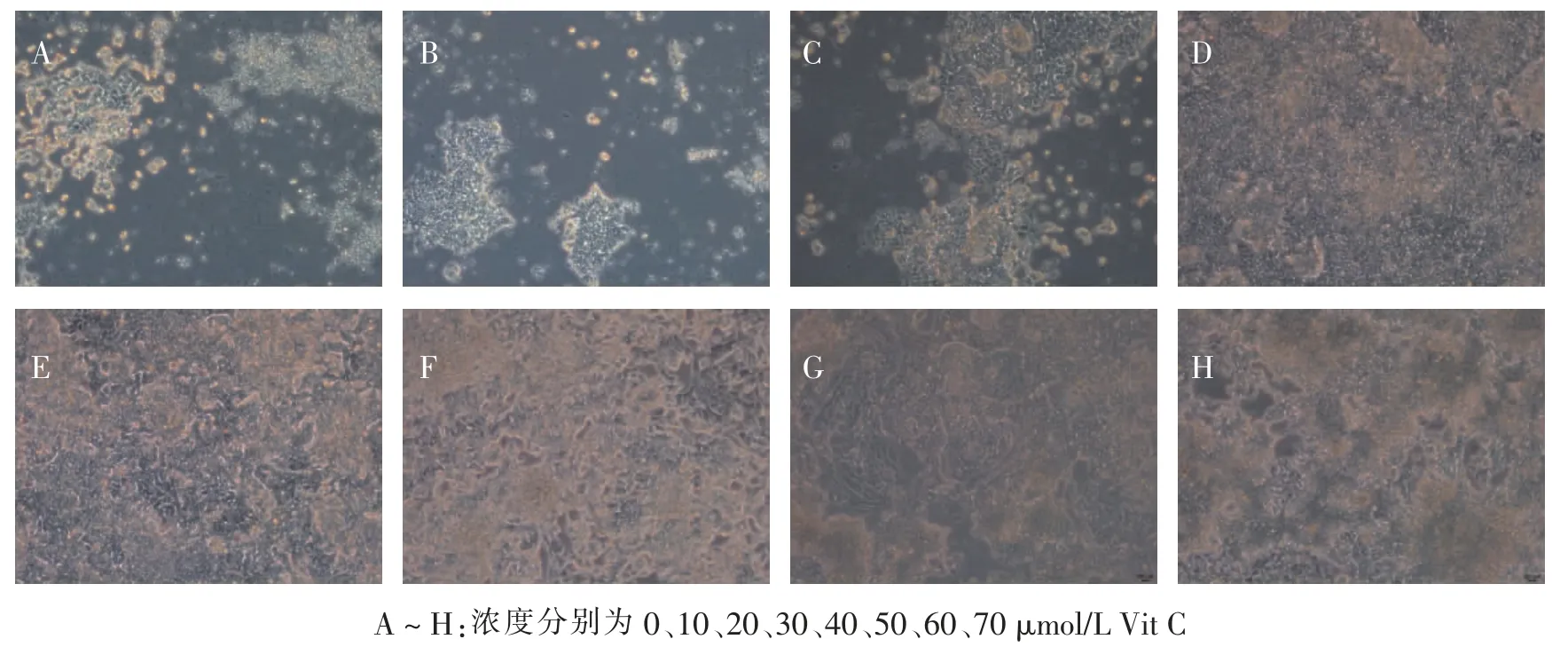
图2 hESC 向心肌分化第3 天不同浓度VitC 的影响光学显微镜观察(标尺=200 μm)Fig.2 Images of different concentration of VitC on 3rd day of hESC differentiation into cardiomyocytes by optical microscope(scale bar =200 μm)
2.3 人胚胎干细胞在VitC 浓度为40 ~70 μmol/L诱导下的观察
hESC 分化第8 天,出现自发跳动的细胞团。在VitC 40、50 μmol/L 浓度组可见某些细胞团连成片呈波浪样跳动(图3A、B),当VitC 浓度增加到60、70μmol/L 后,搏动的细胞团块变少,搏动的频率也越来越低(图3C、D)。
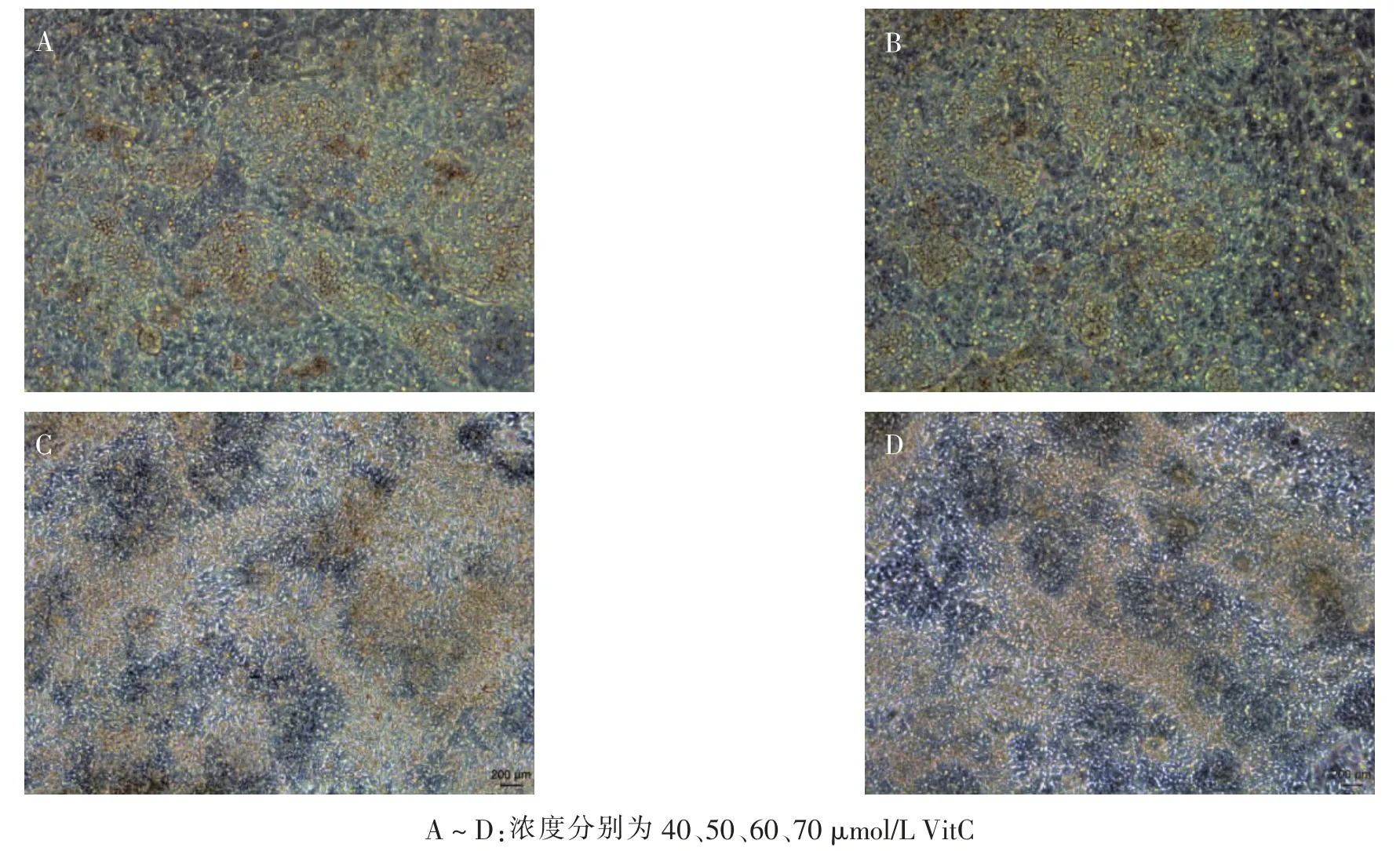
图3 不同浓度VitC 对第8 天心肌细胞搏动的影响(标尺=200 μm)Fig.3 Images of different VitC concentrations on cardiomyocytes beating at 8-day(scale bar=200 μm)
2.4 心肌细胞的鉴定
2.4.1 诱导后细胞的形态学变化
细胞出现明显的肌丝,相邻细胞互相融合成网状结构(图4A),细胞与细胞之间重叠融合形成“竹节状”肌节(图4B)。

图4 光学显微镜下分化的心肌样细胞形态(标尺=200 μm)Fig.4 Images of differentiated cardiomyocyte-like cells morphology by optical microscope(scale bar=200 μm)
2.4.2 诱导后细胞Nanog、Sox2、cTnT 和Nkx2.5 mRNA的表达
以VitC 40、50、60、70 μmol/L 浓度诱导hESC 进行分组,各组内参GAPDH为恒定的表达,Nanog、Sox2、cTnT 和Nkx2.5 mRNA 均呈现单一的溶解峰,说明各引物的特异性良好, 无非特异性扩增和引物二聚体干扰。VitC 诱导后,与不使用VitC 组相比,hESC 标志物Nanog mRNA 在第2 天出现短暂而轻微的升高,50 μmol/L 组与60 μmol/L 组、70 μmol/L 组差异有统计学意义(P=0.009、0.017);随着分化时间的延长,Nanog mRNA 表达量逐渐下降,至分化第10 天时候,40μmol/L组与60 μmol/L 组和70 μmol/L 组相比, 差异具有统计学意义 (P= 0.013、0.027);Sox2 mRNA 在各诱导组均表达下降, 而50 μmol/L 组在第6 天出现Sox2 mRNA 陡然升高,原因尚不清楚,其余时间点均呈下降趋势;在分化第8 天时,40 μmol/L 组与60 μmol/L组相比有明显变化(P=0.044)。相比对照组和VitC 其他浓度组,心肌标志物cTnT mRNA 在分化第8 天时40 μmol/L 组与其他3 组相比, 表达明显升高 (P=0.047、0.023、0.024),至分化第10 天时,40 μmol/L 组与60 μmol/L 组和70 μmol/L 组差异依旧明显(P=0.031、0.022), 而40 μmol/L 组与50 μmol/L 组、 60 μmol/L组与70 μmol/L 组组间差异无统计学意义(P>0.05)。心脏转录因子Nkx2.5 mRNA 在第10 天的表达,则表明40、50 μmol/L 组与60、70 μmol/L 组差异有显著统计学意义(P=0.001、0.001),40 μmol/L 组与50 μmol/L组组间差异无统计学意义(P>0.05)。 见图5。
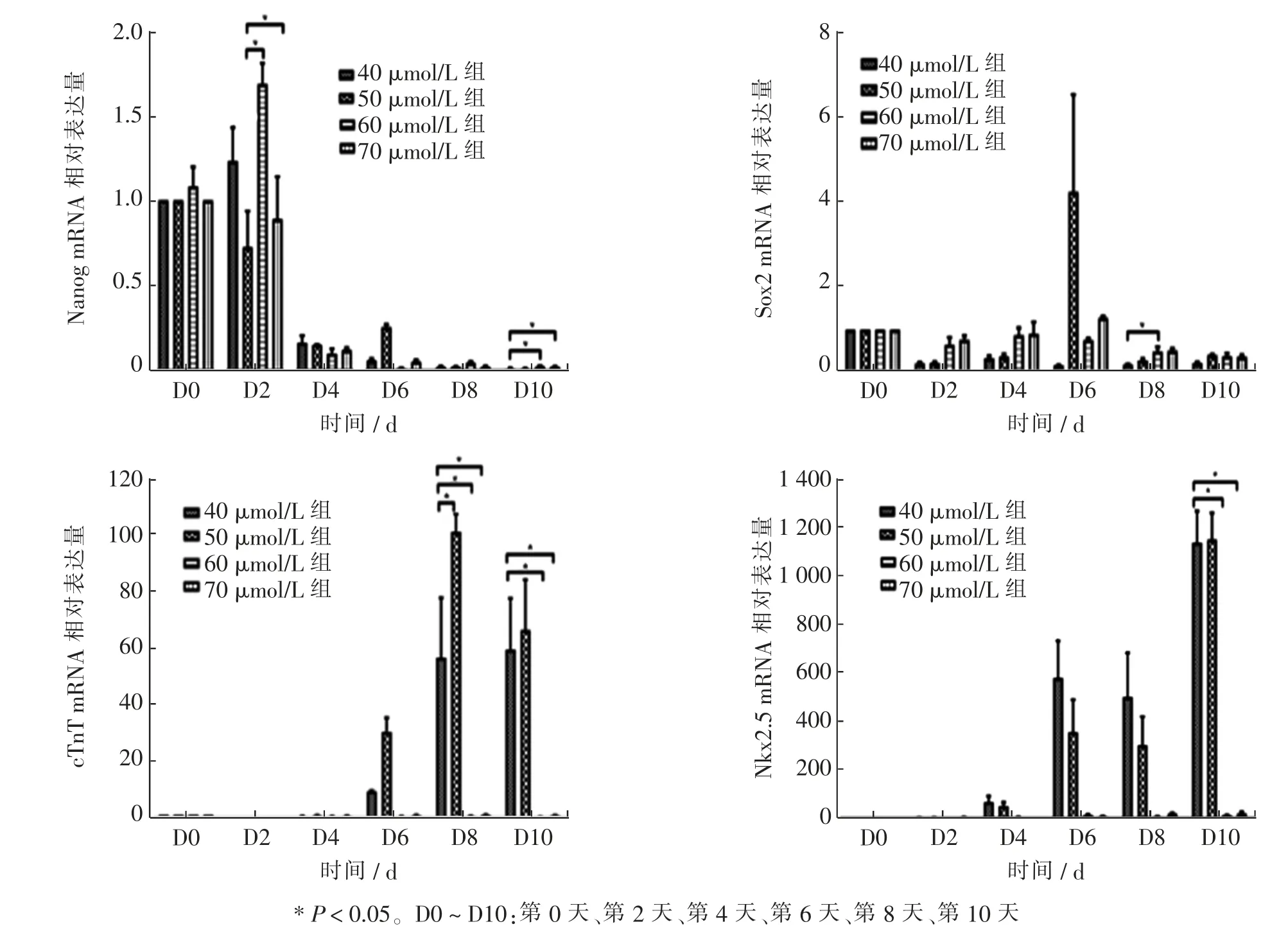
图5 不同浓度组VitC 诱导hESC 分化为心肌细胞内Nanog、Sox2、CTnT 和Nkx2.5 mRNA 的表达柱状图Fig.5 Histograms of Nanog,Sox2,CTnT and Nkx2.5 mRNA expression in cardiomyocytes induced by different concentrations of VitC
2.4.3 免疫荧光鉴定
免疫荧光法检测显示VitC 浓度为40 μmol/L 组和50 μmol/L 组分化得到的心肌样细胞与对照组(VitC 浓度0 μmol/L) 相比低表达干细胞的特异性标志物Nanog, 其荧光强度差异有显著统计学意义(5.469 7 ± 0.466 1、10.161 3 ± 0.940 2vs12.816 3 ±0.489 3。P= 0.007、0.006), 而40 μmol/L 组与50 μmol/L 组组间差异无统计学意义(P>0.05)。 心肌特异性标志物cTnT 表达的对照组与40 μmol/L 组相比,荧光强度差异有显著统计学意义 (7.680 3±2.052 1vs20.543 0±2.052 4。P=0.004),而40 μmol/L 组与50 μmol/L 组组间差异也有统计学意义 (20.543 0 ±2.052 4vs10.472 0±0.577 4。P=0.02)。 Nkx2.5 的表达, 与对照组相比, 无论是40 μmol/L 组还是50 μmol/L 组,其荧光强度差异均有显著统计学意义(24.529 3 ± 1.974 3、26.093 3 ± 2.078 2vs11.057 7 ±0.772 4。P=0.007、0.006),而40 μmol/L 组与50 μmol/L组组间差异无统计学意义(P>0.05)。 见图6 ~8。
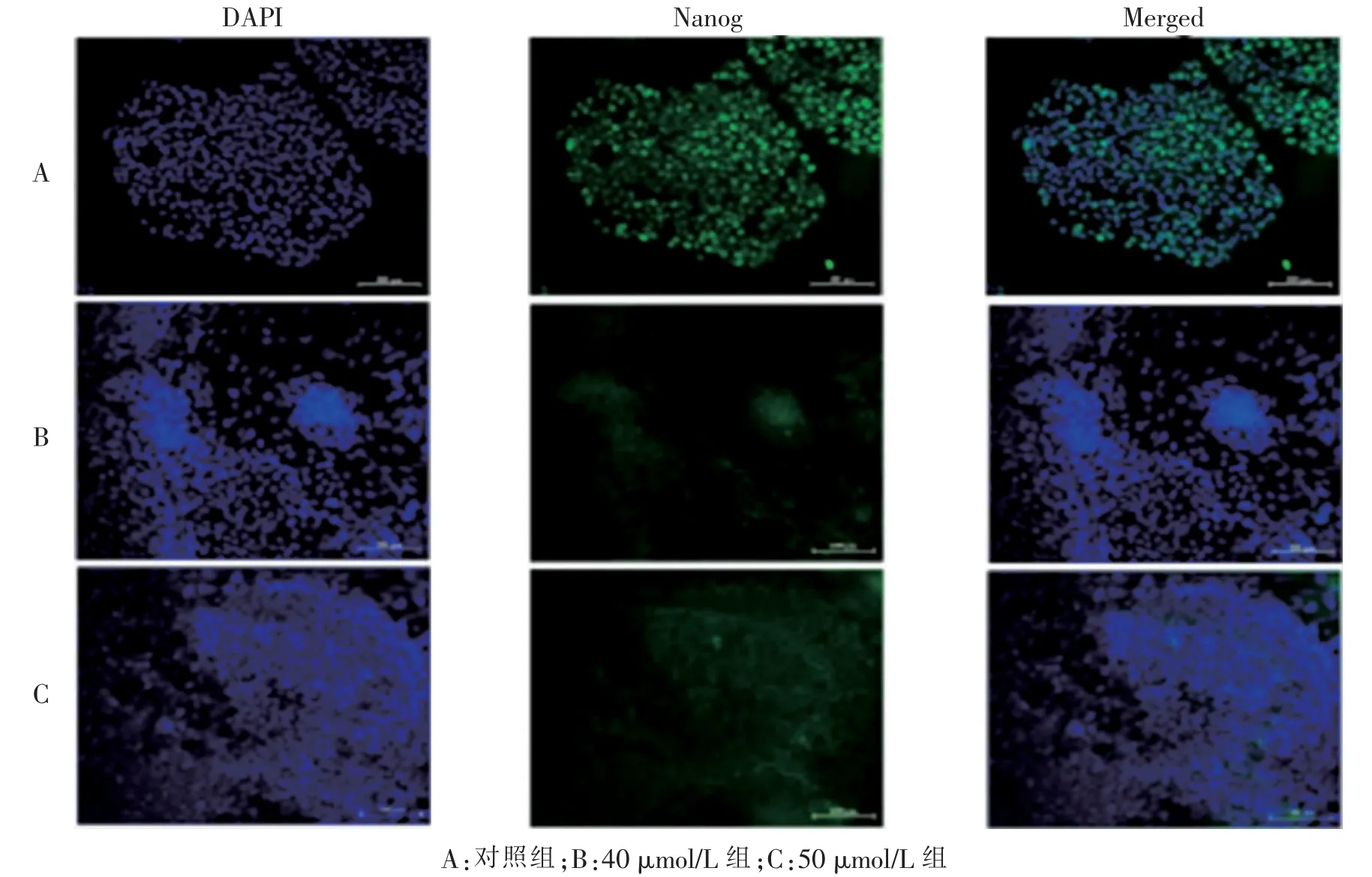
图6 免疫荧光检测心肌样细胞Nanog(标尺=100 μm)Fig.6 Immunofluorescence staining images of Nanog in cardiac-like cells(scale bar=100 μm)
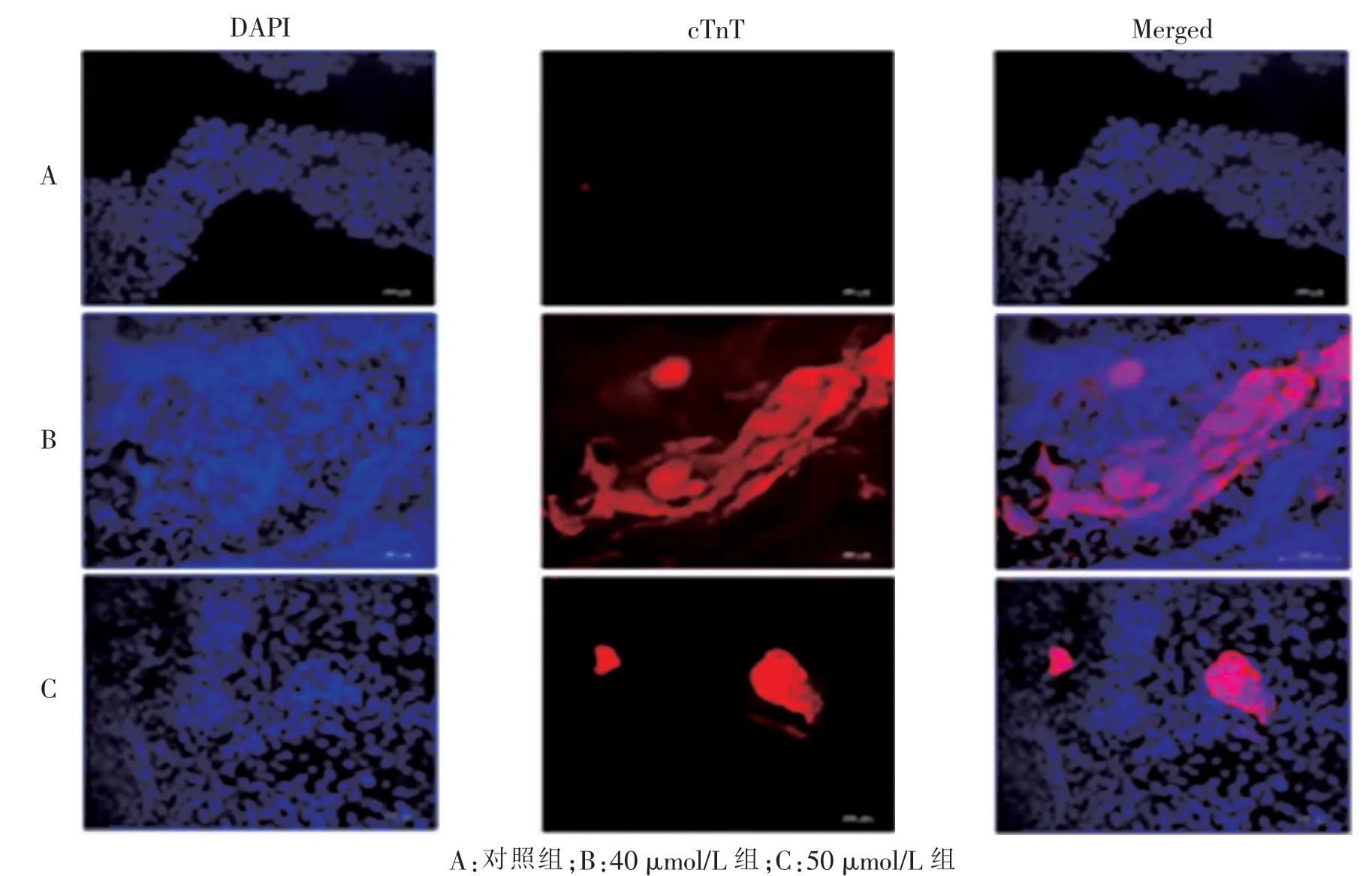
图7 免疫荧光检测心肌样细胞cTnT(标尺=100 μm)Fig.7 Immunofluorescence staining images of cTnT in cardiac-like cells(scale bar=100 μm)
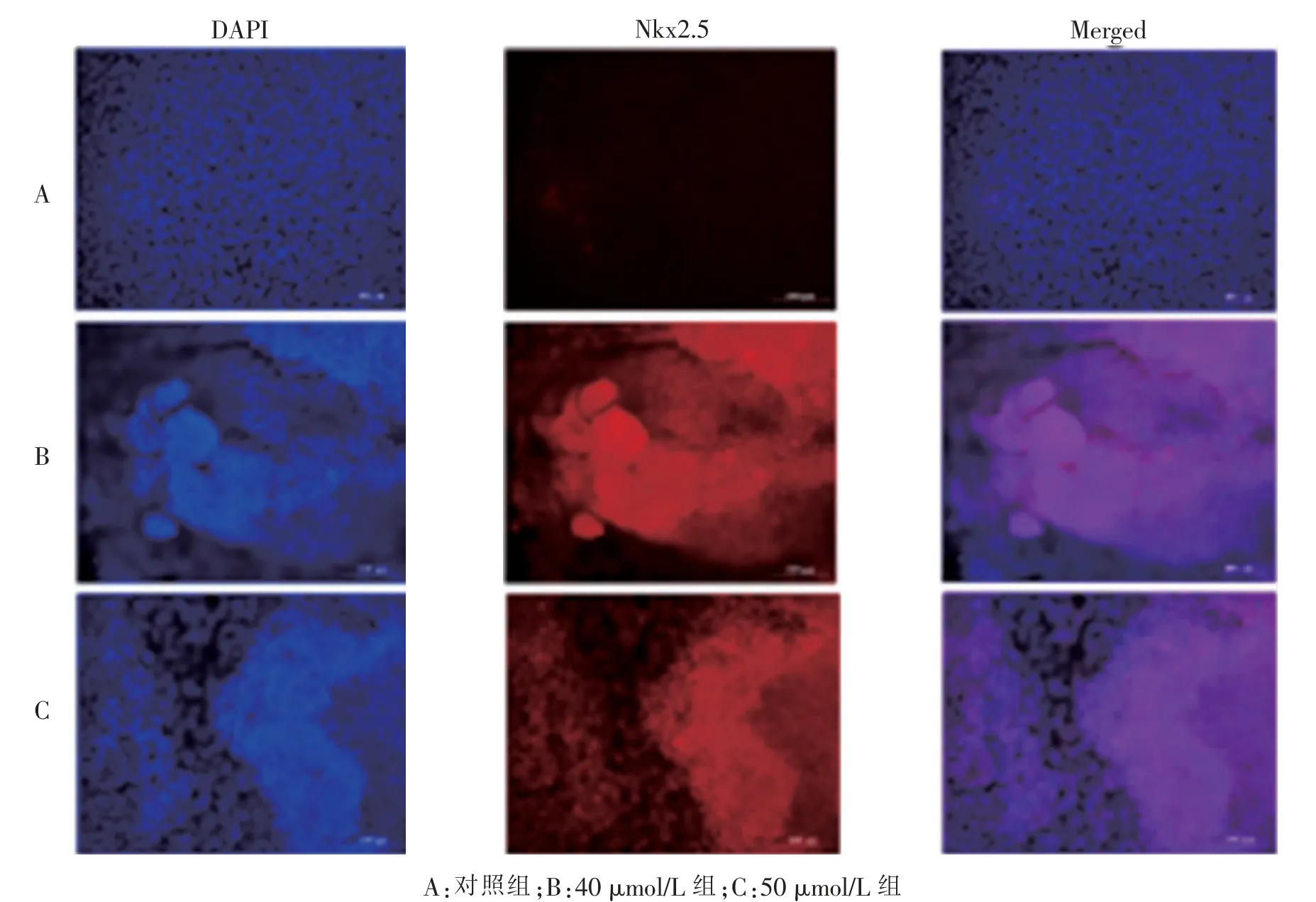
图8 免疫荧光检测心肌样细胞Nkx2.5(标尺=100 μm)Fig.8 Immunofluorescence staining images of Nkx2.5 in cardiac-like cells(scale bar=100 μm)
3 讨论
迄今为止, 研究干细胞向心肌分化已发展将近20 年。 2001 年Kehat I 及其同事[4]首次报道一种通过拟胚体(embryoid body,EB)来分化心肌细胞的方法,但该方法心肌分化效率非常低,只有不到8.1%的细胞能成功转化为跳动的心肌细胞。后来科学家们利用细胞因子激活素A(cytokine activin A,Activin A)和骨形态发生蛋白4(bone morphogenetic protein 4,BMP4)对干细胞进行分化,相比EB 法,这种分化方式具有更高的效率,但该方法仅能在某些人类多能干细胞系中起作用[5],且细胞因子高昂的价格也阻滞了它的发展运用。 后续有研究者发现Wnt/β-Catenin 信号传导抑制剂能进一步更有效诱导胚胎干细胞(embryonic stem cell,ESC)向心肌细胞分化[6~8]。 也有的研究采用病毒过表达转录因子、细胞因子或者microRNA 等进行心肌的诱导分化[9~11]。而从多种多样的诱导方案中,积极寻找高效、简便的诱导分化剂成为目前人们关注的焦点。
抗坏血酸也称维生素C(VitC),是一种人类无法自身合成、只能通过食物摄取的必需营养素。 一方面VitC 是许多酶的重要辅助因子, 它能通过调节DNA的合成和组蛋白羟化酶的活性来修改干细胞的表观遗传学/基因表达谱, 从而影响细胞外基质(extracellular matrix,ECM)的稳态[12],也能通过DNA 甲基化、转录谱和能量代谢影响ESC 的多能性[13]。 另一方面VitC 对干细胞增殖和分化也具有重要影响。 VitC 能通过增强γδ T 细胞的增殖和效应子功能影响T 细胞的分化[14],也可刺激人牙髓干细胞(human deciduous pulp stem cell,HDPSC) 体外增殖及激活分化潜能[15],还可促进精原干细胞增殖和降低其活性氧(reactive oxygen species,ROS)的产生[16]。 有研究发现,VitC 不仅能通过促进胶原蛋白合成,促使诱导性多能干细胞(induced pluripotent stem cells,iPSC)/hESC 来源的神经上皮样干细胞的生成和分化[17],还能增加高表达蛋白TRF1 的诱导性多能干细胞 (induced pluripotent stem cells with high expression of the shelterin-complex protein TRF1,iPSChighT) 分化的心肌细胞数量[18]。Choi SC 等[19]利用成纤维细胞生长因子4(fibroblast growth factor 4,FGF4)和VitC 分化hESC 来源的心肌细胞成功建立一种体外缺氧应激模型。 而Perino MG等[20]则认为VitC 可能是通过激活母亲DPP 同源物1(果蝇)[mothers against DPP homolog 1(Drosophila),SMAD1]通路促进ESC 向心肌细胞分化。
笔者的研究在已有的诱导分化方案上进行简化,采用分化效果明确的化学小分子化合物Chir99021及IWP-2 联合不同浓度的VitC,探索在ESC 的心肌诱导方案中VitC 是否必须及发挥作用最合适的浓度范围。
笔者研究将hESC 培养到90%时,分别用含有不同浓度VitC 序贯联合化学小分子Chir99021 及IWP-2 进行分化培养,在分化过程中发现不含VitC 的培养组细胞大面积死亡,随着VitC 浓度逐渐增高,细胞死亡数量逐渐下降。这表明VitC 是这个诱导分化组合中不可或缺的因子。 研究结果显示,随着分化时间的延长, 干细胞标志物Nanog 的表达量逐渐下降,VitC 40 μmol/L 组比50、60、70 μmol/L 组Sox2 的表达更快降低。 心肌标志物Nkx2.5、cTnTmRNA 表达水平在VitC 40 μmol/L 组和50 μmol/L 组要远远高于60 μmol/L 组和70 μmol/L 组。 在免疫荧光检测中也看到同样的趋势。笔者的结果进一步表明,Nanog 的表达量随着分化天数逐渐下降,而Nkx2.5、cTnT 的表达量逐渐增加。
综上所述,hESC 分化为心肌细胞过程中,可观察到唯有浓度 40 μmol/L 和 50 μmol/L VitC 与Chir99021 及IWP-2 的组合分化方案才能成功且高效诱导hESC 向心肌细胞分化, 且VitC 工作浓度为40 μmol/L 时能获得最佳分化效果,而VitC 在这个诱导分化组合中的具体作用机制尚需进一步的研究。
