明胶胶囊中醛基的测定研究与应用
2023-11-15徐雅婷金孔语恬沈晨栋凌宗涛董华平寿建昕朱帅辉
徐雅婷,金孔语恬,沈晨栋,凌宗涛,崔 迎,董华平,寿建昕,朱帅辉,骆 翔*
(1.绍兴文理学院,浙江 绍兴 312000;2.浙江华光胶囊股份有限公司,浙江 绍兴 312500)
明胶是胶原降解的产物之一,明胶中含量较多的氨基酸依次为精氨酸、赖氨酸和组氨酸[1]。食用级的药用明胶与适宜的辅料按一定比例和方法可制备明胶胶囊[2]。明胶胶囊是用途广泛的一种药用辅料。近年来,胶囊生产能力和技术水平得到很大提升,产品种类不断丰富,胶囊企业逐渐向自动化、规模化方向发展。但是,企业对于胶囊处方的研究和改良一直停滞不前,胶囊的质量和附加值得不到提升,阻碍了胶囊剂的安全性、稳定性和生物有效性的提高,面临着药品一致性评价失败的风险。明胶胶囊在潮湿的环境中,特别是在氧气与水分共同作用下易变质[3]。明胶的交联使胶囊的溶解性质发生变化,如崩解时间延长。明胶交联是目前胶囊生产过程中所面临的主要问题之一[4-7]。明胶胶囊交联反应后生成致密的交联网状结构,致使胶囊难崩解、溶出度下降、药物释放较慢和生物利用度降低[8]。为此,开发新型抗交联的明胶胶囊是目前胶囊产业中亟需解决的关键问题之一。国内外研究者试图采用其他材料代替明胶或者加入抗氧化剂等方法来解决明胶胶囊的交联问题[9-10]。因此,明胶胶囊的抗氧化处理、检测抗氧化能力和提高胶囊保存时长等问题,对于提高企业经济效益是十分重要的。
加入适量的抗氧剂是防止食品被氧化的最方便有效的方法之一[11]。天然来源的抗氧剂因其广泛使用和廉价易得已成为食品和药品中安全常用的辅料。现已知来源的天然抗氧剂种类复杂、品种繁多,如维生素 E、维生素 C、茶多酚等。它们均具有一定的抗氧化能力,并且不同抗氧剂的机理各不相同[12-14]。因此,有必要寻找出一种最有效的抗氧剂。图1 为明胶分子的交联机制图,即明胶胶囊在制备和长期储存过程中会被空气氧化,明胶分子侧链的伯胺基被氧化成醛基,并易与其附近的伯氨基发生席夫碱反应,造成明胶交联,从而影响了胶囊产品的性能。
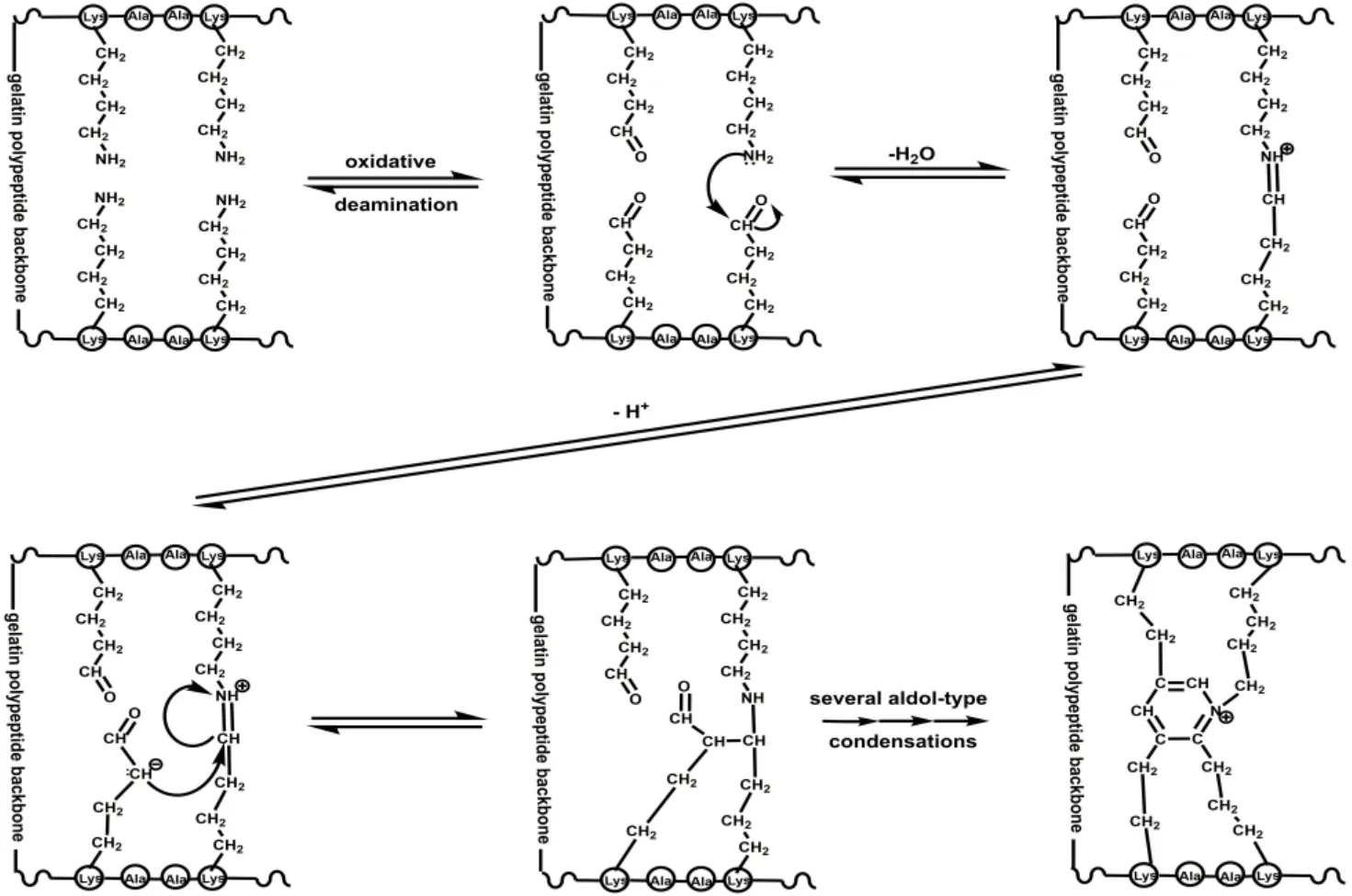
Fig.1 Crosslinking mechanism of gelatin molecules图1 明胶分子的交联机制
因此,我们设计将抗氧剂加入明胶胶囊来抑制伯胺基的氧化反应,减少醛基的产生。通过测定明胶胶囊中醛基的含量变化,筛选出最适宜的抗氧剂,这间接表征明胶交联的程度大小。本研究拟采用不同抗氧剂处理过的明胶胶囊,采用品红—亚硫酸法[15-17]和 2,4-二硝基苯肼法测定胶囊壳中的醛基,并以醛基浓度为指标,通过处方工艺优化筛选出最优的抗氧剂,这为抗交联明胶胶囊的开发提供了研究基础与科学依据。品红—亚硫酸法和 2,4-二硝基苯肼法的原理分别如图2、图3 所示。
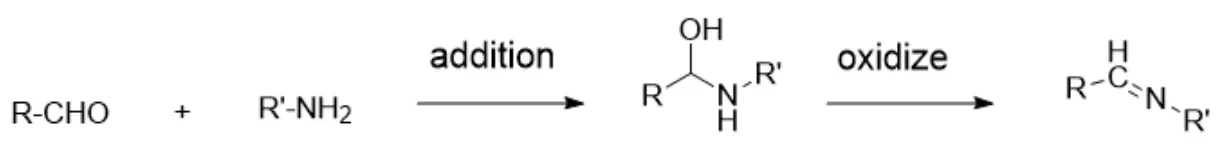
Fig.2 Principle of fuchsin-sulfite method图2 品红—亚硫酸法原理

Fig.3 Principle of 2,4-dinitrophenylhydrazine method图3 2,4-二硝基苯肼法原理
1 材料和方法
1.1 药物与试剂
明胶胶囊(浙江华光胶囊股份有限公司,2020 年生产,批号 P02001015);透明质酸(艾伟拓(上海)医药科技有限公司,平均分子量 3 kDa,批号 KH19003);茶多酚(天津希恩思生化科技有限公司,纯度 ≥ 98%,批号 C20PA0991A);白藜芦醇(天津希恩思生化科技有限公司,纯度 ≥ 98%,批号 W16031134701);谷胱甘肽(北京伊诺凯科技有限公司,纯度 ≥ 97%,批号G09050IK01);维生素E 醋酸酯(上海阿拉丁生化科技股份有限公司,纯度 ≥ 98%,批号 KYFDF68);维生素 C(上海阿拉丁生化科技股份有限公司,纯度 ≥ 99%,批号 KCEE709);焦亚硫酸钠(上海阿拉丁生化科技股份有限公司,纯度 ≥ 99%,批号 S112439);甘氨酸(阿拉丁试剂(上海)有限公司,纯度 >99%,批号 A110749);聚乙二醇1000 维生素E 琥珀酸酯(Tocopherylpolyethylene glycol succinate 1000,TPGS,巴斯夫中国有限公司上海分公司,批号 V819469);无水乙醇(上海麦克林生化科技有限公司,纯度 ≥ 99.7%,批号 E809061);2,4-二硝基苯肼(上海阿拉丁生化科技股份有限公司,纯度 ≥ 99%,批号 C2023038);甲醛溶液(上海阿拉丁生化科技股份有限公司,37% w/v,批号 C19PA28025A);其余试剂均为分析纯。
1.2 仪器
DF-101S 集热式恒温加热磁力搅拌器(巩义英峪予华仪器厂);EM120-HR pro 水分测定仪(瑞士普利赛斯称重设备有限公司);CS101-2ABN 烘箱(重庆康诚永生试验设备有限公司);TG16-WS 型台式高速离心机(湖南湘仪离心机仪器有限公司);UV2700 紫外可见分光光度计(岛津企业管理(中国)有限公司);TopPette 微量移液器(北京大龙兴创实验仪器有限公司);ME104E 型电子天平(梅特勒托利多科技(中国)有限公司)。
1.3 制备抗氧剂处理过的明胶胶囊
1.3.1 明胶胶囊水分测定
随机取 5 颗未处理的明胶胶囊,剪成小碎片,放入水分测定仪中测定水分,重复多次,每次测定的含水量在 13%~15% 范围内。
1.3.2 明胶胶囊的抗氧化处理
配制质量分数为 1% 的抗氧剂溶液,用移液枪移取 20 μL 抗氧剂溶液加入到胶囊壳中,用玻璃棒均匀涂抹内壁,每组制备 30 粒,将抗氧剂处理后的胶囊壳放入 40℃ 烘箱中,烘 8~10 min,之后随机取出 5 粒胶囊,剪碎后放入水分测定仪中测定水分含量,水分含量应符合未处理胶囊的水分范围区间。
1.4 品红—亚硫酸标准曲线的建立
0.1 g 的碱性品红固体溶解于少量的 80℃ 热水中,加入 10 mL 10% 亚硫酸氢钠溶液、1 mL浓盐酸,搅拌均匀。过滤,转移至 100 mL 量瓶中,加水定容。用滤纸过滤,贮存于8℃的冰箱中,放置 12 h 以上,待溶液颜色褪色为淡黄色,即显色剂制备完成,备用。接着将甲醛溶液稀释至 0.01 mg·mL-1,分别取 1.0、1.1、1.2、1.3、1.4、1.5 mL 甲醛稀释液于 EP 管中,加水至 5 mL后,加入 1 mL 显色剂,常温反应 40 min 后,以水作为空白溶剂,利用 UV2700 紫外—可见分光光度计分别对反应液进行 200~800 nm 全波长扫描,根据实验结果来确定最大吸收波长并建立标准曲线。表1 为品红—亚硫酸法试剂配比。
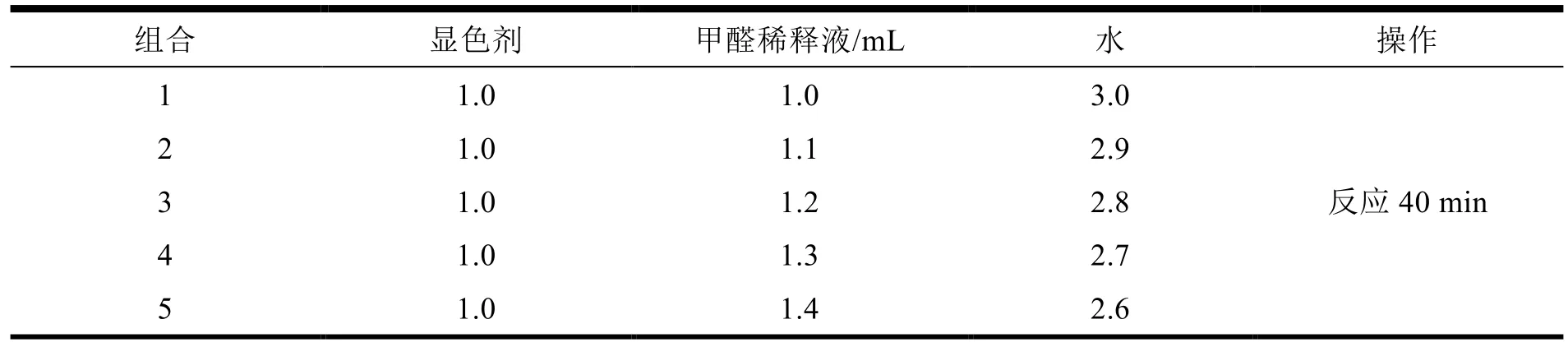
Table 1 Experimental steps of fuchsin-sulfite method表1 品红—亚硫酸法操作步骤
1.5 2,4-二硝基苯肼标准曲线的建立
A 溶液的配制:取 100 μL 37% 甲醛,加水至 10 mL,混匀后取 2 mL,加水至 8 mL,即为 1 mg·mL-1;从中取1 mL,加水至 10 mL,记为 A 溶液。
B 溶液的配制:称取0.2 g 2,4-二硝基苯肼,加入 60 mL 80℃ 的热水,溶解后加入 1 mL 浓盐酸溶液,加水至 100 mL,离心,取离心后的上清液至 100 mL 量瓶中,加水定容,记为 B 溶液。
C 溶液的配制:称取 10.0 g KOH 溶于 100 mL 水中,记为 C 溶液。
具体配比如表2 所示,以组合 1 作为空白溶剂,利用 UV2700 紫外—可见分光光度计对反应液进行 200~800 nm 的全波长扫描,根据实验结果来确定最大吸收波长并建立标准曲线。

Table 2 Experimental steps of 2,4-dinitrophenylhydrazine method表2 2,4-二硝基苯肼法操作步骤
1.6 加速实验确定明胶胶囊交联程度
1.6.1 品红亚硫酸法测定醛基含量
取 2020 年绿白胶囊壳若干,往壳体里加入 20 μL 水,用玻璃棒均匀涂抹内壁,放入 40℃ 烘箱中;在20、40、60、80、120、240、360、480 min 分别取出 10 粒胶囊壳,称取白色胶囊帽,加水溶解(加水量=壳体质量/ 0.5×15 mL);分别取 800、900、1 000、1 100、1 200 μL 溶解液于带编号的EP 管中,加水至5 mL,将EP 管放入离心机中,3 000 r·min-1离心 10 min;离心结束后,分别将上清液倒于另外 5 支相应编号的EP 管中,分别加入 1 mL 显色剂,常温反应 40 min 后,以水为空白溶剂,利用 UV2700 紫外分光光度计对反应液进行 200~800 nm 全波长扫描,记录最大吸收波长。
1.6.2 2,4-二硝基苯肼法测定醛基含量
取 2020 年绿白胶囊,往胶囊壳中加入 20 μL 水,用玻璃棒均匀涂抹内壁,放入 40℃ 烘箱;分别在 20、40、60、80、120、240、360、480 min 取出 15 粒,分别称取 0.6 g 白色胶囊帽,加入 15 mL 水溶解,溶出液离心(3 000 r·min-1离心 10 min)。取 0.15 mL 的溶出液,加入 3 mL B 溶液,60℃ 水浴加热 10 min 后,加入0.3 mL 无水乙醇、2.7 mL C 溶液后,定容至 15 mL;以水为空白溶剂,利用 UV2700 紫外分光光度计对反应液进行 200~800 nm 全波长扫描,记录最大吸收波长。
1.7 加速实验确定抗氧剂抗交联程度
1.7.1 品红亚硫酸法测定醛基含量
首先,采用 2020 年绿白胶囊,往白色胶囊体里加入 20 μL 质量分数为 1% 的抗氧剂溶液,用玻璃棒涂抹均匀,放入 40℃ 烘箱;在 20、40、60、80、120、240、360、480 min 分别取出10 粒,称取白色胶囊体,加水溶解(加水量为壳体质量/ 0.5×15 mL),分别取 800、900、1 000、1 100、1 200 μL 溶解液于带编号的EP 管中,加水至 5 mL,将 EP 管放入离心机中,3 000 r·min-1离心 10 min,离心结束后,分别将上清液倒于另外 5 支 EP 管中,加入 1 mL 品红—亚硫酸显色剂,反应 40 min 后,以水作为空白溶剂,利用 UV2700 紫外分光光度计对反应液进行 200~800 nm 全波长扫描,记录最大吸收波长,根据标准曲线计算出醛基的含量。
1.7.2 2,4-二硝基苯肼法测定醛基含量
首先,采用 2020 年绿白胶囊,往白色胶囊体里加入 20 μL 质量分数为 1% 的抗氧剂溶液,用玻璃棒涂抹均匀,放入 40℃ 烘箱;在 20、40、60、80、120、240、360、480 min 分别取出 10粒,称取白色胶囊体 15 粒,称取 0.6 g 胶囊体,加入 15 mL 水溶解,溶出液离心。取 0.15 mL 的溶出液,加入 3 mL B 溶液,60℃ 水浴加热 10 min 后,加入 0.3 mL 无水乙醇、2.7 mL C 溶液后定容至 15 mL,以水作为空白溶剂,利用 UV2700 紫外分光光度计对反应液进行 200~800 nm全波长扫描,记录最大吸收波长。
2 结果
2.1 明胶胶囊的水分
明胶胶囊的含水量见表3 所示。
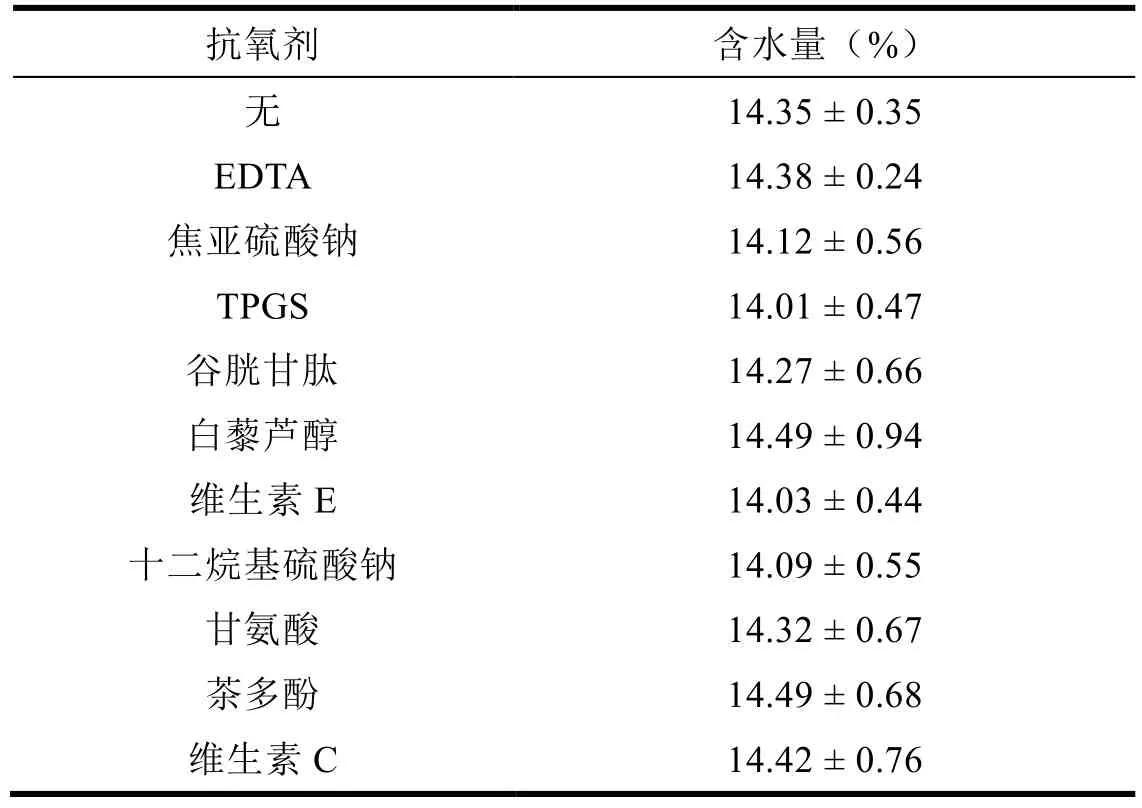
Table 3 Water content of gelatin capsules表3 明胶胶囊的含水量
2.2 品红—亚硫酸法标准曲线的建立
品红—亚硫酸法标准曲线样品见图4 所示。
Fig.4 Samples for the standard curve of fuchsin-sulfite method图4 品红—亚硫酸法标准曲线样品
根据 200~800 nm 紫外扫描结果表明,品红—亚硫酸显色剂在 580 nm 波长处有最大吸收峰。图5 为品红—亚硫酸法建立的标准曲线图,标准曲线为:A=56.726C -0.199,相关系数R2=0.999 7,甲醛浓度在 0.05~0.12 mg·mL-1内线性关系良好。

Fig.5 The standard curve of fuchsin-sulfite method图5 品红—亚硫酸法标准曲线
2.3 2,4-二硝基苯肼法标准曲线的建立
2,4-二硝基苯肼法标准曲线样品见图6 所示。

Fig.6 Samples for the standard curve of 2,4-dinitrophenylhydrazine method图6 2,4-二硝基苯肼法标准曲线样品
根据200~800 nm 紫外扫描结果表明,2,4-二硝基苯肼在 436 nm 波长有最大吸收峰。如图7所示,标准曲线为:A=894.42C -0.005 2,相关系数R2=0.987 1,甲醛浓度在 0.66~1.1 μg·mL-1内成一定的线性关系。

Fig.7 The standard curve of 2,4-dinitrophenylhydrazine method图7 2,4-二硝基苯肼法标准曲线
2.4 抗氧剂加速实验醛基含量变化
由表4 可知,表中所用的抗氧剂制备的抗氧化胶囊在加速实验中醛基含量均小于仅使用水制备的胶囊的醛基含量,说明这些抗氧化剂具有抗氧化能力,能够在明胶胶囊中发挥抗交联功能,但是它们抗交联的能力差异较大。这些抗氧剂抗交联能力由强到弱的顺序是:茶多酚>谷胱甘肽>透明质酸>焦亚硫酸钠>甘氨酸>维生素E>TPGS>白藜芦醇。
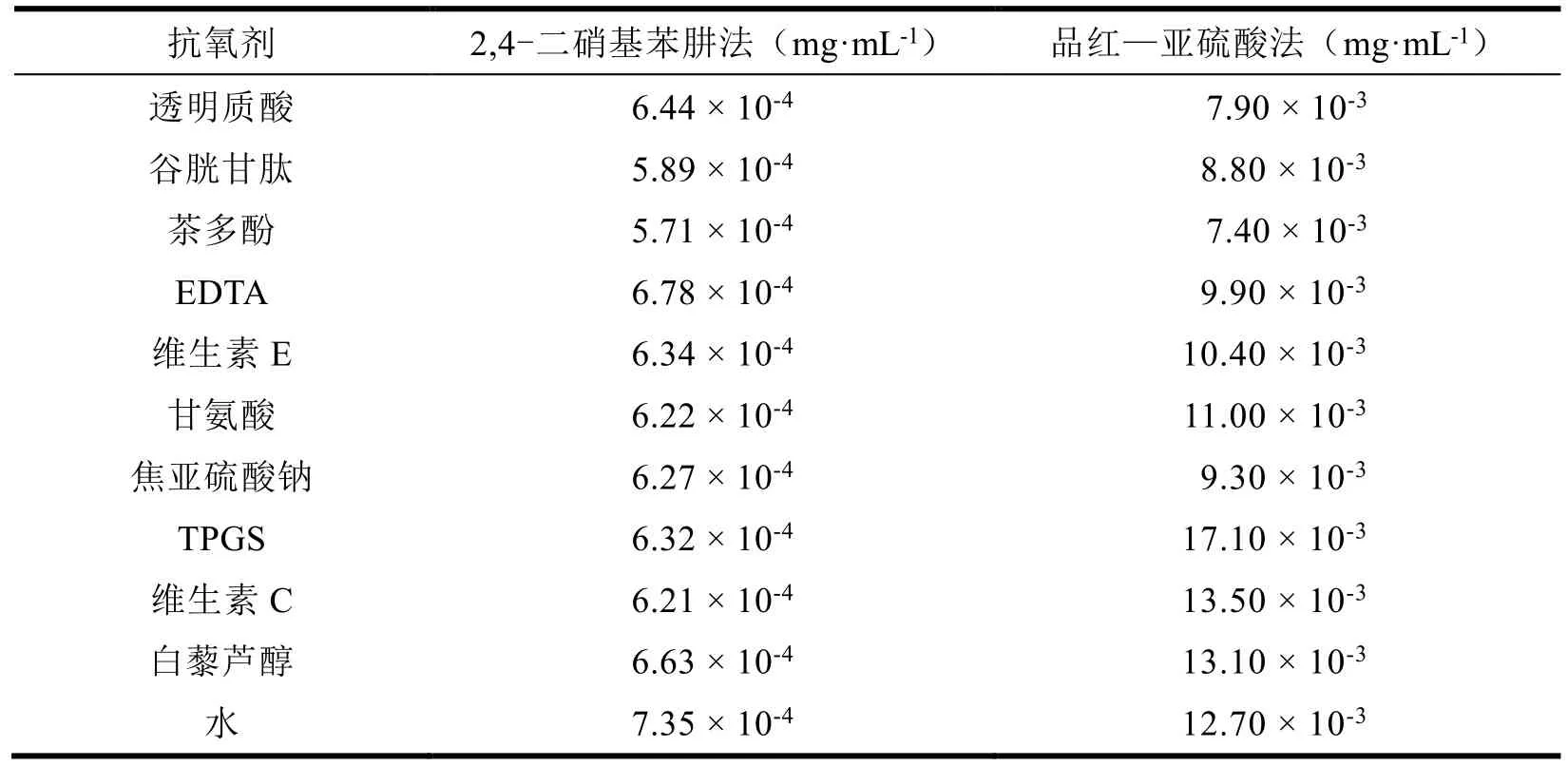
Table 4 Determination of aldehyde groups in gelatin capsules表4 明胶胶囊中醛基含量测定
3 讨论
由上述实验可以知道,2,4-二硝基苯肼法和品红-亚硫酸法均可测定胶囊中的醛基,每个方法测定的醛基含量不同,醛基可与苯肼或者亚硫酸品红试液发生一系列加成反应。通过分子重排反应生成有色物质,其颜色的深浅与样品中醛基的含量在一定线性范围内成正相关[18]。通过对两种方法所得实验结果的比较得出:2,4-二硝基苯肼法测得的实验数据波动和偏差较大。这是由于该方法的检测限比较高,灵敏度达不到要求,并且经过多次重复实验,2,4-二硝基苯肼标准曲线误差较大,即使得到较好的标准曲线,但是重现性也比较差;而品红亚硫酸法得到的标准曲线较精准,重复性较高,所以我们认为品红亚硫酸法具有较高的准确度。两种方法测定用抗氧剂处理过的胶囊的实验数据表明,茶多酚和甘氨酸抗氧化能力最强。因此,醛基含量是衡量明胶胶囊交联程度的一项重要指标之一,使用抗氧化剂可以解决明胶胶囊在储存过程中出现的交联问题,也可为胶囊壳生产工艺的优化提供可靠依据。
