pH 敏感型原位凝胶给药系统的研究进展
2023-11-15朱仔巍季醒兵秦建鹏王东凯
朱仔巍,季醒兵,秦建鹏,王东凯
(沈阳药科大学 药学院,辽宁沈阳 110016)
原位凝胶(In-situgel),又称在位凝胶,是一类以液态给药后,在给药部位发生溶胶—凝胶转变,形成半固体凝胶的制剂[1]。与传统凝胶制剂相比,原位凝胶具有给药方便、缓慢释药、生物相容性好等优点[2]。根据原位凝胶发生胶凝的触发条件不同,可将其分为温度响应型、pH 响应型、离子响应型和磁响应型等[3-7]。本文对 pH 敏感型原位凝胶的材料、胶凝机制、制备方法和药物递送中的应用进行归纳总结。
1 pH 敏感型原位凝胶材料
pH 敏感型原位凝胶材料一般含酸性或碱性基团,这些聚合物随着环境 pH 的不同而接受或释放质子。该类聚合物材料,利用体液具有的一定缓冲能力,根据溶液 pH 的变化,发生分散或构象转换,从而由液态转为凝胶态。近些年来,随着国内外研究者对 pH 敏感型原位凝胶材料的不断探索,该材料的种类和数量不断丰富。笔者就常见的丙烯酸类聚合物、壳聚糖类聚合物和醋酸纤维素酞酸酯聚合物进行概述。
1.1 丙烯酸类聚合物
丙烯酸类聚合物材料中,卡波姆(Carbomer/Carbopol®,CP)类产品最具代表性(图1)。CP 具有疏松、稍有臭味、较强吸湿性等特点[8]。由于 CP 分子中含约 56%~68% 的羧酸基团,可在酸性条件下收缩,在碱性条件下膨胀而形成一定粘度的凝胶。当 pH >5.5(CP 的 pKa 为 5.5)时,会发生溶胶—凝胶转变。研究表明,CP 在 pH 6~12 时粘度最大[9]。CP 的常用浓度为 0.1%~3%;CP 常用型号有 934、934P、940、974P、980 等,不同型号的流变性、粘度和清澈度等会有不同,应根据制剂需要选择适宜的型号。通常,CP 达到 pH 响应的阈值浓度较高,且其酸性较强,易产生局部刺激性,一般不单独使用。CP 常与其它环境敏感型聚合物或增稠剂联用,以达到减少其用量、降低刺激性和改善胶凝能力等目的。Gupta 等[10]将 0.4% CP 与 0.5% pH 敏感材料壳聚糖混合,制备马来酸噻吗洛尔 pH 敏感型眼用凝胶。体外释放研究显示,体外释药时间超 24 h,说明该制剂具备长效释药特性。Wu 等[11]将 CP 与增稠剂羟丙甲纤维素(HPMC)联合使用,制备了眼用黄芩苷 pH 敏感原位凝胶剂。结果显示,与黄芩苷滴眼液相比,原位凝胶剂的 AUC 为前者的 6.1倍,说明原位凝胶剂具有更高的生物利用度。

Fig.1 The chemical structure of carbomer图1 卡波姆结构
聚卡波非(Polycarbophil/Noveon®,PCP),是聚丙烯酸与二乙烯乙二醇的交联物,因含有羧基而具备 pH 响应特性。Sharma 等[12]以 PCP 和 CP-980 为 pH 敏感凝胶基质,负载抗菌药氟康唑,制备眼用原位凝胶剂。体外结果表明,该制剂药物释放动力学符合 Higuchi 模型,体外缓慢释药长达 7 h。
将丙烯酸(Acrylic acid,AA)类与其它单体或聚合物共聚,也可得到丙烯酸类 pH 敏感型原位凝胶材料。Nasir 等[13]制备了以泊洛沙姆 407(P407)-聚丙烯酸为凝胶基质的 pH 敏感型原位凝胶。研究结果表明,该制剂在 pH 6.8 时可发生胶凝,具有良好的热稳定性和生物相容。Samiullah等[14]针对结肠癌的基本环境,制备了具有良好 pH 敏感特性的羧甲基壳聚糖—聚丙烯酸凝胶材料,并以此为凝胶基质,负载抗癌药 5-氟尿嘧啶,提供了一种口服靶向治疗结肠癌的新思路。体外研究表明,该制剂延长了药物的释放,解决了 5-氟尿嘧啶半衰期短的问题,但药物体内释放情况还有待考察。
1.2 壳聚糖及其衍生物
壳聚糖(Chitosan,CS)是碱性条件下甲壳素脱乙酰基后的氨基多糖(图2)。CS 作为高分子材料,由于具备较低的免疫原性和细胞毒性、多种生理活性以及较好的生物相容性和可降解性等明显优势,广泛应用于医药领域[15]。CS 可在碱性条件下膨胀,在酸性条件下收缩,在水中能形成阳离子凝胶网络,展现出对 pH 的响应性[16]。CS 仅溶于酸性溶液,这一特性限制其应用,经修饰或与其它聚合物联用的 CS 可显示出更好的 pH 敏感性和环境响应性[17]。Saurabh 等[18]制备了以 CS 和增稠剂——单油酸甘油酯(GMO)为混合基质的紫杉醇 pH 敏感原位凝胶。该递药系统可用于持续和靶向递送抗癌药物。可在生理 pH 条件下发生胶凝,具有较强的生物粘性和靶向缓释性。
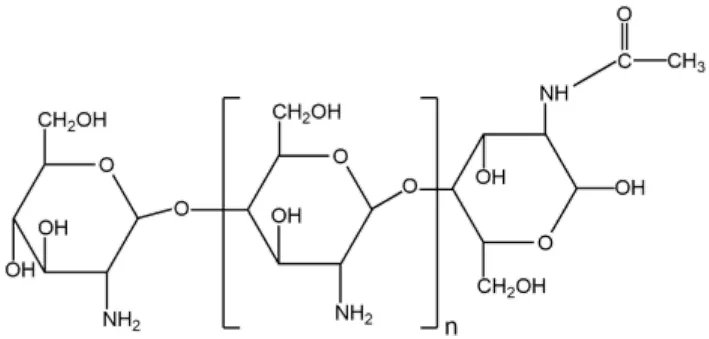
Fig.2 The chemical structure of chitosan(R=H or COCH3)图2 壳聚糖结构(R=H 或 COCH3)
羧甲基壳聚糖(Carboxymethyl chitosan,CMCS)是 CS 的衍生物,壳聚糖中羧基的引用既改善了水溶性,又使其成为良好的环境敏感材料[19]。郑施施等[20]通过钙离子交联法制备了 pH 敏感的磺胺嘧啶钠 CMCS 凝胶。CMCS 弥补了 CS 只溶于酸性溶液的不足,使得碱性药物——磺胺嘧啶可以很好地溶于凝胶基质中。
羧甲基己酰化壳聚糖(Carboxymethyl hexanoyl chitosan,CHC)是一种两亲性 CS 衍生物,其分子骨架同时具备亲水性基团——羧甲基和疏水性基团——己酰基,并同时含有酸性基团——羧甲基和碱性基团——氨基。CHC 的两亲性赋予了该聚合物独特的物理性质,使其能够通过疏水—亲水相互作用和静电络合反应形成凝胶。因此,通过调节 pH,可中和氨基而使其聚集、缠绕形成超分子聚集体,最终发生溶胶—凝胶转变。Lu 等[21]以 CHC 和关节软骨重要成分透明质酸(HA)为材料,负载抗菌抗炎药小檗碱,制备 pH 响应的小檗碱原位凝胶,用于注射治疗骨关节炎。结果表明,该凝胶可潜在地应用于关节内药物递送和软组织工程的可注射系统。
1.3 醋酸纤维素酞酸酯
醋酸纤维素酞酸酯(Cellulose acetate phthalate,CAP)又名纤维醋法酯(图3),亦为 pH 敏感型在体凝胶的常用材料之一[22]。CAP 是部分乙酰化纤维素的酞酸酯,含乙酰基和酞酰基,含有一定的酸性基团而可以对 pH 的变化做出响应。Gumy 等[23]制备了毛果芸香碱纤维醋法酯 pH敏感的眼用原位凝胶。CAP 水分散体(30%)在 pH 5 以下时为低粘度、自由流动的溶液;在 pH升高到 7 左右时,聚合物吸水膨胀,分子间相互缠结,即刻发生胶凝。CAP 亦可与其它聚合物联用而合成新的生物材料。Mohammad 等[24]为了解决聚合物与药物之间的作用力较弱的问题和药物释放过程中的突释问题,合成了一种 pH 敏感的凝胶生物材料聚乙烯醇(PVA)-CAP。体外溶出实验表明,该复合材料在水中分散良好,且 pH >6.5 时溶出度较好。抗菌实验表明,该材料对抑制革兰氏阴性大肠埃希菌和革兰氏阳性金黄色葡萄球菌有效。该生物材料为一些抗生素和伤口愈合药的缓控释递送提供了一种新型递药载体。

Fig.3 The chemical structure of cellulose acetate phthalate (R=H,COCH3 or COC6H4COOH)图3 醋酸纤维素酞酸酯结构(R=H,COCH3 或 COC6H4COOH)
2 pH 敏感原位凝胶的胶凝机制
pH 敏感原位凝胶的胶凝机制主要与高分子聚合物的质子化效应和分子间作用力有关。pH 敏感原位凝胶聚合物的共同特征是存在可离子化的 pH 响应基团,如羧基、羧甲基、氨基等。含有酸性基团的聚合物为阴离子型 pH 敏感原位凝胶材料,最具代表性的材料是带有羧基的聚合物如丙烯酸类聚合物,在碱性条件下,其分子侧链上的羧基发生去质子化作用,转化为分子链间具有静电斥力的阴离子聚电解质,在斥力作用下,分子链膨胀、相互缠结,发生胶凝;在酸性条件下,羧基发生质子化作用变成不带电的聚合物分子,形成自由流动液体(见图4)。含有碱性基团的聚合物为阳离子型 pH 敏感原位凝胶材料,其典型代表为含氨基的聚合物,如壳聚糖类聚合物,该聚合物在碱性条件下释放质子,形成不带电的聚合物,侧链上的氨基与分子链上的羟基间存在较强的氢键作用,聚合物间发生缔合,使得聚合物沉淀形成凝胶;高分子材料在酸性条件下接受质子而带有正电荷,静电斥力破坏或分解晶体的致密结构,溶液呈低粘度透明状[25]。
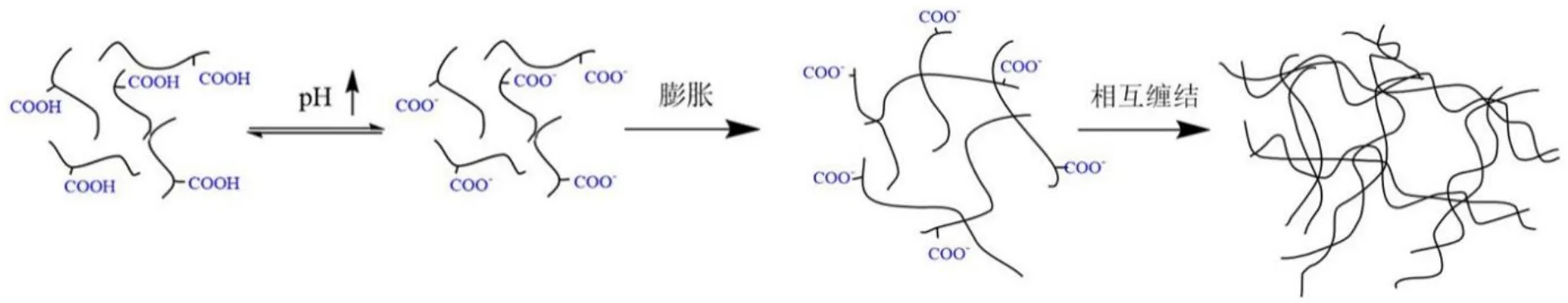
Fig.4 The gelation mechanism of pH-sensitive in-situ gels (containing carboxylic acid groups)图4 pH 敏感原位凝胶(含羧基)的胶凝机制
3 pH 敏感型原位凝胶的制备
目前,pH 敏感型原位凝胶的制备方法有冷溶法、接枝共聚、化学交联和共混或半互穿凝胶网络。冷溶法是物理方法制备混合的 pH 敏感原位凝胶基质,接枝共聚、化学交联和共混或半互穿凝胶网络是化学方法制备 pH 敏感原位凝胶基质。应根据药物性质和制剂需求,选择合适的制备方法制备 pH 敏感原位凝胶。
3.1 冷溶法
冷溶法是指将聚合物置于 4℃ 条件下搅拌,使其充分溶解,然后置于 4~10℃ 冰箱中充分溶胀至澄清溶液。Ni 等[26]用冷溶法,将 CP 和 HPMC 分散在去离子水中,并在 4°C 下溶解。溶胀后,加入乙二胺四乙酸(EDTA)和甘露醇以及熊胆汁的混合物。最后,用三乙醇胺(20%)调节熊胆汁制剂的 pH(5.0±0.1),制得 pH 敏感型熊胆汁眼用原位凝胶。
3.2 接枝共聚
接枝共聚是一种高分子聚合物主链通过一个或多个自由基嫁接上与主链不同的其它聚合物的侧链的聚合反应。Peppas[27]将聚甲基丙烯酸(MAA)与聚乙二醇(PEG)接枝共聚,得到的网络结构共聚物表现出可逆的 pH 响应溶胀,以 MAA/PEG 为凝胶基质负载胰岛素。实验结果表明,胰岛素凝胶可诱导持续的降血糖效应,且其效应与剂量有关。
3.3 化学交联
化学交联是利用光、辐射、交联剂等引发反应,与原有网络交联形成化学键的凝胶技术。Zhao等[28]以甲基丙烯酸酯修饰后的β-环糊精为交联剂与热敏性聚合物N-异丙基丙烯酰胺(NIPAAM)和 pH 敏感性聚合物 AA 聚合,合成聚(NIPAAM-co-AA)。结果表明,该凝胶制剂具有 pH 和温度双敏感响应特性。
3.4 共混或半互穿凝胶网络
共混或半互穿凝胶网络是多种交联聚合物之间无共价键结合,通过相互贯穿或缠结而形成的一类聚集态结构的高分子聚合物,通常具有较高的胶凝速率和凝胶强度以及良好的生物相容性[29]。崔莉等[30]以京尼平为交联剂,制备 CMCS/海藻酸钠(SA)半互穿凝胶网络。结果表明,在一定范围内,交联剂浓度越大,CMCS 与 SA 的交联度越大。
4 pH 敏感型原位凝胶的应用
4.1 黏膜给药
4.1.1 眼部给药
理想的眼部制剂是能够在眼部病灶处获得最佳的活性药物浓度的制剂。目前,眼用制剂中 90%以上为溶液型滴眼剂和眼膏剂。事实上,常规滴眼液局部给药后,仅一小部分药物在病灶处被吸收。这是因为多种消除机制的存在[31],导致眼部生物利用度低至 5%~10%。这些消除过程包括泪液周转、鼻泪引流、蛋白结合、全身吸收、酶降解和复合渗透屏障[32-34]。原位凝胶眼部给药系统[23]可以通过延长眼部滞留时间,减少这些消除效应,增加吸收,降低给药频率,实现缓慢释药,提高生物利用度。Ranch 等[35]以 0.35% CP-934P 和离子敏感材料 0.55% 结冷胶(GG)为凝胶基质,制备了 pH/离子敏感的盐酸奥洛他定凝胶。体内研究表明,该原位凝胶剂在兔眼内释放长达 3 h,而市售滴眼液的体内释放仅有 1 h;原位凝胶剂的眼内滞留时间是滴眼液的 3 倍左右,长达(15.0±2.5)min。说明原位凝胶制剂可实现更长的眼部滞留时间和更低的给药频率。Ni 等[36]以 CP-974 和 HPMC-K4M 为凝胶材料,制备了负载熊胆汁的 pH 敏感原位凝胶。结果显示,该凝胶制剂药物体外释放时间长达 160 min,体内滞留时间为滴眼液的 3 倍多,长达 28 min。Barse 等[37]以 CP-974P 和 HPMC-K4M 为凝胶基质,制备了治疗青光眼的酒石酸溴莫尼定 pH敏感原位凝胶。体内研究结果表明,市售滴眼液可使眼压降低(13.38±4.42)%,持续时间仅 2~3 h,而原位凝胶剂可使眼压降低(45.71 ±4.72)%,持续时间高达 8 h。
4.1.2 鼻腔给药
鼻腔内鼻黏膜的纤毛运动使得液体制剂在鼻黏膜中滞留时间仅有 15~30 min,半固体制剂虽滞留时间长,但存在给药不方便、剂量不准确等问题。鼻用原位凝胶剂将二者结合,扬长避短,具有良好的组织相容性和生物粘附性。Chen 等[38]制备了石杉碱甲微乳 pH/温度鼻用原位凝胶。筛选得到最优处方为 0.65% CP、20.41% 的温敏材料 P407 和 1.58% 的温敏材料泊洛沙姆 188(P188),该制剂在生理温度和 pH 下发生胶凝,可用于治疗阿尔兹海默症。体内药动研究表明,在相同给药剂量下,该原位凝胶剂的 AUC 是注射剂的 1.2 倍,原位凝胶剂相对地提高了药物进入脑组织的药量,更有益于脑部疾病的治疗。鼻腔内给药是药物脑靶向的一条较好的途径,其可以绕过血脑屏障而提高生物利用度。Yan 等[39]制备了磷酸川芎嗪(TMPP)pH 敏感原位凝胶,对TMPP 的溶液剂和原位凝胶剂的经鼻给药后在大鼠血液和脑中的药代动力学进行研究。结果表明,二者的脑部 TMPP 的ρmax均高于血液中 TMPP 的ρmax,展现了 TMPP 经鼻—脑靶向的优越性;脑部的 AUC 结果显示,溶液剂明显低于凝胶剂,分别为(615.4±71.2)μg·min·mL-1、(801.4±67.5)μg·min·mL-1,体现了凝胶剂改善生物利用度的优势。Sherje 等[40]将治疗精神分裂的帕利哌酮(PLPD)包裹于羟丙基-β-环糊精(HP-β-CD)中,置于 0.2% CP-934 和 0.4% HPMC-K4M 的 pH 响应原位凝胶基质中,最终制得原位凝胶剂。结果显示,PLPD 原位凝胶剂与 PLPD 包合物原位凝胶剂在 4 h 内分别有(56.28± 4.20)% 和(74.69±3.49)% 的 PLPD 被渗透,且二者均表现出长达 6 h 的药物释放。表明包合物可改善 PLPD 的水溶性和渗透性,且原位凝胶剂具有缓释特性。
4.1.3 阴道给药
与口服给药相比,阴道给药局部浓度高,治疗效果好,可避免首过效应、毒副作用低。目前,常用的阴道给药剂型有固体制剂、液体制剂和半固体制剂。固体制剂在阴道内涂布易出现分布不均匀现象;液体制剂分布均匀但附着性差;半固体制剂附着性好,但存在给药不方便、易出现给药死角等问题。原位凝胶取三者之优点,具有良好的组织相容性、分布均匀性、生物粘附性和药物缓释特性,具备给药方便、低给药频率等优势。阴道用原位凝胶可大大提高患者的顺应性。正常生理状态下,阴道 pH 为 4 左右,当发生疾病,如阴道炎时,pH >4.5,根据 pH 值的不同可实现 pH 敏感型原位凝胶的阴道给药。胡晓[41]制备了用于治疗霉菌性阴道炎的 0.9% 制霉菌素pH 响应型原位凝胶,筛选得到最优处方为:0.655% CP-980NF、1.213% 成膜剂 PVA-203、10%增塑剂甘油和 0.09% 防腐剂尼泊金甲酯。该制剂在非生理条件(pH=3.8)下为自由流动液体,易于阴道给药;在生理条件(pH=4)下可发生胶凝,在病理条件(pH=4.6)下可形成强度更大的凝胶。大鼠阴道药动学研究表明,原位凝胶剂的阴道滞留时间为普通泡腾片滞留时间的 1.74 倍。
4.1.4 口腔给药
口腔黏膜递药系统经口腔黏膜给药吸收后,发挥局部或全身治疗作用,可分为舌下黏膜给药、颊黏膜给药和局部给药。降低口腔黏膜给药吸收的主要生理因素是唾液的冲洗作用。口腔黏膜原位凝胶剂利用其生物粘附性可克服此缺点,提高生物利用度。与凝胶制剂相比,其溶胶—凝胶特性使得给药更为方便。口腔黏膜炎是癌症治疗中的常见并发症之一,通常采用含局部麻醉药的口腔含漱液来缓解口腔黏膜炎的症状,但该剂型存在起效时间短、需频繁给药的问题。Li 等[42]开发了一种室温下喷洒,在与口腔黏膜接触时可发生胶凝的长效镇痛制剂。以 pH 敏感材料 CP 和PCP、温敏性材料 P407 和 P188 为凝胶基质负载麻醉药布比卡因γ-亚油酸酯,制备了 pH/温度敏感的原位凝胶剂。体外释放研究显示,药物在病理条件下(pH 5.8)比在生理条件下(pH 7.4)释放的快,表明口腔黏膜炎越严重,药物起效越快。该制剂在口腔黏膜炎止痛中具有很好的应用前景。Nief 等[43]以 CP-934 和 HPMC-K4M 为凝胶基质,制备了治疗口咽念珠菌病的伊曲康唑pH 敏感口腔黏膜原位凝胶剂,发现 HPMC-K4M 浓度的增加会减慢药物的体外释放速率。这可能是由于 HPMC-K4M 的高水溶性会产生额外的渗透梯度,导致聚合物溶胀速度更快、凝胶厚度更大。筛选得到最优处方:0.7% CP-934 和 1.5% HPMC-K4M,该处方的制剂体外释放时间超 6 h。
4.2 注射给药
原位凝胶的组织定位性强,可减小其它部位的药量而减小全身不良反应,长效释药,降低给药频率,提高患者的顺应性[44]。可注射原位凝胶系统(injectablein-situgelling depot systems,IISGDS)利用注射器注入机体内部,在给药部位即刻胶凝,具有高生物相容性、生物可降解性、易于制造、保护生物制品和缓释等优点,是一种潜在的开发剂型[45]。
骨关节炎具有滑膜炎症、软骨退变和关节疼痛等症状。目前,骨关节炎的最常用的药物治疗方式为口服非甾体抗炎药,该方式可以达到较高的血药浓度,但同时存在全身不良反应较大的问题。迄今为止,该疾病最好的治疗方式为注射给药,但美中不足的是,组织的致密和带负电荷的细胞外基质的阻碍使药物快速消除,因此,药效受到限制[46]。通常,可用脂质体、纳米粒或原位凝胶等剂型来延缓药物释放,由于前两者制备成本较高,因此,注射用原位凝胶在骨关节炎治疗方面具有很大潜力[47]。Lu 等[21]提供了一种利用关节内给药的可注射 pH 敏感原位凝胶系统来治疗骨关节炎的思路,以 CHC 和 HA 为基质材料,制备小檗碱原位凝胶剂。结果表明,该制剂在发炎的关节软骨(pH 6.0)下持续缓慢释放小檗碱,在正常组织(pH 7.4)下小檗碱降解速率加快,该制剂具有 pH 响应释放特性。
除骨关节外,骨质疏松和骨缺失亦是常见的骨骼疾病。Skhekhawat 等[48]以 1.25% CS 为凝胶基质,4%β-甘油磷酸二钠(β-GP)为缓冲剂,制成可生物降解的辛伐他汀原位凝胶。CS 与甘油磷酸盐联用展现出了温敏特性,在生理 pH 和体温条件下可实现胶凝化。体外研究显示,该制剂7 天内体外药物释放率为(98.7±1.5)%,具有一定的缓慢释药的优势。Kocak 等[49]提出了一种用于骨再生的药物递送途径,以 CS、羟基磷灰石(HAP)为 pH/温度敏感凝胶基质,并负载肝素(Hep),制备了诱导血管生成的新型可注射凝胶(CS-HAP-Hep)。结果表明,该制剂在较低浓度 Hep 下,依然可以在促血管生成反应中表现出很高的效率。CS 与 HAP 可作为双敏感基质,一方面 CS 的 pH 响应性,另一方面可能是 CS 与含羟基和磷酸基团的 HAP 可形成温敏凝胶,低温条件下,在氢键作用下聚合物链段分离,避免其相互缠绕;升温后,氢键作用被破坏,分子链间的疏水作用促使其发生胶凝。
牙周炎是常见的细菌感染性疾病,炎症过度增生和组织的破坏,致使微生物和食物残渣堆积而形成牙周袋。传统的口服给药,很难达到有效浓度,而频繁的给药会导致机体其它部位的不良反应及耐药性。原位凝胶剂则可以克服此缺点。Inayathulla 等[50]联合使用抗菌和抗炎药治疗牙周炎,以 CP 和 HPMC 为 pH 敏感的凝胶基质,制备了含利奈唑胺和双氯芬酸钠的局部可注射原位凝胶。该注射制剂的药物体外释放可延长至 12 h,但发现前 2 h 的体外释药达 35%。药物的初期突释可能与凝胶基质的水溶性有关,凝胶化时的基质已经发生水合作用,水合作用和水渗透作用对限制药物释放的作用较小。Nasra 等[51]以 1% CP-934 和 30% 温敏性材料 P407 为 pH/温度敏感凝胶基质,负载有抗菌抗炎功效的姜黄素,制备了 2% 的姜黄素可局部注射的原位凝胶。体外研究表明,该制剂体外持续释药长达 1 周,其释药时长是姜黄素乙醇溶液的 6 倍左右,该制剂具有缓释特性;临床初步试验显示,给药一月后,患者的牙周袋深度缩小,牙周出血明显减少,牙龈上的斑块减少。该制剂在治疗牙周病方面具有一定疗效。
4.3 口服给药
口服给药原位凝胶经胃肠道入血而发挥药效。胃肠道由胃至肠道,酸性递减,利用 pH 的不同,可延长药物在胃部或肠道[14]的滞留时间,实现靶向缓慢释药。郑施施等[20]提供了一种口服—肠靶向的思路,为解决磺胺嘧啶钠在胃部水解成磺胺嘧啶而产生胃刺激的问题,制备了 pH 敏感的磺胺嘧啶凝胶。体外释放结果表明,该制剂在酸性条件下释放缓慢,而在中性或碱性条件下释放较快。利用某些离子敏感原位凝胶材料亦可发生 pH 刺激下的溶胶—凝胶转变[52]。Madan 等[53]以离子敏感型聚合物 SA 为凝胶基质,氯化钙为络合剂,HPMC-K100M 为增稠剂,制备了口服的普瑞巴林原位凝胶。该原位凝胶在胃部 pH 条件下转变为凝胶,在胃内漂浮或粘附在胃黏膜上,增加了胃部滞留时间,延了长药物在胃肠道的输送,实现了抗癫痫药物普瑞巴林的缓慢释放,药物释放长达 12 h。在中性或碱性条件下,Ca2+以络合态存在,不与凝胶基质发生物理交联;在胃液的 pH 条件下,Ca2+变为游离态,SA 对 Ca2+做出响应,形成凝胶。
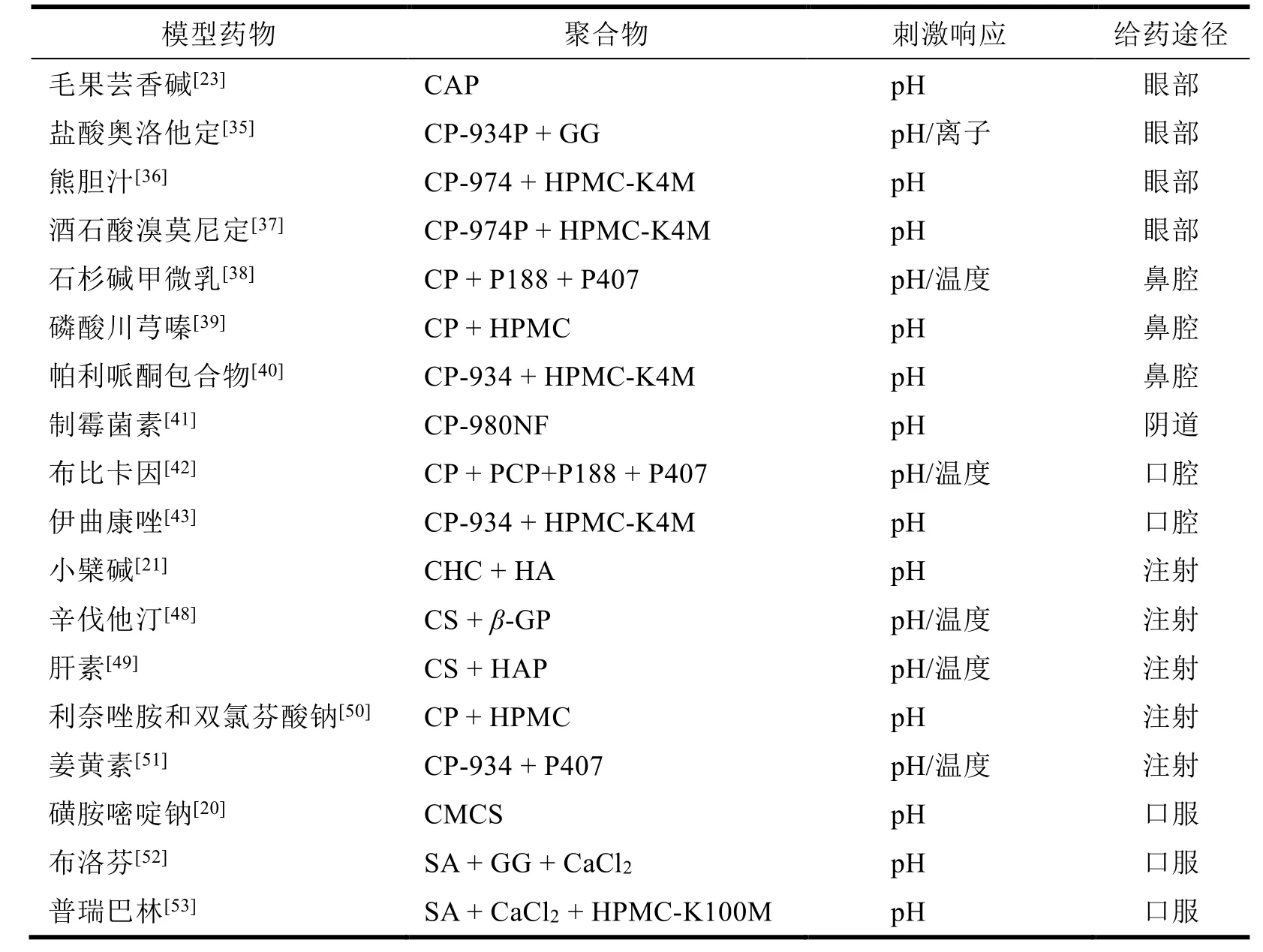
Table 1 The application of pH-sensitive in-situ gels表1 pH 敏感原位凝胶的应用
5 pH 敏感型原位凝胶给药系统的优势与劣势
5.1 优势
首先,pH 敏感原位凝胶作为原位凝胶的一种,其递药系统具备环境响应型原位凝胶递药系统的共同优点:①具有良好的生物相容性;②具有溶胶—凝胶特性,使药物粘附于组织间隙,滞留时间长;③具有良好的缓控释放药物的特性;④组织定位性强,减小全身不良反应;⑤具备制备简单、便于量化生产和运输方便等优势。
其次,pH 敏感型原位凝胶除了自身含有酸性或碱性基团的聚合物会对 pH 的变化直接做出响应外,一些离子敏感型原位凝胶材料还可以通过 pH 的不同,释放或结合某些金属阳离子[54],而对离子做出响应。在酸性条件下,某些金属阳离子会从络合物中释放出来,使得离子敏感材料(如 GG、SA 等)在游离金属离子存在的刺激下发生胶凝。
另外,pH 敏感原位凝胶与温度敏感型原位凝胶相比,所需要的环境响应性聚合物浓度更小、局部刺激性更小、成本较低。且温度敏感型原位凝胶的溶胶—凝胶转变受温度影响,因此其储存温度相对于 pH 敏感原位凝胶的储存温度更受到限制。
5.2 劣势
与其它环境敏感型原位凝胶相比,一方面,pH 敏感型原位凝胶材料对离子型药物的效用有限,该类聚合物是离子电解质,可能会与某些离子型药物形成不溶性络合物,影响药物作用效果;另一方面,pH 敏感型原位凝胶制剂的 pH 与药物起效部位的 pH 有差异,易产生局部刺激性。pH 敏感原位凝胶作为一种新型药物递送系统,其研究仍处于初级阶段,一些问题还有待解决。例如,该给药系统存在凝胶后,因形状不固定导致的药物释放速率相差过大、体内降解代谢过程的不确定性和注射给药的药物突释等问题。
6 结语
pH 敏感原位凝胶由于具有在生理或病理 pH 条件发生溶胶—凝胶转变的特性,在制备、给药途径选择、缓控释药、生物利用度等方面显示出一定的优势。pH 敏感型材料可以与其它环境敏感材料相结合,制备双敏感或三重敏感的原位凝胶制剂,这些制剂具有更好的环境响应性。pH敏感原位凝胶还可作为药物递送体的载体(如包合物、微球、纳米粒和脂质体等载体)的 pH 敏感原位凝胶,这些制剂可以充分发挥出两种给药系统的优势。
近年来,随着国内外研究者对 pH 敏感原位凝胶的深入研究,pH 敏感原位凝胶在药物递送方面取得了很大进展。但其作为一种新型给药系统,一些研究仍处于初步阶段,一些问题还有待解决。相信随着技术不断进步和生物材料的不断丰富,pH 敏感原位凝胶产品也将为医学诊断和治疗带来突破性的进展,造福人类。
